ĐỀ SỐ 5
SỞ GD&ĐT ………………
KIỂM TRA HỌC KỲ I NĂM HỌC 2022-2023
TRƯỜNG THPT ……………………
Môn thi: Hoá học – Khối: 10
Thời gian làm bài: 45 phút Đề thi chính thức
(Đề thi gồm 28 câu trắc nghiệm và 3 câu tự luận) Mã đề thi: 130
Họ và tên học sinh:……………………………………………….. Lớp:……… SBD: ………………
PHẦN I. TRẮC NGHIỆM
Câu 1: Hạt nhân của hầu hết các nguyên tử (trừ H) được tạo nên từ
A. proton và electron.
B. electron và neutron. C. proton và neutron. D. proton.
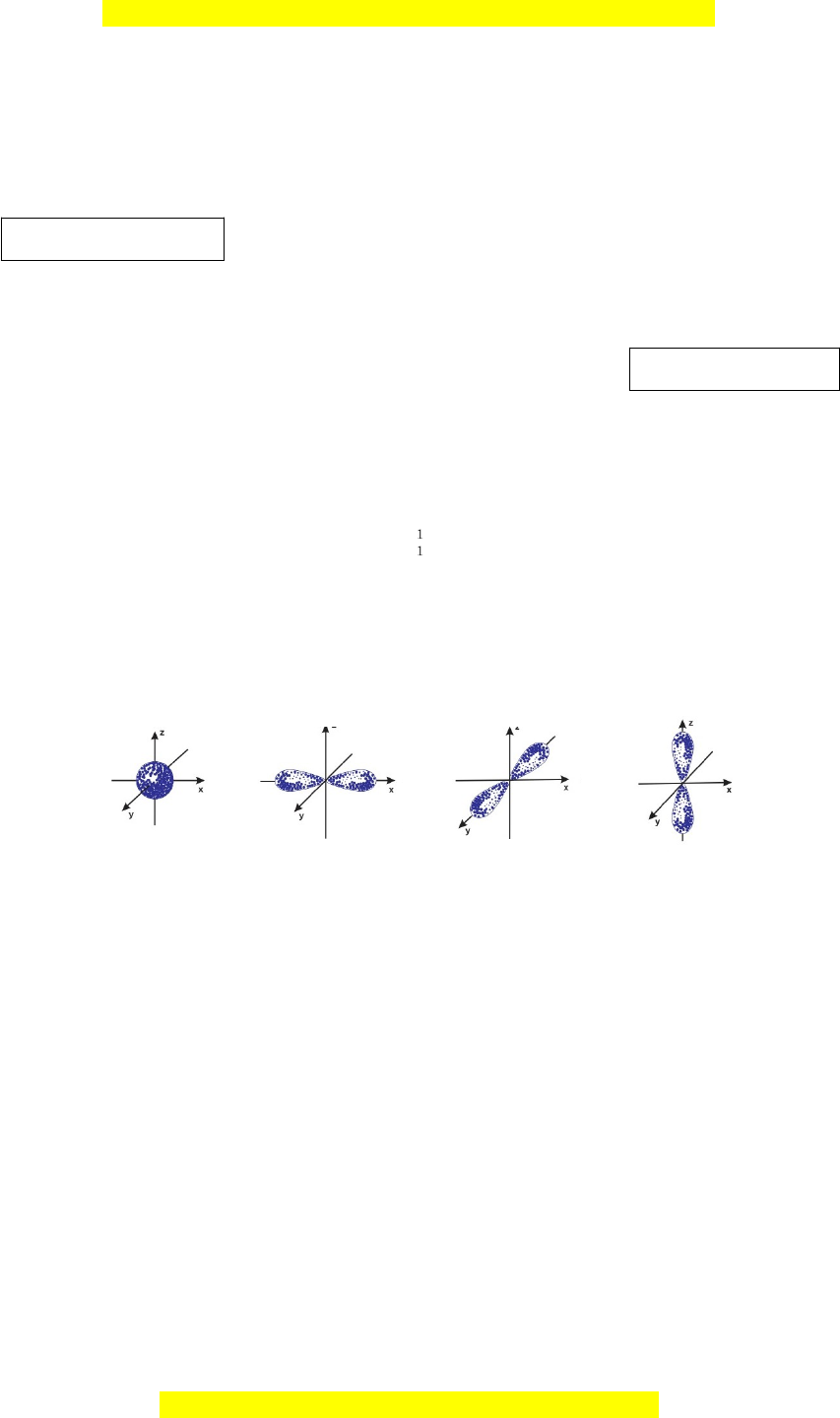
Câu 2: Hình bên là mô phỏng của AO 1 2 3 4
Đâu là hình mô phỏng của AOp A. 1; 2; 3. B. 2; 3; 4. C. 1; 3; 4. D. 1; 2; 4.
Câu 3: Số phân lớp electron tối đa trong các lớp K, L, M, N lần lượt là A. 1, 4, 9 và 16. B. 1, 2, 3 và 4. C. 2, 6, 10 và 14. D. 2, 8, 18 và 32.
Câu 4: Số nguyên tố trong chu kì 3 và 5 của bảng tuần hoàn lần lượt là A. 8 và 18. B. 2 và 8. C. 8 và 8. D. 18 và 32.
Câu 5: Trong một chu kì, đại lượng nào sau đây không biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân?
A. Bán kính nguyên tử.
B. Hóa trị trong công thức oxide cao nhất.
C. Độ âm điện của nguyên tử.
D. Số lớp electron trong nguyên tử.
Câu 6: Trong một nhóm A (trừ nhóm VIIIA), theo chiều tăng của điện tích hạt nhân nguyên tử thì
A. tính kim loại tăng dần, độ âm điện tăng dần.
B. tính phi kim giảm dần, bán kính nguyên tử tăng dần.
C. tính acid giảm dần, tính phi kim tăng dần.
D. tính kim loại tăng dần, tính base giảm dần.
Câu 7: Cho mô hình nguyên tử của X.
Công thức hợp chất khí của X với hydrogen là A. XH2. B. XH4. C. XH. D. XH3.
Câu 8: Nguyên tố X thuộc nhóm VIIIA của bảng tuần hoàn. Cấu hình electron lớp ngoài cùng
của nguyên tử nguyên tố X là A. ns2np5. B. ns2np3. C. ns2np1. D. ns2np6.
Câu 9: Theo quy tắc octet, khi hình thành liên kết hóa học, các nguyên tử có xu hướng nhường,
nhận hoặc góp chung electron để đạt cấu hình electron bền vững giống với
A. kim loại kiềm gần kề.
B. kim loại kiềm thổ gần kề.
C. nguyên tử halogen gần kề.
D. nguyên tử khí hiếm gần kề.
Câu 10: Tính chất nào sau đây không là tính chất của hợp chất ion?
A. Nhiệt độ nóng chảy cao.
B. Tan nhiều trong nước. C. Khó bay hơi.
D. Nhiệt độ sôi thấp.
Câu 11: Liên kết cọng hóa trị là liên kết được tạo thành bằng
A. lực hút tĩnh điện giữa các electron tự do với ion dương kim loại.
B. cặp electron chung giữa hai nguyên tử.
C. lực hút tĩnh điện giữa các ion mang điện trái dấu.
D. cặp electron chung chỉ do một nguyên tử đóng góp.
Câu 12: Phân tử nào dưới đây chỉ không chứa ion đa nguyên tử? A. Na2SO4. B. NH4HCO3. C. CaCl2. D. Al(NO3)3.
Câu 13: Chất nào sau đây có liên kết cộng hóa trị phân cực? A. K2O. B. NaCl. C. AlCl3. D. H2S.
Câu 14: Cho cấu hình electron của nguyên tử oxygen là 1s22s22p4. Để hình thành phân tử O2,
mỗi nguyên tử O góp chung n electron. Giá trị của n là A. 1. B. 4. C. 3. D. 2.
Câu 15: Liên kết ion là liên kết được hình thành
A. giữa kim loại điển hình và phi kim điển hình.
B. bởi lực hút tĩnh điện giữa hai lưỡng cực tạm thời.
C. giữa ion kim loại với electron tự do.
D. giữa hai nguyên tử bằng một hay nhiều cặp electron chung.
Câu 16: Tương tác van der Waals tồn tại giữa những A. ion. B. hạt proton. C. hạt neutron.
D. nguyên tử khí hiếm.
Câu 17: Nguyên tử nguyên tố oxygen có 16 hạt mang điện và 10 hạt không mang điện. Số khối
hạt nhân nguyên tử oxygen là A. 10. B. 16. C. 18. D. 26.
Câu 18: Nguyên tử X có phân mức năng lượng cao nhất là 4s1. Điện tích hạt nhân của X là A. +24. B. +11. C. +29. D. +19.
Câu 19: Nguyên tử của nguyên tố X có cấu hình electron ở trạng thái cơ bản là
1s22s22p63s23p63d54s1. Trong bảng tuần hoàn X thuộc
A. chu kỳ 3, nhóm IA.
B. chu kỳ 4, nhóm IB.
C. chu kỳ 4, nhóm VIB.
D. chu kỳ 3, nhóm VIA.
Câu 20: Cho bản tuần hoàn các nguyên tố hóa học: X Z Y
Dãy gồm các nguyên tố được sắp xếp theo chiều tăng dần bán kính nguyên tử từ trái sang phải là A. Z, Y, X. B. Y, Z, X. C. X, Y, Z. D. Y, X, Z.
Câu 21: Ba nguyên tố với số hiệu nguyên tử lần lượt là 11, 12, 13 có hydroxide tương tứng là
X, Y, T. Chiều tăng dần tính acid của hydroxide này là A. X, Y, T. B. X, T, Y. C. T, X, Y. D. T, Y, X.
Câu 22: Nguyên tử nguyên tố X có phân lớp electron ngoài cùng là 2p2. Công thức oxide cao
nhất của X, hydroxide tương ứng và tính chất của các hợp chất lần lượt là
A. X2O3, X(OH)3, tính lưỡng tính.
B. XO3, H2XO4, tính acid.
C. XO2, H2XO3, tính acid.
D. XO, X(OH)2, tính base.
Câu 23: Khi hình thành liên kết hóa học, nguyên tử nào sau đây có xu hướng nhận 1 electron
để đạt cấu hình electron bền vững của khí hiếm theo quy tắc octet? A. X (Z=20). B. Y (Z=35). C. Z (Z=19). D. T (Z=16).
Câu 24: Cho cấu hình electron nguyên tử của các nguyên tố sau: X ([Xe]6s2), Y
([Ar]3d104s24p5). Hợp chất được tạo thành từ X và Y có công thức là
A. XY2, hợp chất ion.
B. X2Y3, hợp chất cộng hóa trị.
C. X2Y, hợp chất ion.
D. X3Y2, hợp chất cộng hóa trị.
Câu 25: Liên kết trong phân tử nào sau đây mang nhiều đặc tính ion nhất? A. Rb2O. B. Li2O. C. K2O. D. Na2O.
Câu 26: Cho biết: H (Z=1), C (Z=6), O (Z=8). Trong phân tử C2H2 và H2O, tổng số cặp
electron chưa tham gia liên kết lần lượt là A. 0 và 2. B. 5 và 2. C. 4 và 3. D. 2 và 2.
Câu 27: Dãy chất nào sau đây chỉ có liên kết cộng hóa trị phân cực? A. H2S, Na2O, AlCl3. B. NH4NO3, H2O, HCl. C. H2, H2O, NH3. D. H2O, CO2, Al2S3.
Câu 28: Chất nào sau đây tan nhiều trong nước? A. O2. B. C3H4. C. CH3NH2. D. H2S. PHẦN II. TỰ LUẬN
Đề thi cuối kì 1 Hóa học 10 Cánh diều - Đề 5
583
292 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu bộ 9 đề thi cuối kì 1 (7 đề có đáp án, 2 đề không đáp án) có đầy đủ ma trận và lời giải chi tiết Hóa học 10 Cánh diều mới nhất năm 2023 - 2024 nhằm giúp Giáo viên có thêm tài liệu tham khảo ra đề thi Hóa học lớp 10.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(583 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 10
Xem thêmTài liệu bộ mới nhất
Đây là bản xem thử, vui lòng mua tài liệu để xem chi ết (có lời giải)
ĐỀ SỐ 5
SỞ GD&ĐT ………………
TRƯỜNG THPT ……………………
Đề thi chính thức
KIỂM TRA HỌC KỲ I NĂM HỌC 2022-2023
Môn thi: Hoá học – Khối: 10
Thời gian làm bài: 45 phút
(Đề thi gồm 28 câu trắc nghiệm và 3 câu tự
luận)
Mã đề thi: 130
Họ và tên học sinh:……………………………………………….. Lớp:……… SBD:
………………
PHẦN I. TRẮC NGHIỆM
Câu 1: Hạt nhân của hầu hết các nguyên tử (trừ H) được tạo nên từ
A. proton và electron. B. electron và neutron.
C. proton và neutron. D. proton.
Câu 2: Hình bên là mô phỏng của AO
1 2 3 4
Đâu là hình mô phỏng của AOp
A. 1; 2; 3. B. 2; 3; 4. C. 1; 3; 4. D. 1; 2; 4.
Câu 3: Số phân lớp electron tối đa trong các lớp K, L, M, N lần lượt là
A. 1, 4, 9 và 16. B. 1, 2, 3 và 4. C. 2, 6, 10 và 14. D. 2, 8, 18 và 32.
Câu 4: Số nguyên tố trong chu kì 3 và 5 của bảng tuần hoàn lần lượt là
A. 8 và 18. B. 2 và 8. C. 8 và 8. D. 18 và 32.
Câu 5: Trong một chu kì, đại lượng nào sau đây không biến đổi tuần hoàn theo chiều tăng của
điện tích hạt nhân?
A. Bán kính nguyên tử. B. Hóa trị trong công thức oxide cao nhất.
C. Độ âm điện của nguyên tử. D. Số lớp electron trong nguyên tử.
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi ết (có lời giải)
Câu 6: Trong một nhóm A (trừ nhóm VIIIA), theo chiều tăng của điện tích hạt nhân nguyên tử
thì
A. tính kim loại tăng dần, độ âm điện tăng dần.
B. tính phi kim giảm dần, bán kính nguyên tử tăng dần.
C. tính acid giảm dần, tính phi kim tăng dần.
D. tính kim loại tăng dần, tính base giảm dần.
Câu 7: Cho mô hình nguyên tử của X.
Công thức hợp chất khí của X với hydrogen là
A. XH
2
. B. XH
4
. C. XH. D. XH
3
.
Câu 8: Nguyên tố X thuộc nhóm VIIIA của bảng tuần hoàn. Cấu hình electron lớp ngoài cùng
của nguyên tử nguyên tố X là
A. ns
2
np
5
. B. ns
2
np
3
. C. ns
2
np
1
. D. ns
2
np
6
.
Câu 9: Theo quy tắc octet, khi hình thành liên kết hóa học, các nguyên tử có xu hướng nhường,
nhận hoặc góp chung electron để đạt cấu hình electron bền vững giống với
A. kim loại kiềm gần kề. B. kim loại kiềm thổ gần kề.
C. nguyên tử halogen gần kề. D. nguyên tử khí hiếm gần kề.
Câu 10: Tính chất nào sau đây không là tính chất của hợp chất ion?
A. Nhiệt độ nóng chảy cao. B. Tan nhiều trong nước.
C. Khó bay hơi. D. Nhiệt độ sôi thấp.
Câu 11: Liên kết cọng hóa trị là liên kết được tạo thành bằng
A. lực hút tĩnh điện giữa các electron tự do với ion dương kim loại.
B. cặp electron chung giữa hai nguyên tử.
C. lực hút tĩnh điện giữa các ion mang điện trái dấu.
D. cặp electron chung chỉ do một nguyên tử đóng góp.
Câu 12: Phân tử nào dưới đây chỉ không chứa ion đa nguyên tử?
A. Na
2
SO
4
. B. NH
4
HCO
3
. C. CaCl
2
. D. Al(NO
3
)
3
.
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi ết (có lời giải)
Câu 13: Chất nào sau đây có liên kết cộng hóa trị phân cực?
A. K
2
O. B. NaCl. C. AlCl
3
. D. H
2
S.
Câu 14: Cho cấu hình electron của nguyên tử oxygen là 1s
2
2s
2
2p
4
. Để hình thành phân tử O
2
,
mỗi nguyên tử O góp chung n electron. Giá trị của n là
A. 1. B. 4. C. 3. D. 2.
Câu 15: Liên kết ion là liên kết được hình thành
A. giữa kim loại điển hình và phi kim điển hình.
B. bởi lực hút tĩnh điện giữa hai lưỡng cực tạm thời.
C. giữa ion kim loại với electron tự do.
D. giữa hai nguyên tử bằng một hay nhiều cặp electron chung.
Câu 16: Tương tác van der Waals tồn tại giữa những
A. ion. B. hạt proton.
C. hạt neutron. D. nguyên tử khí hiếm.
Câu 17: Nguyên tử nguyên tố oxygen có 16 hạt mang điện và 10 hạt không mang điện. Số khối
hạt nhân nguyên tử oxygen là
A. 10. B. 16. C. 18. D. 26.
Câu 18: Nguyên tử X có phân mức năng lượng cao nhất là 4s
1
. Điện tích hạt nhân của X là
A. +24. B. +11. C. +29. D. +19.
Câu 19: Nguyên tử của nguyên tố X có cấu hình electron ở trạng thái cơ bản là
1s
2
2s
2
2p
6
3s
2
3p
6
3d
5
4s
1
. Trong bảng tuần hoàn X thuộc
A. chu kỳ 3, nhóm IA. B. chu kỳ 4, nhóm IB.
C. chu kỳ 4, nhóm VIB. D. chu kỳ 3, nhóm VIA.
Câu 20: Cho bản tuần hoàn các nguyên tố hóa học:
X
Z Y
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi ết (có lời giải)
Dãy gồm các nguyên tố được sắp xếp theo chiều tăng dần bán kính nguyên tử từ trái sang
phải là
A. Z, Y, X. B. Y, Z, X. C. X, Y, Z. D. Y, X, Z.
Câu 21: Ba nguyên tố với số hiệu nguyên tử lần lượt là 11, 12, 13 có hydroxide tương tứng là
X, Y, T. Chiều tăng dần tính acid của hydroxide này là
A. X, Y, T. B. X, T, Y. C. T, X, Y. D. T, Y, X.
Câu 22: Nguyên tử nguyên tố X có phân lớp electron ngoài cùng là 2p
2
. Công thức oxide cao
nhất của X, hydroxide tương ứng và tính chất của các hợp chất lần lượt là
A. X
2
O
3
, X(OH)
3
, tính lưỡng tính. B. XO
3
, H
2
XO
4
, tính acid.
C. XO
2
, H
2
XO
3
, tính acid. D. XO, X(OH)
2
, tính base.
Câu 23: Khi hình thành liên kết hóa học, nguyên tử nào sau đây có xu hướng nhận 1 electron
để đạt cấu hình electron bền vững của khí hiếm theo quy tắc octet?
A. X (Z=20). B. Y (Z=35). C. Z (Z=19). D. T (Z=16).
Câu 24: Cho cấu hình electron nguyên tử của các nguyên tố sau: X ([Xe]6s
2
), Y
([Ar]3d
10
4s
2
4p
5
). Hợp chất được tạo thành từ X và Y có công thức là
A. XY
2
, hợp chất ion. B. X
2
Y
3
, hợp chất cộng hóa trị.
C. X
2
Y, hợp chất ion. D. X
3
Y
2
, hợp chất cộng hóa trị.
Câu 25: Liên kết trong phân tử nào sau đây mang nhiều đặc tính ion nhất?
A. Rb
2
O. B. Li
2
O. C. K
2
O. D. Na
2
O.
Câu 26: Cho biết: H (Z=1), C (Z=6), O (Z=8). Trong phân tử C
2
H
2
và H
2
O, tổng số cặp
electron chưa tham gia liên kết lần lượt là
A. 0 và 2. B. 5 và 2. C. 4 và 3. D. 2 và 2.
Câu 27: Dãy chất nào sau đây chỉ có liên kết cộng hóa trị phân cực?
A. H
2
S, Na
2
O, AlCl
3
. B. NH
4
NO
3
, H
2
O, HCl.
C. H
2
, H
2
O, NH
3
. D. H
2
O, CO
2
, Al
2
S
3
.
Câu 28: Chất nào sau đây tan nhiều trong nước?
A. O
2
. B. C
3
H
4
. C. CH
3
NH
2
. D. H
2
S.
PHẦN II. TỰ LUẬN
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi ết (có lời giải)
Câu 29: (1 điểm) X có Z = 12, được sử dụng để làm cho hợp kim nhẹ bền, đặc biệt là cho
ngành công nghiệp hàng không vũ trụ, và cũng được sử dụng trong flashbulbs và pháo hoa
bởi vì nó đốt cháy với một ngọn lửa trắng rực rỡ.
a. Viết cấu hình electron và xác định vị trí của X trong bản hệ thống tuần hoàn.
b. Cho biết xu hướng cơ bản của nguyên tử X khi hình thành liên kết hóa học. Hãy vẽ sơ đồ
minh họa quá trình đó.
Câu 30: (1 điểm) Cho các chất sau: HCl, N
2
.
a. Phân loại các chất trên theo liên kết (ion, cộng hóa trị phân cực, cộng hóa trị không phân
cực).
b. Biểu diễn sự hình thành liên kết ion đối với hợp chất ion; viết công thức electron, công
thức Lewis, công thức cấu tạo đối với hợp chất cộng hóa trị.
Câu 31: (0,5 điểm) Hãy giải thích sự biến đổi về nhiệt độ nóng chảy của dãy các chất sau:
Chất C
2
H
6
HF K
2
O
Nhiệt độ nóng
chảy
-182,76 °C -83,6 °C 740 °C
Câu 32: (0,5 điểm) Một hợp chất có công thức MX. Tổng số các hạt trong hợp chất là 84, trong
đó số hạt mang điện nhiều hơn số hạt không mang điện là 28. Nguyên tử khối của X lớn hơn
của M là 8. Tổng số các hạt trong X
2-
nhiều hơn M
2+
là 16. Tìm số proton của nguyên tử M
và X.
HƯỚNG DẪN CHẤM
I. PHẦN TRẮC NGHIỆM
1.C 2.B 3.B 4.A 5.D 6.B 7.D 8.D 9.D 10.D
11.B 12.C 13.C 14.D 15.A 16.D 17.C 18.D 19.C 20.C
21.A 22.C 23.B 24.A 25.A 26.A 27.D 28.C
II. PHẦN TỰ LUẬN
Câu Đáp án Điểm
29 a. Cấu hình electron: 1s
2
2s
2
2p
6
3s
2
0,25
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85























