Bảng đặc tả, ma trận và đề kiểm tra cuối học kì II (có đáp án chi tiết) Môn: Hoá học 10
Bộ sách: Chân trời sáng tạo
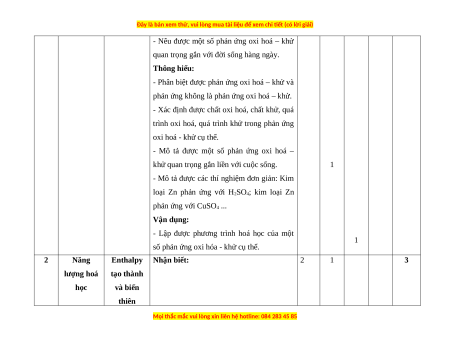
I. Bảng đặc tả kĩ thuật đề kiểm tra cuối học kì 2 - Hóa học 10 – Chân trời sáng tạo.
Mức độ kiến thức, kĩ năng
Số câu hỏi theo các mức
Nội dung Đơn vị kiến TT
cần kiểm tra, đánh giá độ nhận thức Tổng kiến thức thức NB TH VD VDC 1 Phản ứng Nhận biết: oxi hóa –
- Nêu được khái niệm số oxi hoá. khử và ứng
- Nêu được các quy tắc xác định số oxi hoá
dụng trong Số oxi hóa của nguyên tử các nguyên tố. 1 2 cuộc sống Thông hiểu:
- Xác định được số oxi hoá của nguyên tử 1
các nguyên tố trong một số hợp chất cụ thể.
Phản ứng Nhận biết: 1 3 oxi hóa -
- Nêu được khái niệm phản ứng oxi hoá – khử khử.
- Nêu được khái niệm chất oxi hóa, chất
khử, sự oxi hóa (quá trình oxi hoá), sự khử (quá trình khử).
- Nêu được một số phản ứng oxi hoá – khử
quan trọng gắn với đời sống hàng ngày. Thông hiểu:
- Phân biệt được phản ứng oxi hoá – khử và
phản ứng không là phản ứng oxi hoá – khử.
- Xác định được chất oxi hoá, chất khử, quá
trình oxi hoá, quá trình khử trong phản ứng oxi hoá - khử cụ thể.
- Mô tả được một số phản ứng oxi hoá –
khử quan trọng gắn liền với cuộc sống. 1
- Mô tả được các thí nghiệm đơn giản: Kim
loại Zn phản ứng với H2SO4; kim loại Zn phản ứng với CuSO4 ... Vận dụng:
- Lập được phương trình hoá học của một 1
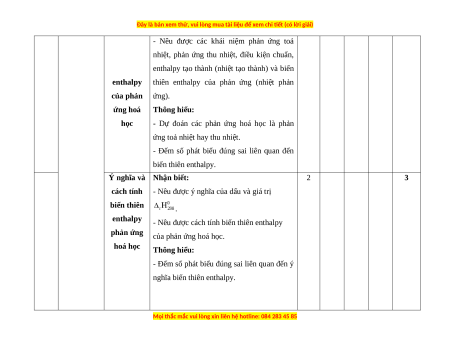
số phản ứng oxi hóa - khử cụ thể. 2 Năng Enthalpy Nhận biết: 2 1 3 lượng hoá tạo thành học và biến thiên
- Nêu được các khái niệm phản ứng toả
nhiệt, phản ứng thu nhiệt, điều kiện chuẩn,
enthalpy tạo thành (nhiệt tạo thành) và biến enthalpy
thiên enthalpy của phản ứng (nhiệt phản của phản ứng). ứng hoá Thông hiểu: học
- Dự đoán các phản ứng hoá học là phản
ứng toả nhiệt hay thu nhiệt.
- Đếm số phát biểu đúng sai liên quan đến biến thiên enthalpy.
Ý nghĩa và Nhận biết: 2 3
cách tính - Nêu được ý nghĩa của dấu và giá trị biến thiên . enthalpy
- Nêu được cách tính biến thiên enthalpy
phản ứng của phản ứng hoá học. hoá học Thông hiểu:
- Đếm số phát biểu đúng sai liên quan đến ý nghĩa biến thiên enthalpy.
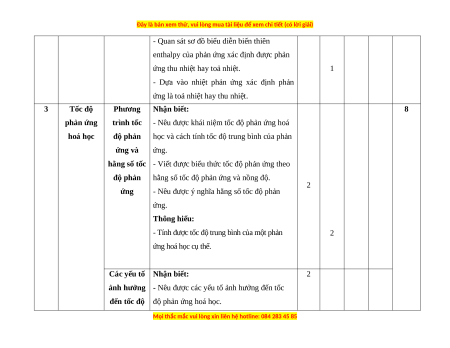
- Quan sát sơ đồ biểu diễn biến thiên
enthalpy của phản ứng xác định được phản
ứng thu nhiệt hay toả nhiệt. 1
- Dựa vào nhiệt phản ứng xác định phản
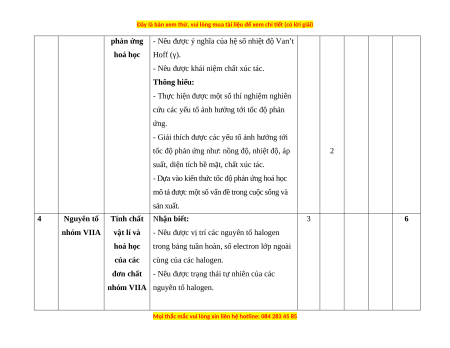
ứng là toả nhiệt hay thu nhiệt. 3 Tốc độ Phương Nhận biết: 8 phản ứng trình tốc
- Nêu được khái niệm tốc độ phản ứng hoá hoá học độ phản
học và cách tính tốc độ trung bình của phản ứng và ứng.
hằng số tốc - Viết được biểu thức tốc độ phản ứng theo độ phản
hằng số tốc độ phản ứng và nồng độ. 2 ứng
- Nêu được ý nghĩa hằng số tốc độ phản ứng. Thông hiểu:
- Tính được tốc độ trung bình của một phản 2 ứng hoá học cụ thể.
Các yếu tố Nhận biết: 2
ảnh hưởng - Nêu được các yếu tố ảnh hưởng đến tốc
đến tốc độ độ phản ứng hoá học.
Đề thi cuối kì 2 Hóa học 10 Chân trời sáng tạo - Đề 1
589
295 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu 3 đề thi cuối kì 2 môn Hóa học 10 bộ Chân trời sáng tạo mới nhất năm 2023 - 2024 nhằm giúp Giáo viên có thêm tài liệu tham khảo ra đề thi Hóa học lớp 10.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(589 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 10
Xem thêmTài liệu bộ mới nhất

Đây là bản xem thử, vui lòng mua tài liệu để xem chi ết (có lời giải)
Bảng đặc tả, ma trận và đề kiểm tra cuối học kì II (có đáp án chi tiết)
Môn: Hoá học 10
Bộ sách: Chân trời sáng tạo
I. Bảng đặc tả kĩ thuật đề kiểm tra cuối học kì 2 - Hóa học 10 – Chân trời sáng tạo.
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
TT
Nội dung
kiến thức
Đơn vị kiến
thức
Mức độ kiến thức, kĩ năng
cần kiểm tra, đánh giá
Số câu hỏi theo các mức
độ nhận thức
Tổng
NB TH VD VDC
1 Phản ứng
oxi hóa –
khử và ứng
dụng trong
cuộc sống
Số oxi hóa
Nhận biết:
- Nêu được khái niệm số oxi hoá.
- Nêu được các quy tắc xác định số oxi hoá
của nguyên tử các nguyên tố.
Thông hiểu:
- Xác định được số oxi hoá của nguyên tử
các nguyên tố trong một số hợp chất cụ thể.
1
1
2
Phản ứng
oxi hóa -
khử
Nhận biết:
- Nêu được khái niệm phản ứng oxi hoá –
khử.
- Nêu được khái niệm chất oxi hóa, chất
khử, sự oxi hóa (quá trình oxi hoá), sự khử
(quá trình khử).
1 3

Đây là bản xem thử, vui lòng mua tài liệu để xem chi ết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
- Nêu được một số phản ứng oxi hoá – khử
quan trọng gắn với đời sống hàng ngày.
Thông hiểu:
- Phân biệt được phản ứng oxi hoá – khử và
phản ứng không là phản ứng oxi hoá – khử.
- Xác định được chất oxi hoá, chất khử, quá
trình oxi hoá, quá trình khử trong phản ứng
oxi hoá - khử cụ thể.
- Mô tả được một số phản ứng oxi hoá –
khử quan trọng gắn liền với cuộc sống.
- Mô tả được các thí nghiệm đơn giản: Kim
loại Zn phản ứng với H
2
SO
4
; kim loại Zn
phản ứng với CuSO
4
...
Vận dụng:
- Lập được phương trình hoá học của một
số phản ứng oxi hóa - khử cụ thể.
1
1
2 Năng
lượng hoá
học
Enthalpy
tạo thành
và biến
thiên
Nhận biết: 2 1 3
Đây là bản xem thử, vui lòng mua tài liệu để xem chi ết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
enthalpy
của phản
ứng hoá
học
- Nêu được các khái niệm phản ứng toả
nhiệt, phản ứng thu nhiệt, điều kiện chuẩn,
enthalpy tạo thành (nhiệt tạo thành) và biến
thiên enthalpy của phản ứng (nhiệt phản
ứng).
Thông hiểu:
- Dự đoán các phản ứng hoá học là phản
ứng toả nhiệt hay thu nhiệt.
- Đếm số phát biểu đúng sai liên quan đến
biến thiên enthalpy.
Ý nghĩa và
cách tính
biến thiên
enthalpy
phản ứng
hoá học
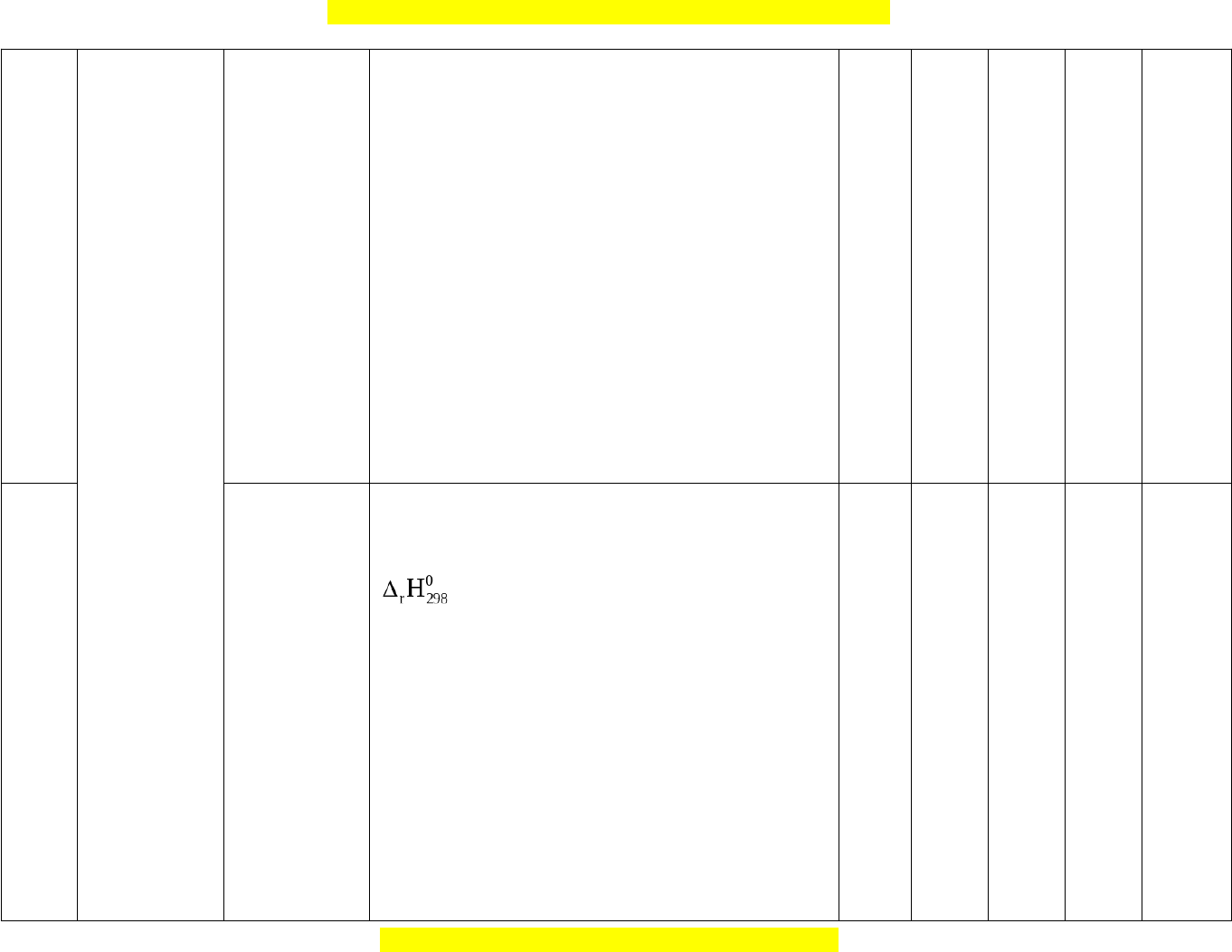
Nhận biết:
- Nêu được ý nghĩa của dấu và giá trị
.
- Nêu được cách tính biến thiên enthalpy
của phản ứng hoá học.
Thông hiểu:
- Đếm số phát biểu đúng sai liên quan đến ý
nghĩa biến thiên enthalpy.
2 3

Đây là bản xem thử, vui lòng mua tài liệu để xem chi ết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
- Quan sát sơ đồ biểu diễn biến thiên
enthalpy của phản ứng xác định được phản
ứng thu nhiệt hay toả nhiệt.
- Dựa vào nhiệt phản ứng xác định phản
ứng là toả nhiệt hay thu nhiệt.
1
3 Tốc độ
phản ứng
hoá học
Phương
trình tốc
độ phản
ứng và
hằng số tốc
độ phản
ứng
Nhận biết:
- Nêu được khái niệm tốc độ phản ứng hoá
học và cách tính tốc độ trung bình của phản
ứng.
- Viết được biểu thức tốc độ phản ứng theo
hằng số tốc độ phản ứng và nồng độ.
- Nêu được ý nghĩa hằng số tốc độ phản
ứng.
Thông hiểu:
- Tính được tốc độ trung bình của một phản
ứng hoá học cụ thể.
2
2
8
Các yếu tố
ảnh hưởng
đến tốc độ
Nhận biết:
- Nêu được các yếu tố ảnh hưởng đến tốc
độ phản ứng hoá học.
2

Đây là bản xem thử, vui lòng mua tài liệu để xem chi ết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
phản ứng
hoá học
- Nêu được ý nghĩa của hệ số nhiệt độ Van’t
Hoff (γ).
- Nêu được khái niệm chất xúc tác.
Thông hiểu:
- Thực hiện được một số thí nghiệm nghiên
cứu các yếu tố ảnh hưởng tới tốc độ phản
ứng.
- Giải thích được các yếu tố ảnh hưởng tới
tốc độ phản ứng như: nồng độ, nhiệt độ, áp
suất, diện tích bề mặt, chất xúc tác.
- Dựa vào kiến thức tốc độ phản ứng hoá học
mô tả được một số vấn đề trong cuộc sống và
sản xuất.
2
4 Nguyên tố
nhóm VIIA
Tính chất
vật lí và
hoá học
của các
đơn chất
nhóm VIIA
Nhận biết:
- Nêu được vị trí các nguyên tố halogen
trong bảng tuần hoàn, số electron lớp ngoài
cùng của các halogen.
- Nêu được trạng thái tự nhiên của các
nguyên tố halogen.
3 6