Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có l i ờ gi i ả ) Bài 4: C u t ấ rúc l p v ớ el
ỏ ectron c a nguyên t ủ ử I. Sự chuy n đ ể ng c ộ a el ủ
ectron trong nguyên tử 1. Sự chuy n đ ể ng c ộ a el ủ
ectron trong nguyên tử
- Theo mô hình nguyên tử c a
ủ Rutherford – Bohr, các electron chuy n ể đ ng ộ trên nh ng ữ qu đ ỹ o hì ạ nh tròn hay b u d ầ c xác đ ụ nh xung quanh h ị t ạ nhân. - Theo mô hình hi n ệ đ i ạ , trong nguyên t , ử các electron chuy n ể đ ng ộ r t ấ nhanh xung quanh h t ạ nhân không theo m t ộ quỹ đ o ạ xác đ nh, ị t o ạ thành đám mây electron. 2. Orbital nguyên tử
- Orbital nguyên tử (Atomic Orbital, vi t ế t t ắ AO) là khu v c ự không gian xung quanh h t ạ nhân nguyên tử mà t i ạ đó xác su t ấ tìm th y ấ electron là l n ớ nh t ấ (kho ng ả 90%). - M t ộ số AO thư ng g ờ p: ặ s, p, d, f - Các AO có hình d ng ạ khác nhau: AO s có d ng ạ hình c u, ầ AO p có d ng ạ hình
số tám nổi, AO d và f có hình d ng ph ạ c ứ t p. ạ M i
ọ thắc mắc vui lòng xin vui lòng: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t (c ế ó l i ờ gi i ả ) II. L p và phâ ớ n l p ớ electron Trong nguyên t , ử các electron đư c ợ s p ắ x p ế thành t ng ừ l p ớ và phân l p ớ theo năng lư ng ợ t t ừ h p đ ấ n cao. ế 1. L p el ớ ectron - Trong nguyên t , ử các electron đư c ợ s p ắ x p ế thành t ng ừ l p ớ (kí hi u ệ K, L, M, N, O, P, Q) từ g n đ ầ n xa ế h t ạ nhân, theo th t ứ t ự ừ l p n = 1 đ ớ n n = 7. ế
- Các electron trên cùng m t ộ l p ớ có năng lư ng g ợ n b ầ ng ằ nhau. 2. Phân l p ớ electron - Mỗi l p
ớ electron phân chia thành các phân l p, ớ đư c ợ kí hi u ệ b ng ằ các chữ cái vi t ế thư ng: ờ
s, p, d, f. Các electron thu c ộ các phân l p ớ s, p, d và f đư c ợ g i ọ tư ng ơ ng l ứ
à các electron s, p, d và f. - Các phân l p s ớ , p, d và f l n l ầ ư t ợ có các s ố AO tư ng ơ ng 1, 3, 5 và 7. ứ
- Các electron trên cùng m t ộ phân l p có năng l ớ ư ng b ợ ng ằ nhau. V i ớ 4 l p đ ớ u ầ (1, 2, 3, 4) số phân l p t ớ rong m i ỗ l p b ớ ng ằ s t ố h t ứ c ự a l ủ p ớ đó. M i ọ thắc m c
ắ vui lòng xin vui lòng: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có l i ờ gi i ả )
III. Cấu hình electron nguyên tử 1. Nguyên lí v ng b ữ n ề - Trong nguyên t , ử các electron trên m i ỗ AO có m t ộ m c ứ năng lư ng ợ xác đ nh. ị Ngư i ờ ta g i ọ m c ứ năng lư ng này l ợ à m c ứ năng lư ng ợ AO nguyên t . ử
- Các electron trên các AO khác nhau c a ủ cùng m t ộ phân l p ớ có năng lư ng ợ nh nhau. ư Ví d : ụ Phân l p
ớ 2p có 3 AO 2px, 2py, 2pz; các electron c a ủ các AO p trong phân l p ớ này tuy có sự đ nh ị hư ng
ớ trong không gian khác nhau nh ng ư chúng có cùng m c năng l ứ ư ng ợ AO. - Nguyên lí v ng ữ b n: ề Ở tr ng ạ thái cơ b n,
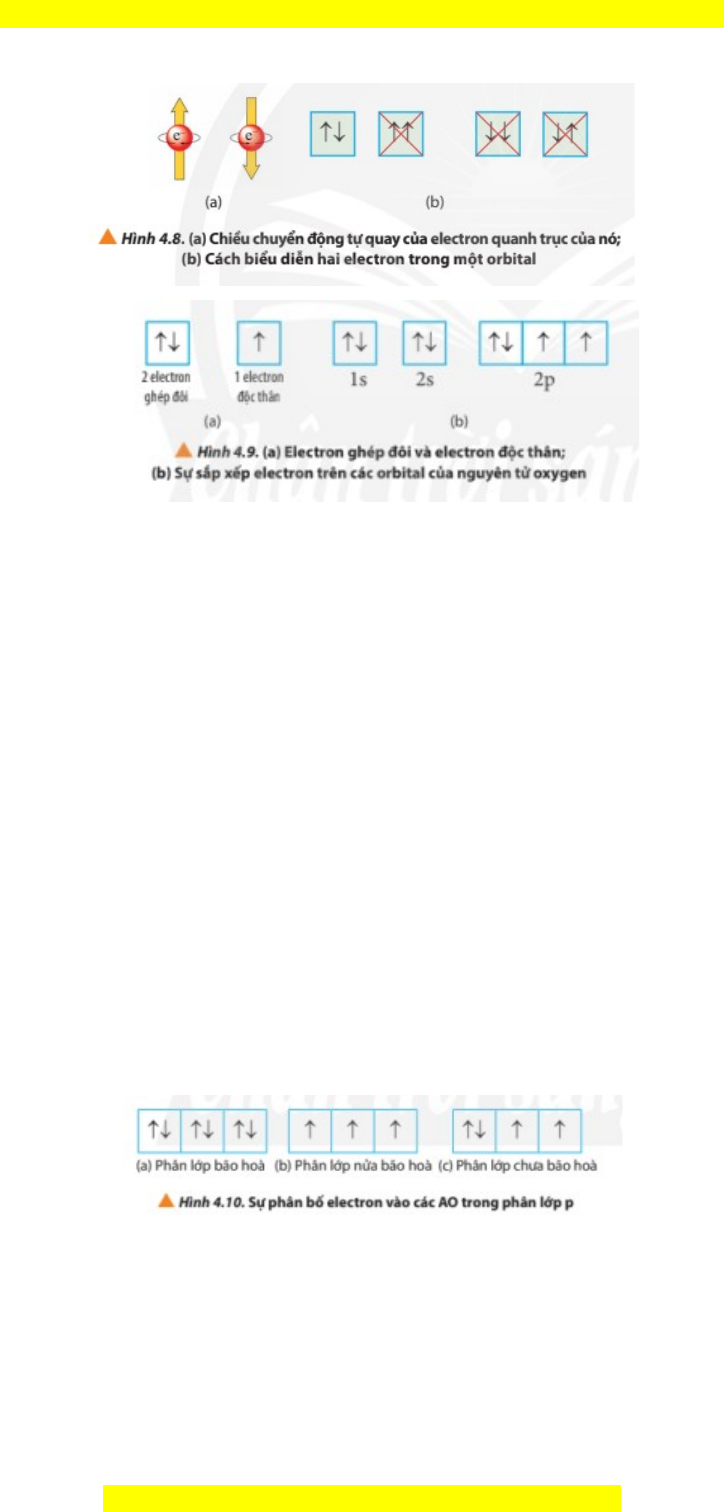
ả các electron trong nguyên tử chi m ế l n ầ lư t ợ nh ng ữ orbital có m c ứ năng lư ng ợ t ừ th p ấ đ n ế cao: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p … 2. Nguyên lí Pauli - Để bi u ể di n ễ orbital nguyên t , ử ngư i ờ ta sử d ng ụ các ô vuông, g i ọ là ô lư ng t ợ . M ử ỗi ô lư ng ợ t ử ng v ứ i ớ m t ộ AO. M i ỗ AO ch a ứ t i ố đa 2 electron. + N u ế trong AO chỉ ch a
ứ 1 electron thì electron đó g i ọ là electron đ c ộ thân (kí hiệu b i ở 1 mũi tên hư ng l ớ ên ↑). + N u ế AO ch a
ứ đủ 2 electron thì các electron đó g i
ọ là electron ghép đôi (kí hiệu b i ở hai mũi tên ngư c chi ợ u ề nhau ↑↓). M i
ọ thắc mắc vui lòng xin vui lòng: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t (c ế ó l i ờ gi i ả )
- Nguyên lí Pauli: Mỗi orbital chỉ ch a ứ t i
ố đa 2 electron và có chi u ề tự quay ngư c ợ nhau. - D a
ự vào nguyên lí Pauli, ta dễ dàng xác đ nh ị đư c ợ số AO và s ố electron t i ố đa trong m i ỗ l p ớ và phân l p. ớ + Số AO t i ố đa trong l p n l ớ à n2 (n ≤ 4). + Số electron t i ố đa trong l p n l ớ à 2n2 (n ≤ 4). 3. Quy tắc Hund - Các phân l p: ớ s2; p6; d10; f14 ch a ứ đủ số electron t i ố đa g i ọ là phân l p ớ bão hòa. - Các phân l p: ớ s1; p3; d5; f7 ch a ứ m t ộ n a ử số electron t i ố đa g i ọ là phân l p ớ nửa bão hòa. - Các phân l p ch ớ a đ ư ủ số electron t i ố đa g i ọ là phân l p ch ớ a bão ư hòa. - Quy t c ắ Hund: Trong cùng m t ộ phân l p ớ ch a
ư bão hòa, các electron sẽ phân
bố vào các orbital sao cho s el ố ectron đ c t ộ hân là t i ố đa. 4. Cách vi t
ế cấu hình electron nguyên tử - C u
ấ hình electron nguyên tử bi u ể di n
ễ sự phân bố electron trong v ỏ nguyên t t ử rên các phân l p t ớ hu c các ộ l p khác nhau. ớ M i ọ thắc m c
ắ vui lòng xin vui lòng: 084 283 45 85
Lý thuyết Cấu trúc lớp vỏ electron của nguyên tử Hóa học 10 Chân trời sáng tạo
835
418 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Tài liệu được cập nhật liên tục trong gói này từ nay đến hết tháng 6/2023. Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu Bộ lý thuyết Hóa học 10 Chân trời sáng tạo mới nhất năm 2023 nhằm giúp Giáo viên có thêm tài liệu tham khảo Lý thuyết môn Hóa học lớp 10.
- File word có lời giải chi tiết 100%.Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(835 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 10
Xem thêmTài liệu bộ mới nhất

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
Bài 4: C u trúc l p v electron c a nguyên tấ ớ ỏ ủ ử
I. S chuy n đ ng c a electron trong nguyên tự ể ộ ủ ử
1. S chuy n đ ng c a electron trong nguyên tự ể ộ ủ ử
- Theo mô hình nguyên t c a Rutherford – Bohr, các electron chuy n đ ngử ủ ể ộ
trên nh ng qu đ o hình tròn hay b u d c xác đ nh xung quanh h t nhân. ữ ỹ ạ ầ ụ ị ạ
- Theo mô hình hi n đ i, trong nguyên t , các electron chuy n đ ng r t nhanhệ ạ ử ể ộ ấ
xung quanh h t nhân không theo m t qu đ o xác đ nh, t o thành đám mâyạ ộ ỹ ạ ị ạ
electron.
2. Orbital nguyên tử
- Orbital nguyên t (Atomic Orbital, vi t t t AO) là khu v c không gian xungử ế ắ ự
quanh h t nhân nguyên t mà t i đó xác su t tìm th y electron là l n nh tạ ử ạ ấ ấ ớ ấ
(kho ng 90%).ả
- M t s AO th ng g p: s, p, d, fộ ố ườ ặ
- Các AO có hình d ng khác nhau: AO s có d ng hình c u, AO p có d ng hìnhạ ạ ầ ạ
s tám n i, AO d và f có hình d ng ph c t p.ố ổ ạ ứ ạ
M i th c m c vui lòng xin vui lòng: 084 283 45 85ọ ắ ắ

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
II. L p và phân l p electronớ ớ
Trong nguyên t , các electron đ c s p x p thành t ng l p và phân l p theoử ượ ắ ế ừ ớ ớ
năng l ng t th p đ n cao.ượ ừ ấ ế
1. L p electronớ
- Trong nguyên t , các electron đ c s p x p thành t ng l p (kí hi u K, L, M,ử ượ ắ ế ừ ớ ệ
N, O, P, Q) t g n đ n xa h t nhân, theo th t t l p n = 1 đ n n = 7.ừ ầ ế ạ ứ ự ừ ớ ế
- Các electron trên cùng m t l p có năng l ng g n b ng nhau.ộ ớ ượ ầ ằ
2. Phân l p electronớ
- M i l p electron phân chia thành các phân l p, đ c kí hi u b ng các chỗ ớ ớ ượ ệ ằ ữ
cái vi t th ng: s, p, d, f. Các electron thu c các phân l p s, p, d và f đ c g iế ườ ộ ớ ượ ọ
t ng ng là các electron s, p, d và f.ươ ứ
- Các phân l p s, p, d và f l n l t có các s AO t ng ng 1, 3, 5 và 7.ớ ầ ượ ố ươ ứ
- Các electron trên cùng m t phân l p có năng l ng b ng nhau. V i 4 l p đ uộ ớ ượ ằ ớ ớ ầ
(1, 2, 3, 4) s phân l p trong m i l p b ng s th t c a l p đó.ố ớ ỗ ớ ằ ố ứ ự ủ ớ
M i th c m c vui lòng xin vui lòng: 084 283 45 85ọ ắ ắ

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
III. C u hình electron nguyên tấ ử
1. Nguyên lí v ng b nữ ề
- Trong nguyên t , các electron trên m i AO có m t m c năng l ng xác đ nh.ử ỗ ộ ứ ượ ị
Ng i ta g i m c năng l ng này là m c năng l ng AO nguyên t .ườ ọ ứ ượ ứ ượ ử
- Các electron trên các AO khác nhau c a cùng m t phân l p có năng l ngủ ộ ớ ượ
nh nhau.ư
Ví d : Phân l p 2p có 3 AO 2pụ ớ
x
, 2p
y
, 2p
z
; các electron c a các AO p trong phânủ
l p này tuy có s đ nh h ng trong không gian khác nhau nh ng chúng cóớ ự ị ướ ư
cùng m c năng l ng AO.ứ ượ
- Nguyên lí v ng b n:ữ ề tr ng thái c b n, các electron trong nguyên tỞ ạ ơ ả ử
chi m l n l t nh ng orbital có m c năng l ng t th p đ n cao: 1s 2s 2p 3sế ầ ượ ữ ứ ượ ừ ấ ế
3p 4s 3d 4p 5s 4d 5p …
2. Nguyên lí Pauli
- Đ bi u di n orbital nguyên t , ng i ta s d ng các ô vuông, g i là ôể ể ễ ử ườ ử ụ ọ
l ng t . M i ô l ng t ng v i m t AO. M i AO ch a t i đa 2 electron. ượ ử ỗ ượ ử ứ ớ ộ ỗ ứ ố
+ N u trong AO ch ch a 1 electron thì electron đó g i là electron đ c thân (kíế ỉ ứ ọ ộ
hi u b i 1 mũi tên h ng lên ↑).ệ ở ướ
+ N u AO ch a đ 2 electron thì các electron đó g i là electron ghép đôi (kíế ứ ủ ọ
hi u b i hai mũi tên ng c chi u nhau ↑↓).ệ ở ượ ề
M i th c m c vui lòng xin vui lòng: 084 283 45 85ọ ắ ắ
Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
- Nguyên lí Pauli: M i orbital ch ch a t i đa 2 electron và có chi u t quayỗ ỉ ứ ố ề ự
ng c nhau.ượ
- D a vào nguyên lí Pauli, ta d dàng xác đ nh đ c s AO và s electron t iự ễ ị ượ ố ố ố
đa trong m i l p và phân l p.ỗ ớ ớ
+ S AO t i đa trong l p n là ố ố ớ n
2
(n ≤ 4).
+ S electron t i đa trong l p n là ố ố ớ 2n
2
(n ≤ 4).
3. Quy t c Hundắ
- Các phân l p: sớ
2
; p
6
; d
10
; f
14
ch a đ s electron t i đa g i là ứ ủ ố ố ọ phân l p bãoớ
hòa.
- Các phân l p: sớ
1
; p
3
; d
5
; f
7
ch a m t n a s electron t i đa g i là ứ ộ ử ố ố ọ phân l pớ
n a bão hòa.ử
- Các phân l p ch a đ s electron t i đa g i là phân l p ch a bão hòa.ớ ư ủ ố ố ọ ớ ư
- Quy t c Hund: Trong cùng m t phân l p ch a bão hòa, các electron s phânắ ộ ớ ư ẽ
b vào các orbital sao cho s electron đ c thân là t i đa.ố ố ộ ố
4. Cách vi t c u hình electron nguyên tế ấ ử
- C u hình electron nguyên t bi u di n s phân b electron trong v nguyênấ ử ể ễ ự ố ỏ
t trên các phân l p thu c các l p khác nhau.ử ớ ộ ớ
M i th c m c vui lòng xin vui lòng: 084 283 45 85ọ ắ ắ

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
- Quy c cách bi u di n s phân b electron trên các phân l p thu c các l pướ ể ễ ự ố ớ ộ ớ
nh sau:ư
- Cách vi t c u hình electron:ế ấ
+ B c 1: Xác đ nh s electron c a nguyên t .ướ ị ố ủ ử
+ B c 2: Các electron đ c phân b theo th t các AO có m c năng l ngướ ượ ố ứ ự ứ ượ
tăng d n, theo các nguyên lí và quy t c phân b electron trong nguyên t .ầ ắ ố ử
+ B c 3: Vi t c u hình electron theo th t các phân l p trong m t l p vàướ ế ấ ứ ự ớ ộ ớ
theo th t c a các l p electron.ứ ự ủ ớ
Ví d :ụ
Mg (Z = 12): Th t m c năng l ng orbital: 1sứ ự ứ ượ
2
2s
2
2p
6
3s
2
.
C u hình electron: 1sấ
2
2s
2
2p
6
3s
2
ho c vi t g n là: [Ne]3sặ ế ọ
2
.
[Ne] là kí hi u c u hình electron nguyên t c a nguyên t neon, là khí hi mệ ấ ử ủ ố ế
g n nh t đ ng tr c Mg.ầ ấ ứ ướ
C u hình electron theo orbital:ấ
5. Đ c đi m electron l p ngoài cùng c a nguyên tặ ể ớ ủ ử
- D a vào s l ng electron l p ngoài cùng c a nguyên t nguyên t , có thự ố ượ ớ ủ ử ố ể
d đoán m t nguyên t là kim lo i, phi kim hay khí hi m.ự ộ ố ạ ế
+ Các nguyên t có 1, 2, 3 electron l p ngoài cùng th ng là nguyên t c aử ở ớ ườ ử ủ
các nguyên t kim lo i.ố ạ
+ Các nguyên t có 5, 6, 7 electron l p ngoài cùng th ng là nguyên t c aử ở ớ ườ ử ủ
các nguyên t phi kim.ố
+ Các nguyên t có 4 electron l p ngoài cùng có th là nguyên t c aử ở ớ ể ử ủ
nguyên t kim lo i ho c phi kim.ố ạ ặ
+ Các nguyên t có 8 electron l p ngoài cùng là nguyên t c a nguyên t khíử ở ớ ử ủ ố
hi m (tr He có 2 electron l p ngoài cùng).ế ừ ở ớ
M i th c m c vui lòng xin vui lòng: 084 283 45 85ọ ắ ắ