BẢNG ĐẶC TẢ KĨ THUẬT ĐỀ KIỂM TRA GIỮA KÌ 1
Môn: Hóa học 10 – Thời gian làm bài 45 phút
Bộ sách: Kết nối tri thức với cuộc sống
Mức độ kiến thức, kĩ năng
Số câu hỏi theo các mức Nội dung Đơn vị Tổng TT
cần kiểm tra, đánh giá độ nhận thức
kiến thức kiến thức NB TH VD VDC Thành Nhận biết: 4
phần của - Nguyên tử gồm hạt nhân mang điện tích dương và
nguyên vỏ nguyên tử mang điện tích âm. tử
- Kích thước, khối lượng của nguyên tử.
- Hạt nhân gồm các hạt proton và neutron.
- Kí hiệu, khối lượng và điện tích của electron, proton và neutron.
- Khái niệm điện tích hạt nhân, số khối. Thông hiểu: 2
- Khối lượng của electron nhỏ hơn nhiều so với
khối lượng proton và neutron hay khối lượng
nguyên tử tập trung chủ yếu ở hạt nhân.
- Kích thước của nguyên tử chủ yếu là kích thước của lớp vỏ.
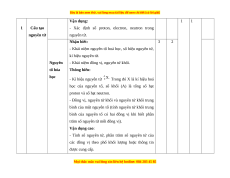
Vận dụng: 1 1 1 Cấu tạo
- Xác định số proton, electron, neutron trong nguyên tử nguyên tử. Nhận biết: 3 2
- Khái niệm nguyên tố hoá học, số hiệu nguyên tử, kí hiệu nguyên tử. Nguyên
- Khái niệm đồng vị, nguyên tử khối. tố hóa Thông hiểu: học - Kí hiệu nguyên tử
Trong đó X là kí hiệu hoá
học của nguyên tố, số khối (A) là tổng số hạt
proton và số hạt neutron.
- Đồng vị, nguyên tử khối và nguyên tử khối trung
bình của một nguyên tố (tính nguyên tử khối trung
bình của nguyên tố có hai đồng vị khi biết phần
trăm số nguyên tử mỗi đồng vị). Vận dụng cao:
- Tính số nguyên tử, phần trăm số nguyên tử của
các đồng vị theo phổ khối lượng hoặc thông tin được cung cấp.
Nhận biết: 6
Cấu trúc - Mô hình hiện đại mô tả sự chuyển động của lớp vỏ electron trong nguyên tử.
electron - Khái niệm về obital nguyên tử (AO); hình dạng của của AOs và AOp.
nguyên - Số lượng phân lớp trong một lớp. tử
- Số electron tối đa trong một lớp, một phân lớp.
- Sự phân bố electron trên các phân lớp, lớp và cấu
hình electron nguyên tử của 20 nguyên tố đầu tiên.
- Đặc điểm của lớp electron ngoài cùng: Lớp ngoài
cùng có nhiều nhất là 8 electron (ns2np6), lớp ngoài
cùng của nguyên tử khí hiếm có 8 electron (riêng helium có 2 electron). Thông hiểu:
- Số lượng electron trong 1 AO. 5
- Hiểu được cách phân bố electron vào các phân lớp.
- Xác định số electron lớp ngoài cùng.
- Xác định loại nguyên tố s, p, d dựa vào cấu hình electron nguyên tử.
- Quy ước viết cấu hình electron của nguyên tử. Nhận biết: 3 3
- Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn. 2
- Cấu tạo của bảng tuần hoàn: ô, chu kì, nhóm Bảng Cấu tạo
nguyên tố (nhóm A, nhóm B).
tuần hoàn của tuần - Khái niệm liên quan (ô, chu kì, nhóm) các
hoàn các Thông hiểu: nguyên tố nguyên
- Chu kì: là dãy các nguyên tố mà nguyên tử của
hoá học – tố hóa
chúng có cùng số lớp electron, được xếp theo chiều Định luật học
điện tích hạt nhân tăng dần. tuần hoàn
- Phân loại được nguyên tố (dựa theo cấu hình
electron: nguyên tố s, p, d, f).
- Mối liên hệ giữa cấu hình electron và vị trí 1
nguyên tố trong bảng tuần hoàn. Vận dụng:
- Giải thích được mối liên hệ giữa cấu hình electron
và vị trí của nguyên tố trong bảng tuần hoàn, dẫn ra thí dụ minh họa. Vận dụng cao:
Đề thi giữa kì 1 Hóa học 10 Kết nối tri thức - Đề 3
593
297 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu 5 đề thi giữa kì 1 môn Hóa học 10 bộ Kết nối tri thức mới nhất năm 2023 - 2024 nhằm giúp Giáo viên có thêm tài liệu tham khảo ra đề thi Hóa học lớp 10.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(593 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 10
Xem thêmTài liệu bộ mới nhất
Đây là bản xem thử, vui lòng mua tài liệu để xem chi ết (có lời giải)
BẢNG ĐẶC TẢ KĨ THUẬT ĐỀ KIỂM TRA GIỮA KÌ 1
Môn: Hóa học 10 – Thời gian làm bài 45 phút
Bộ sách: Kết nối tri thức với cuộc sống
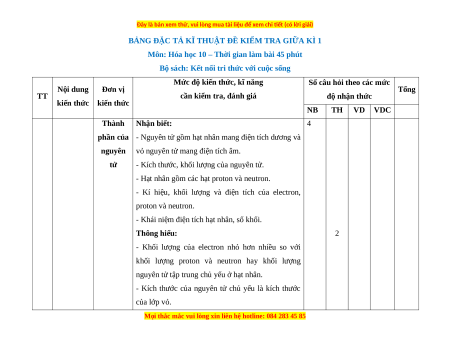
TT
Nội dung
kiến thức
Đơn vị
kiến thức
Mức độ kiến thức, kĩ năng
cần kiểm tra, đánh giá
Số câu hỏi theo các mức
độ nhận thức
Tổng
NB TH VD VDC
Thành
phần của
nguyên
tử
Nhận biết:
- Nguyên tử gồm hạt nhân mang điện tích dương và
vỏ nguyên tử mang điện tích âm.
- Kích thước, khối lượng của nguyên tử.
- Hạt nhân gồm các hạt proton và neutron.
- Kí hiệu, khối lượng và điện tích của electron,
proton và neutron.
- Khái niệm điện tích hạt nhân, số khối.
Thông hiểu:
- Khối lượng của electron nhỏ hơn nhiều so với
khối lượng proton và neutron hay khối lượng
nguyên tử tập trung chủ yếu ở hạt nhân.
- Kích thước của nguyên tử chủ yếu là kích thước
của lớp vỏ.
4
2
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Đây là bản xem thử, vui lòng mua tài liệu để xem chi ết (có lời giải)
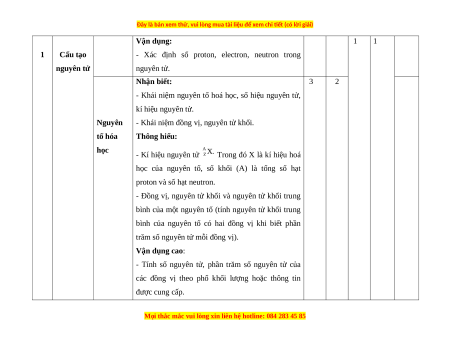
1 Cấu tạo
nguyên tử
Vận dụng:
- Xác định số proton, electron, neutron trong
nguyên tử.
1 1
Nguyên
tố hóa
học
Nhận biết:
- Khái niệm nguyên tố hoá học, số hiệu nguyên tử,
kí hiệu nguyên tử.
- Khái niệm đồng vị, nguyên tử khối.
Thông hiểu:
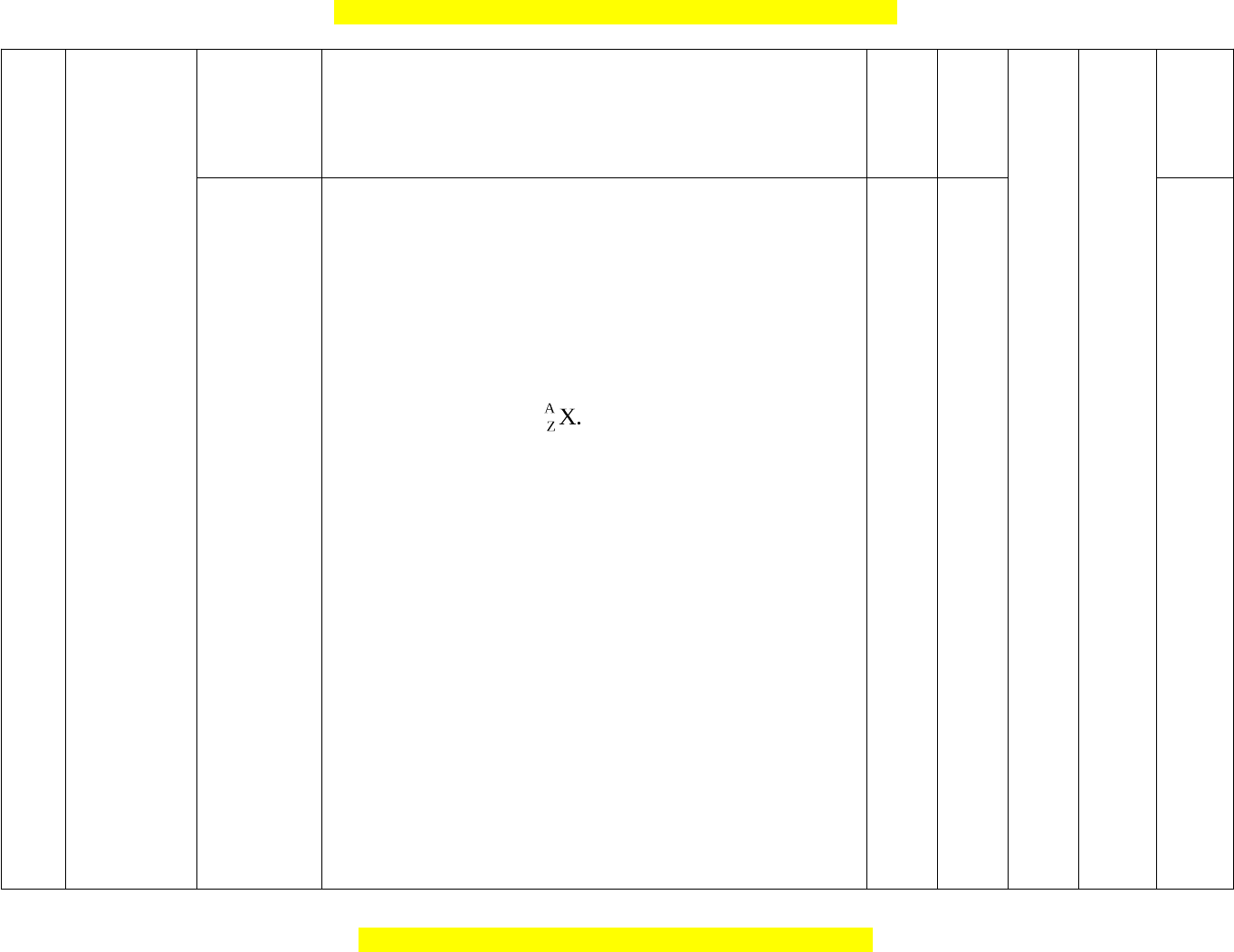
- Kí hiệu nguyên tử Trong đó X là kí hiệu hoá
học của nguyên tố, số khối (A) là tổng số hạt
proton và số hạt neutron.
- Đồng vị, nguyên tử khối và nguyên tử khối trung
bình của một nguyên tố (tính nguyên tử khối trung
bình của nguyên tố có hai đồng vị khi biết phần
trăm số nguyên tử mỗi đồng vị).
Vận dụng cao:
- Tính số nguyên tử, phần trăm số nguyên tử của
các đồng vị theo phổ khối lượng hoặc thông tin
được cung cấp.
3 2
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi ết (có lời giải)
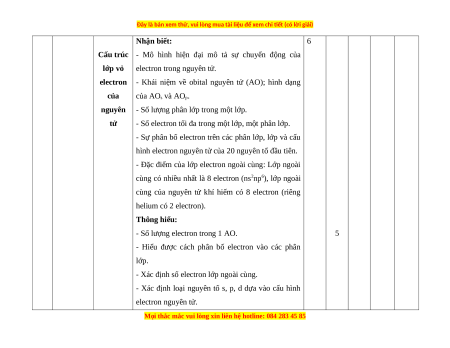
Cấu trúc
lớp vỏ
electron
của
nguyên
tử
Nhận biết:
- Mô hình hiện đại mô tả sự chuyển động của
electron trong nguyên tử.
- Khái niệm về obital nguyên tử (AO); hình dạng
của AO
s
và AO
p
.
- Số lượng phân lớp trong một lớp.
- Số electron tối đa trong một lớp, một phân lớp.
- Sự phân bố electron trên các phân lớp, lớp và cấu
hình electron nguyên tử của 20 nguyên tố đầu tiên.
- Đặc điểm của lớp electron ngoài cùng: Lớp ngoài
cùng có nhiều nhất là 8 electron (ns
2
np
6
), lớp ngoài
cùng của nguyên tử khí hiếm có 8 electron (riêng
helium có 2 electron).
Thông hiểu:
- Số lượng electron trong 1 AO.
- Hiểu được cách phân bố electron vào các phân
lớp.
- Xác định số electron lớp ngoài cùng.
- Xác định loại nguyên tố s, p, d dựa vào cấu hình
electron nguyên tử.
6
5
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi ết (có lời giải)
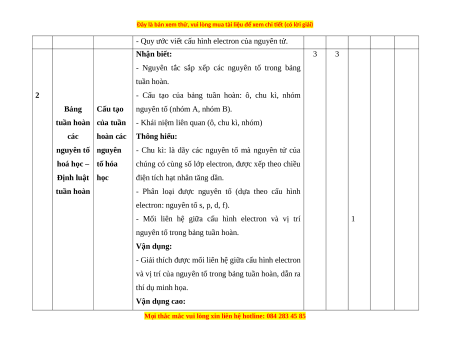
- Quy ước viết cấu hình electron của nguyên tử.
2
Bảng
tuần hoàn
các
nguyên tố
hoá học –
Định luật
tuần hoàn
Cấu tạo
của tuần
hoàn các
nguyên
tố hóa
học
Nhận biết:
- Nguyên tắc sắp xếp các nguyên tố trong bảng
tuần hoàn.
- Cấu tạo của bảng tuần hoàn: ô, chu kì, nhóm
nguyên tố (nhóm A, nhóm B).
- Khái niệm liên quan (ô, chu kì, nhóm)
Thông hiểu:
- Chu kì: là dãy các nguyên tố mà nguyên tử của
chúng có cùng số lớp electron, được xếp theo chiều
điện tích hạt nhân tăng dần.
- Phân loại được nguyên tố (dựa theo cấu hình
electron: nguyên tố s, p, d, f).
- Mối liên hệ giữa cấu hình electron và vị trí
nguyên tố trong bảng tuần hoàn.
Vận dụng:
- Giải thích được mối liên hệ giữa cấu hình electron
và vị trí của nguyên tố trong bảng tuần hoàn, dẫn ra
thí dụ minh họa.
Vận dụng cao:
3 3
1
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi ết (có lời giải)
- Làm bài tập xác định vị trí của một nguyên tố
trong bảng tuần hoàn.
1
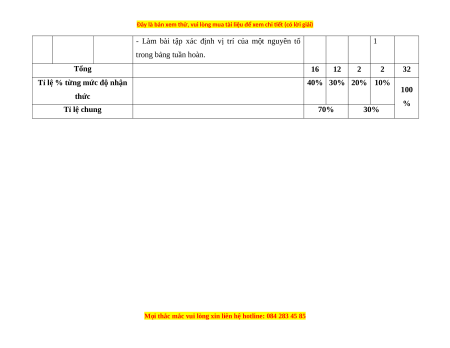
Tổng
16 12 2 2 32
Tỉ lệ % từng mức độ nhận
thức
40% 30% 20% 10%
100
%
Tỉ lệ chung 70% 30%
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85