Ngày soạn: .../.../... Ngày dạy: .../.../...
Trường: ……………………. Họ và tên giáo viên:
Tổ: ………………………….
………………………………..
BÀI 12: LIÊN KẾT CỘNG HÓA TRỊ (3 tiết) I. MỤC TIÊU 1. Kiến thức
- Trình bày được khái niệm và lấy được ví dụ về liên kết cộng hóa trị (liên kết đơn,
đôi, ba) khi áp dụng quy tắc octet.
- Viết được công thức Lewis của một số chất đơn giản.
- Trình bày được khái niệm về liên kết cho - nhận
- Phân biệt được các loại liên kết (liên kết cộng hóa trị không phân cực, liên kết cộng
hóa trị phân cực, liên kết ion) dựa theo độ âm điện.
- Giải thích được sự hình thành liên kết σ và liên kết π qua sự xen phủ AO.
- Trình bày được khái niệm năng lượng liên kết (cộng hóa trị).
- Lắp ráp được mô hình một số phân tử có liên kết cộng hóa trị. 2. Năng lực 2.1. Năng lực chung
- Năng lực tự chủ và tự học: Kĩ năng tìm kiếm thông tin trong SGK, quan sát hình
ảnh về mô hình phân tử để tìm hiểu về liên kết cộng hóa trị, sự xen phủ các orbital nguyên tử.
- Năng lực giao tiếp và hợp tác: Làm việc nhóm tìm hiểu về sự tạo thành liên kết
cộng hóa trị, lắp ráp mô hình phân tử, mô tả liên kết cộng hóa trị bằng sự xen phủ các AO.
- Năng lực giải quyết vấn đề và sáng tạo: Giải thích được tại sao các phân tử có liên
kết cộng hóa trị được hình thành bằng sự góp chung electron.
2.2. Năng lực hóa học
a. Nhận thức hoá học: Học sinh đạt được các yêu cầu sau:
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Trình bày được:
- Liên kết cộng hóa trị trong các phân tử Cl2, HCl, NH3, O2, CO2, N2…
- Liên kết cho – nhận trong ion NH ; H3O+ …
- Mối quan hệ giữa hiệu độ âm điện với liên kết hóa học.
- Mô tả sự xen phủ s – s, s – p, p – p của AO.
- Năng lượng liên kết đặc trưng cho độ bền liên kết.
b. Tìm hiểu tự nhiên dưới góc độ hóa học được thực hiện thông qua các hoạt động:
Thảo luận, tìm hiểu SGK, lắp ráp các mô hình phân tử, cắt dán sự xen phủ AO.
c. Vận dụng kiến thức, kĩ năng đã học để giải thích được tại sao có liên kết đơn, liên
kết đôi, liên kết ba, liên kết cho – nhận trong các hợp chất có liên kết cộng hóa trị. 3. Phẩm chất:
- Chăm chỉ, tự tìm tòi thông tin trong SGK về sự hình thành liên kết cộng hóa trị.
- HS có trách nhiệm trong việc hoạt động nhóm, hoàn thành các nội dung được giao.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU - Hình ảnh, video ...
- Phiếu bài tập số 1, số 2....
III. TIẾN TRÌNH DẠY HỌC
Kiểm tra bài cũ: Không kiểm tra đầu giờ, kiểm tra bài cũ lồng vào trong tiết học.
1. Hoạt động 1: Khởi động a) Mục tiêu:
Huy động kiến thức đã học của HS, tạo nhu cầu tiếp tục tìm hiểu kiến thức mới.
b) Nội dung: GV tổ chức cho HS chơi trò chơi ô chữ. Mỗi ô hàng ngang được lật sẽ
chứa các chữ của từ khóa.
Hàng ngang 1: Phần tử mang điện tích dương được gọi là gì? (đáp án: CATION).
Hàng ngang 2: Hoàn thành câu sau: “Khi nguyên tử nhường hay nhận electron thì
nguyên tử trở thành phần tử .....” (đáp án: MANG ĐIỆN).
Hàng ngang 3: Ion Cl- có tên gọi là? (đáp án: ANION CHLORIDE).
Hàng ngang 4: Ở điều kiện thường, dạng tồn tại của NaCl là? (đáp án: TINH THỂ).
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Hàng ngang 5: Nguyên tử của loại nguyên tố hóa học nào thường có xu hướng nhận
electron để tạo thành phần tử mang điện âm ? (đáp án: PHI KIM).
Hàng ngang 6: Dung dịch nóng chảy của hợp chất ion có khả năng gì? (đáp án: DẪN ĐIỆN).
Hàng ngang 7: Quy tắc bát tử còn có tên gọi khác là quy tắc ....? (đáp án: OCTET).
Hàng ngang 8: Sự kết hợp giữa ion Na+ và ion Cl- tạo thành tinh thể NaCl gọi là gì? (đáp án: LIÊN KẾT)
Hàng ngang 9: Hạt vô cùng nhỏ cấu tạo nên chất? (đáp án: NGUYÊN TỬ).
Hàng ngang 10: Trong nguyên tử, hạt không mang điện là? (đáp án: NEUTRON).
Từ khóa : GÓP CHUNG ELECTRON c) Sản phẩm:
- Câu trả lời của học sinh d) Tổ chức thực hiện:
- GV gọi HS chọn từ hàng ngang ngẫu nhiên
- Trong mỗi đáp án của từ hàng ngang có chứa chữ cái của từ khóa (được bôi đậm)
- HS có thể trả lời từ khóa khi chưa mở hết các từ hàng ngang
2. Hoạt động 2: Hình thành kiến thức mới
Hoạt động 1: Sự hình thành liên kết cộng hóa trị trong đơn chất, hợp chất
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Mục tiêu:
- Trình bày được khái niệm và lấy được ví dụ về liên kết cộng hóa trị (liên kết đơn, đôi,
ba) khi áp dụng quy tắc octet.
- Viết được công thức Lewis của 1 số chất đơn giản.
- Trình bày được khái niệm về liên kết cho – nhận
HOẠT ĐỘNG GV VÀ HS
SẢN PHẨM DỰ KIẾN
Giao nhiệm vụ học tập:
Phiếu học tập số 1 Cách chia nhóm: Cấu hình electron:
“Nhóm chuyên gia”: Chia lớp thành 6
+ H: 1s1 → có 1 electron ở lớp ngoài cùng.
nhóm, mỗi nhóm từ 6 đến 8 HS. Trong
+ Cl: 1s22s22p63s23p5 → có 7 electron ở lớp
mỗi nhóm, mỗi thành viên đánh số thứ tự ngoài cùng. từ 1 đến 6.
+ Phân tử chlorine: Mỗi nguyên tử chlorine “Nhóm mảnh ghép”:
có 7 electron hóa trị, hai nguyên tử chlorine
+ Các thành viên có STT 1,2 lập thành
liên kết với nhau bằng cách mỗi nguyên tử nhóm mới.
chlorine góp 1 e tạo thành 1 cặp electron
+ Các thành viên có STT 3,4 lập thành dùng chung. nhóm mới.
+ Các thành viên có STT 5,6 lập thành nhóm mới.
+ Phân tử hydrogen chloride: Nguyên tử
− Nhiệm vụ của các nhóm: Hoàn thành
hydrogen liên kết với nguyên tử chlorine PHT 1,2,3
bằng cách mỗi nguyên tử góp 1 e tạo thành Nhóm 1,2
Sự tạo thành liên kết hóa
1 cặp e dùng chung trong phân tử HCl. học trong phân tử Cl2, HCl. Nhóm 3,4
Sự tạo thành liên kết hóa học trong phân tử O2, Phiếu học tập 2 CO2. Cấu hình electron: Nhóm 5,6
Sự tạo thành liên kết hóa
+ C: 1s22s22p2 có 4 electron ở lớp ngoài học trong phân tử N2,
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Giáo án Bài 12: Liên kết cộng hóa trị Hóa học 10 Kết nối tri thức
1.8 K
893 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Bộ giáo án Hóa học 10 Kết nối tri thức được cập nhật liên tục trong gói này từ nay đến hết tháng 6/2023.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Bộ giáo án Hóa học 10 Kết nối tri thức năm 2023 mới, chuẩn nhất được thiết kế theo phong cách hiện đại, đẹp mắt, trình bày chi tiết cho từng bài học và bám sát chương trình Sách giáo khoa Hóa học 10 Kết nối tri thức.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(1785 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 10
Xem thêmTài liệu bộ mới nhất

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Ngày soạn: .../.../...
Ngày dạy: .../.../...
Trường: …………………….
Tổ: ………………………….
Họ và tên giáo viên:
………………………………..
BÀI 12: LIÊN KẾT CỘNG HÓA TRỊ (3 tiết)
I. MỤC TIÊU
1. Kiến thức
- Trình bày được khái niệm và lấy được ví dụ về liên kết cộng hóa trị (liên kết đơn,
đôi, ba) khi áp dụng quy tắc octet.
- Viết được công thức Lewis của một số chất đơn giản.
- Trình bày được khái niệm về liên kết cho - nhận
- Phân biệt được các loại liên kết (liên kết cộng hóa trị không phân cực, liên kết cộng
hóa trị phân cực, liên kết ion) dựa theo độ âm điện.
- Giải thích được sự hình thành liên kết σ và liên kết π qua sự xen phủ AO.
- Trình bày được khái niệm năng lượng liên kết (cộng hóa trị).
- Lắp ráp được mô hình một số phân tử có liên kết cộng hóa trị.
2. Năng lực
2.1. Năng lực chung
- Năng lực tự chủ và tự học: Kĩ năng tìm kiếm thông tin trong SGK, quan sát hình
ảnh về mô hình phân tử để tìm hiểu về liên kết cộng hóa trị, sự xen phủ các orbital
nguyên tử.
- Năng lực giao tiếp và hợp tác: Làm việc nhóm tìm hiểu về sự tạo thành liên kết
cộng hóa trị, lắp ráp mô hình phân tử, mô tả liên kết cộng hóa trị bằng sự xen phủ các
AO.
- Năng lực giải quyết vấn đề và sáng tạo: Giải thích được tại sao các phân tử có liên
kết cộng hóa trị được hình thành bằng sự góp chung electron.
2.2. Năng lực hóa học
a. Nhận thức hoá học: Học sinh đạt được các yêu cầu sau:
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Trình bày được:
- Liên kết cộng hóa trị trong các phân tử Cl
2
, HCl, NH
3
, O
2
, CO
2
, N
2
…
- Liên kết cho – nhận trong ion NH ; H
3
O
+
…
- Mối quan hệ giữa hiệu độ âm điện với liên kết hóa học.
- Mô tả sự xen phủ s – s, s – p, p – p của AO.
- Năng lượng liên kết đặc trưng cho độ bền liên kết.
b. Tìm hiểu tự nhiên dưới góc độ hóa học được thực hiện thông qua các hoạt động:
Thảo luận, tìm hiểu SGK, lắp ráp các mô hình phân tử, cắt dán sự xen phủ AO.
c. Vận dụng kiến thức, kĩ năng đã học để giải thích được tại sao có liên kết đơn, liên
kết đôi, liên kết ba, liên kết cho – nhận trong các hợp chất có liên kết cộng hóa trị.
3. Phẩm chất:
- Chăm chỉ, tự tìm tòi thông tin trong SGK về sự hình thành liên kết cộng hóa trị.
- HS có trách nhiệm trong việc hoạt động nhóm, hoàn thành các nội dung được giao.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
- Hình ảnh, video ...
- Phiếu bài tập số 1, số 2....
III. TIẾN TRÌNH DẠY HỌC
Kiểm tra bài cũ: Không kiểm tra đầu giờ, kiểm tra bài cũ lồng vào trong tiết học.
1. Hoạt động 1: Khởi động
a) Mục tiêu:
Huy động kiến thức đã học của HS, tạo nhu cầu tiếp tục tìm hiểu kiến thức mới.
b) Nội dung: GV tổ chức cho HS chơi trò chơi ô chữ. Mỗi ô hàng ngang được lật sẽ
chứa các chữ của từ khóa.
Hàng ngang 1: Phần tử mang điện tích dương được gọi là gì? (đáp án: CATION).
Hàng ngang 2: Hoàn thành câu sau: “Khi nguyên tử nhường hay nhận electron thì
nguyên tử trở thành phần tử .....” (đáp án: MANG ĐIỆN).
Hàng ngang 3: Ion Cl
-
có tên gọi là? (đáp án: ANION CHLORIDE).
Hàng ngang 4: Ở điều kiện thường, dạng tồn tại của NaCl là? (đáp án: TINH THỂ).
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Hàng ngang 5: Nguyên tử của loại nguyên tố hóa học nào thường có xu hướng nhận
electron để tạo thành phần tử mang điện âm ? (đáp án: PHI KIM).
Hàng ngang 6: Dung dịch nóng chảy của hợp chất ion có khả năng gì? (đáp án: DẪN
ĐIỆN).
Hàng ngang 7: Quy tắc bát tử còn có tên gọi khác là quy tắc ....? (đáp án: OCTET).
Hàng ngang 8: Sự kết hợp giữa ion Na
+
và ion Cl
-
tạo thành tinh thể NaCl gọi là gì?
(đáp án: LIÊN KẾT)
Hàng ngang 9: Hạt vô cùng nhỏ cấu tạo nên chất? (đáp án: NGUYÊN TỬ).
Hàng ngang 10: Trong nguyên tử, hạt không mang điện là? (đáp án: NEUTRON).
Từ khóa : GÓP CHUNG ELECTRON
c) Sản phẩm:
- Câu trả lời của học sinh
d) Tổ chức thực hiện:
- GV gọi HS chọn từ hàng ngang ngẫu nhiên
- Trong mỗi đáp án của từ hàng ngang có chứa chữ cái của từ khóa (được bôi đậm)
- HS có thể trả lời từ khóa khi chưa mở hết các từ hàng ngang
2. Hoạt động 2: Hình thành kiến thức mới
Hoạt động 1: Sự hình thành liên kết cộng hóa trị trong đơn chất, hợp chất
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mục tiêu:
- Trình bày được khái niệm và lấy được ví dụ về liên kết cộng hóa trị (liên kết đơn, đôi,
ba) khi áp dụng quy tắc octet.
- Viết được công thức Lewis của 1 số chất đơn giản.
- Trình bày được khái niệm về liên kết cho – nhận
HOẠT ĐỘNG GV VÀ HS SẢN PHẨM DỰ KIẾN
Giao nhiệm vụ học tập:
Cách chia nhóm:
“Nhóm chuyên gia”: Chia lớp thành 6
nhóm, mỗi nhóm từ 6 đến 8 HS. Trong
mỗi nhóm, mỗi thành viên đánh số thứ tự
từ 1 đến 6.
“Nhóm mảnh ghép”:
+ Các thành viên có STT 1,2 lập thành
nhóm mới.
+ Các thành viên có STT 3,4 lập thành
nhóm mới.
+ Các thành viên có STT 5,6 lập thành
nhóm mới.
− Nhiệm vụ của các nhóm: Hoàn thành
PHT 1,2,3
Nhóm 1,2 Sự tạo thành liên kết hóa
học trong phân tử Cl
2
,
HCl.
Nhóm 3,4 Sự tạo thành liên kết hóa
học trong phân tử O
2
,
CO
2
.
Nhóm 5,6 Sự tạo thành liên kết hóa
học trong phân tử N
2
,
Phiếu học tập số 1
Cấu hình electron:
+ H: 1s
1
→ có 1 electron ở lớp ngoài cùng.
+ Cl: 1s
2
2s
2
2p
6
3s
2
3p
5
→ có 7 electron ở lớp
ngoài cùng.
+ Phân tử chlorine: Mỗi nguyên tử chlorine
có 7 electron hóa trị, hai nguyên tử chlorine
liên kết với nhau bằng cách mỗi nguyên tử
chlorine góp 1 e tạo thành 1 cặp electron
dùng chung.
+ Phân tử hydrogen chloride: Nguyên tử
hydrogen liên kết với nguyên tử chlorine
bằng cách mỗi nguyên tử góp 1 e tạo thành
1 cặp e dùng chung trong phân tử HCl.
Phiếu học tập 2
Cấu hình electron:
+ C: 1s
2
2s
2
2p
2
có 4 electron ở lớp ngoài
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
NH
3
.
Nhóm mảnh ghép:
Các HS chuyên sâu lần lượt sẽ trình bày
về Sự tạo thành liên kết hóa học trong các
phân tử mà nhóm chuyên sâu của mình đã
nghiên cứu. Sau đó hoàn thành PHT số 4
Bước 2: HS thực hiện nhiệm vụ
− HS làm việc tại nhóm chuyên gia theo
phân công.
− HS lập nhóm mảnh ghép, HS chuyên
gia trình bày cho các HS còn lại. Các HS
trong nhóm mảnh ghép tổng hợp ý kiến
và hoàn thành PHT 4.
Báo cáo, thảo luận: Đại diện nhóm HS
đưa ra nội dung kết quả thảo luận của
nhóm.
Kết luận, nhận định: GV nhận xét, đưa
ra kết luận:
- Liên kết cộng hóa trị được tạo thành
giữa 2 nguyên tử bằng một hay nhiều cặp
electron dùng chung.
- Liên kết đơn (-): thay 1 cặp electron
dùng chung bằng 1 dấu gạch nối.
- Liên kết đôi (=): thay 2 cặp electron
dùng chung bằng 2 dấu gạch nối.
- Liên kết ba (≡): thay 3 cặp electron dùng
chung bằng 3 dấu gạch nối.
- Liên kết cộng hóa trị không phân cực có
cùng;
+ O: 1s
2
2s
2
2p
4
có 6 electron ở lớp ngoài
cùng.
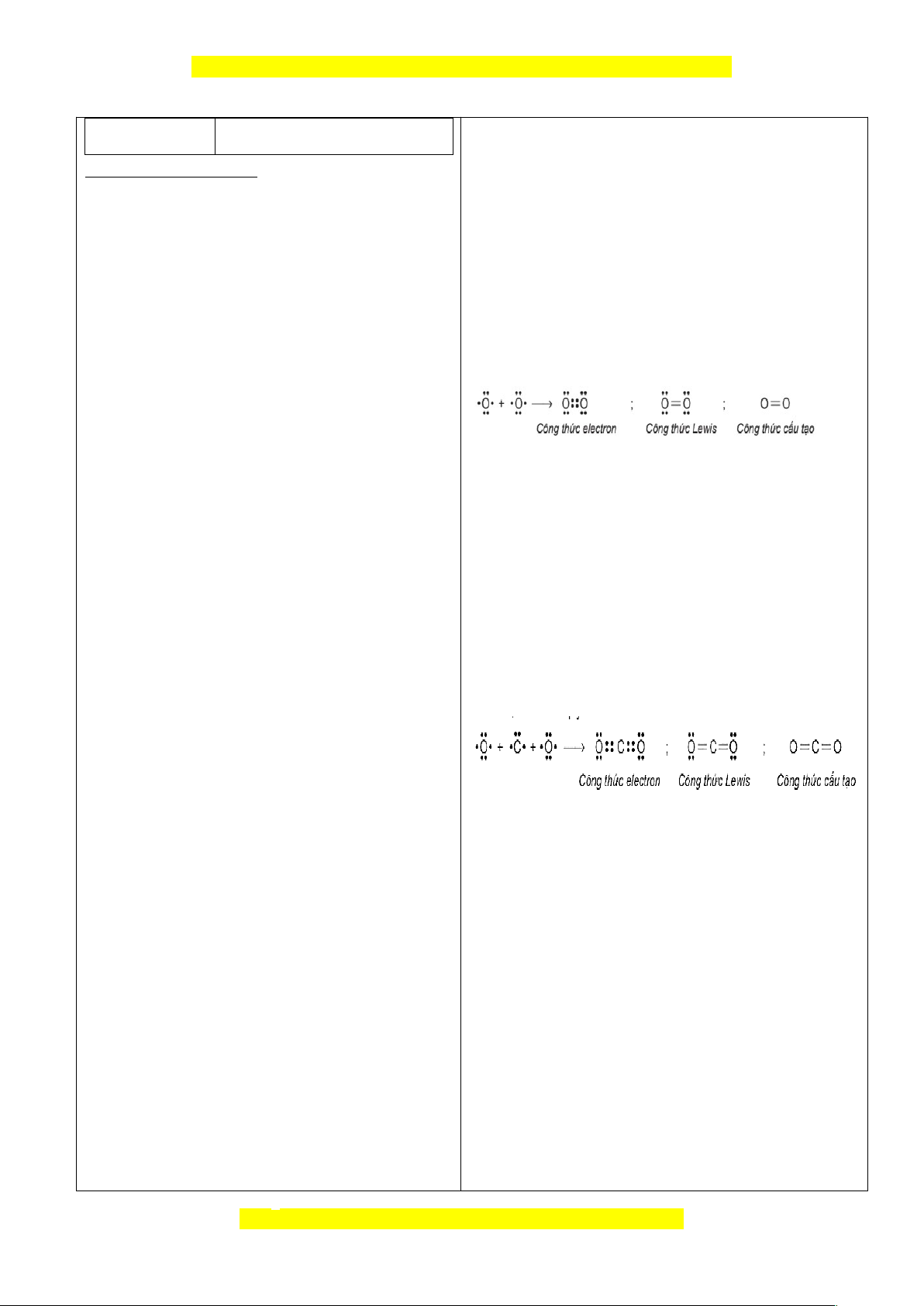
Phân tử O
2
: Hai nguyên tử oxygen liên kết
với nhau bằng cách mỗi nguyên tử đóng góp
2 electron tạo thành 2 cặp electron dùng
chung.
Phân tử CO
2
: Nguyên tử carbon có 4 e hóa
trị, nguyên tử oxygen có 6 e hóa trị. Hai
nguyên tử oxygen liên kết với 1 nguyên tử
carbon bằng cách mỗi nguyên tử oxygen
góp 2 electron và nguyên tử carbon góp 4
electron tạo thành 4 cặp electron dùng
chung.
Phiếu học tập số 3
Cấu hình electron của:
+ H (Z = 1): 1s
1
có 1 electron ở lớp ngoài
cùng.
+ N (Z = 7): 1s
2
2s
2
2p
3
có 5 electron ở lớp
ngoài cùng.
+ Phân tử nitrogen: Hai nguyên tử nitrogen
liên kết với nhau bằng cách mỗi nguyên tử
đóng góp 3 electron tạo thành 3 cặp electron
dùng chung.
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85























