Ngày soạn: .../.../... Ngày dạy: .../.../...
Trường: ……………………. Họ và tên giáo viên:
Tổ: ………………………….
………………………………..
BÀI 18: ÔN TẬP CHƯƠNG 5 (1 tiết) I. Mục tiêu 1. Về kiến thức
– Trình bày được khái niệm phản ứng toả nhiệt, thu nhiệt; điều kiện chuẩn (áp suất 1 bar
và thường chọn nhiệt độ 25oC hay 298 K); enthalpy tạo thành (nhiệt tạo thành) và biến
thiên enthalpy (nhiệt phản ứng) của phản ứng.
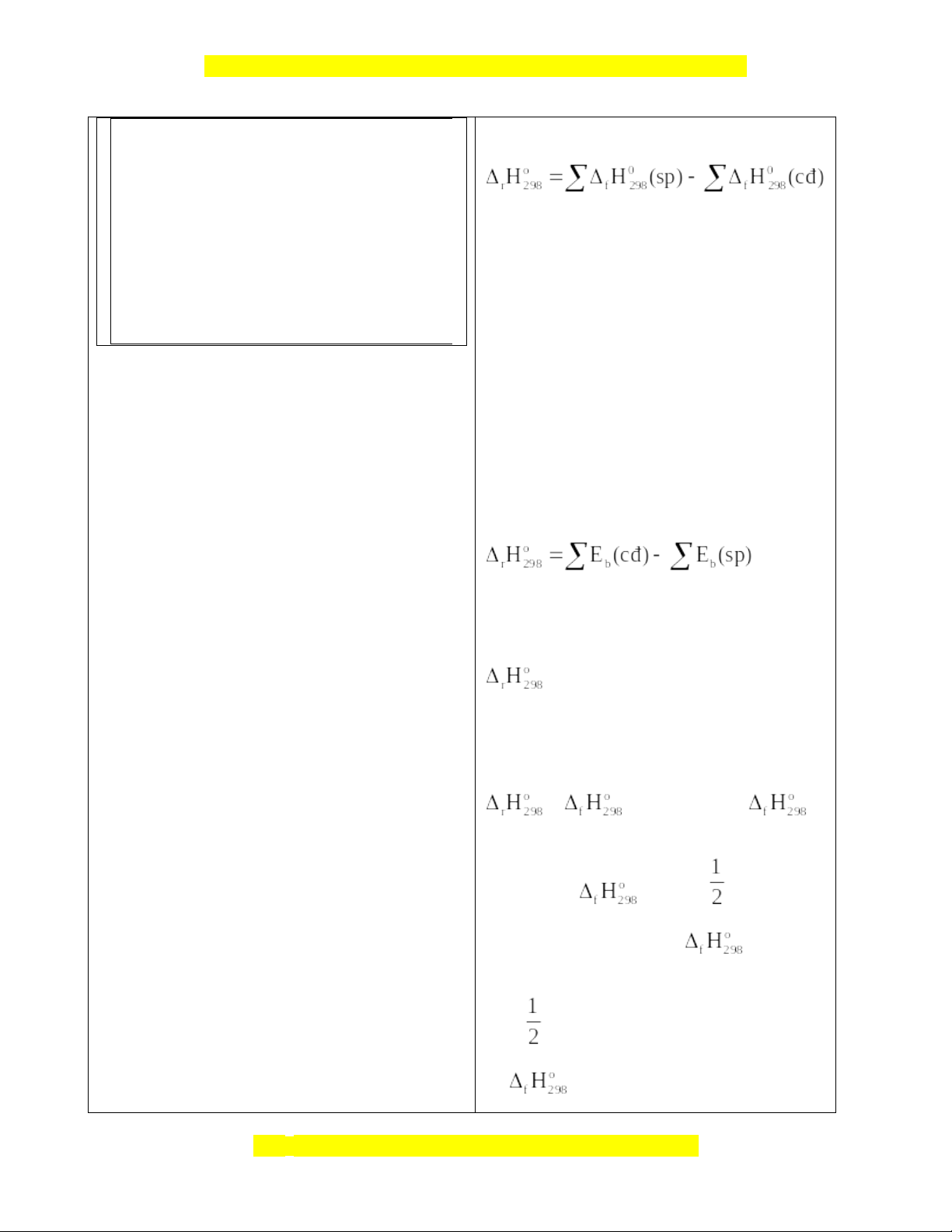
– Nêu được ý nghĩa của dấu và giá trị – Tính được
của một phản ứng dựa vào bảng số liệu năng lượng liên kết, nhiệt
tạo thành cho sẵn, vận dụng công thức: và ,
là tổng năng lượng liên kết trong phân tử chất đầu và sản phẩm phản ứng. 2. Về năng lực:
a. Năng lực chung: HS hình thành năng lực giao tiếp và hợp tác, năng lực giải quyết
vấn đề và sáng tạo thông qua việc tham gia đóng góp ý kiến trong nhóm và tiếp thu sự
góp ý, hỗ trợ của các thành viên trong nhóm; Lập kế hoạch giải quyết các vấn đề được yêu cầu.
b. Năng lực hóa học
* Năng lực nhận thức hóa học:
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
- Nhận biết được phản ứng tỏa nhiệt hay thu nhiệt dựa vào dấu và giá trị
- Tính được enthalpy tạo thành (nhiệt tạo thành)
và biến thiên enthalpy (nhiệt
phản ứng) của phản ứng
* Năng lực tìm hiểu thế giới tự nhiên dưới góc độ hóa học
Thông qua các hoạt động thảo luận, quan sát thực tiễn, tìm hiểu thông tin, tính toán hóa
học để vận dụng ý nghĩa trong thực tiễn.
* Năng lực vận dụng kiến thức, kĩ năng dưới góc độ hóa học
Học sinh biết ứng dụng giải thích hiện tượng thực tiễn
3. Về phẩm chất: Góp phần hình thành và phát triển phẩm chất chăm chỉ, trung thực, trách nhiệm.
II. Thiết bị dạy học và học liệu - Máy tính, máy chiếu.
- Các phiếu học tập, câu hỏi kiểm tra đánh giá theo từng mức độ.
III. Tiến trình dạy học
Kiểm tra bài cũ: Kết hợp trong bài 3. Bài mới
1. Hoạt động 1: Khởi động a) Mục tiêu:
– Nêu được ý nghĩa của dấu và giá trị – Tính được
của một phản ứng dựa vào bảng số liệu năng lượng liên kết, nhiệt
tạo thành cho sẵn, vận dụng công thức: và ,
là tổng năng lượng liên kết trong phân tử chất đầu và sản phẩm phản ứng.
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
b) Nội dung: HĐ nhóm hoàn thành phần hệ thống hóa kiến thức trong SGK c) Sản phẩm:
Chất phản ứng → Sản phẩm
> 0 (phản ứng thu nhiệt)
< 0 (phản ứng tỏa nhiệt)
Tính biến thiên enthalpy của phản ứng theo nhiệt tạo thành (ở điều kiện tiêu chuẩn):
Tính biến thiên enthalpy của phản ứng (mà các chất đều ở thể khí) theo năng lượng liên
kết (ở điều kiện tiêu chuẩn): d) Tổ chức thực hiện:
+ Giao nhiệm vụ học tập
GV chia lớp thành các nhóm học tập (mỗi bàn 1 nhóm nhỏ)
+ Thực hiện nhiệm vụ học tập: HS thực hiện nhiệm vụ,
+ Báo cáo, thảo luận
- GV mời một HS báo cáo kết quả, các HS khác góp ý, bổ sung, phản biện cho nhau.
- Nếu HS vẫn không giải quyết được, GV có thể gợi ý cho HS.
+ Kết luận, nhận định: GV chốt lại kiến thức.
2. Hoạt động 2: Hình thành kiến thức mới/giải quyết vấn đề/ thực thi nhiệm vụ đặt
ra từ Hoạt động 1.
Hoạt động 2.1. Kiến thức cần nhớ
Mục tiêu: Củng cố cho HS kiến thức về năng lượng hóa học
Hoạt động của GV và HS
Sản phẩm dự kiến
Giao nhiệm vụ học tập: GV chia lớp làm
4 nhóm, hoàn thành phiếu bài tập sau: enthalpy của phản ứng Tính biến thiên
PHIẾU BÀI TẬP SỐ 1
theo nhiệt tạo thành ( ở điều kiện tiêu
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Viết công thức tính nhiệt tạo thành chuẩn):
của chất tham gia phản ứng và sản phẩm phản ứng.
Hoàn thành bài tập số 1 và số 2
Từ đó rút ra công thức tính nhiệt tạo trong SGK.
thành của chất tham gia phản ứng và
GV chia HS thành 4 nhóm, mỗi nhóm sản phẩm phản ứng.
một phần nội dung trong phiếu học tập số Tính biến thiên enthalpy của phản ứng
1, các nhóm thảo luận và điền vào bảng (mà các chất đều ở thể khí) theo năng phụ.
lượng liên kết ( ở điều kiện tiêu
+ Nhóm 1, 2 : Công thức tính tính nhiệt chuẩn):
tạo thành của chất tham gia phản ứng và
sản phẩm phản ứng. Bài tập số 1.
Đáp án bài tập số 1, 2.
+ Nhóm 3, 4: Công thức tính tính nhiệt Bài 1: Đáp án A.
tạo thành của chất tham gia phản ứng và
sản phẩm phản ứng. Bài tập số 2.
> 0 ⇒ Phản ứng thu nhiệt.
Thực hiện nhiệm vụ: HS hoàn thành ⇒ P đỏ bền hơn P trắng.
phiếu bài tập theo 4 nhóm. Bài 2: Đáp án A
Báo cáo, thảo luận: Đại diện nhóm HS = (CO2(g)).1 – [
đưa ra nội dung kết quả thảo luận của nhóm. (CO(g)) + (O2(g)). ]
Kết luận, nhận định: GV nhận xét, đưa ra kết luận. ⇒ - 283 = - 393,5.1 – [ (CO(g)) + 0. ] ⇒ (CO(g)) = - 110,5 kJ
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Giáo án Bài 18: Ôn tập chương 5 Hóa học 10 Kết nối tri thức
1.2 K
583 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Bộ giáo án Hóa học 10 Kết nối tri thức được cập nhật liên tục trong gói này từ nay đến hết tháng 6/2023.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Bộ giáo án Hóa học 10 Kết nối tri thức năm 2023 mới, chuẩn nhất được thiết kế theo phong cách hiện đại, đẹp mắt, trình bày chi tiết cho từng bài học và bám sát chương trình Sách giáo khoa Hóa học 10 Kết nối tri thức.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(1165 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 10
Xem thêmTài liệu bộ mới nhất

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
BÀI 18: ÔN TẬP CHƯƠNG 5
(1 tiết)
I. Mục tiêu
1. Về kiến thức
!"#$%&'&#()#*+)"#!),-%)./0
!#123
4025678*90:%-#8;
90:%-#%&'8!<0%&'
) !=>0!<0.)?
@ ! !<0$1%&'A0&B:#)C: :";(#
!D(EF!G'!
( :C: :";%HI!.J)&%,$%&
'
2. Về năng lực:
a. Năng lực chungKC:A!0;% %!(C:A!&L);
.+GL)0#!0$0MM%=";M$;%)A
M%=(N !<0!!M$*OE%";!&L);!!.+ !
)!J)
b. Năng lực hóa học
* Năng lực nhận thức hóa học:
Mọithắc mắc vui lòng xin liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
PE; !%&'Q0#0)#A0.)?
P@ !90:%-#8 ;90:%-#
%&'8!<0%&'
* Năng lực tìm hiểu thế giới tự nhiên dưới góc độ hóa học
GL)0!!1&:)E(L)0A!R($S)G(@M0
!SEF=>0 A!R
* Năng lực vận dụng kiến thức, kĩ năng dưới góc độ hóa học
!;'F&@!# A!R
3. Về phẩm chất:TM%%J%S%,$!.!C$!U()A!(
!#$
II. Thiết bị dạy học và học liệu
PV@($!;)
P4!%;)!E%(!H)Q"S$09W$'!1
III. Tiến trình dạy học
Kiểm tra bài cũ: Kết hợp trong bài
3. Bài mới
1. Hoạt động 1: Khởi động
08VF!)
) !=>0!<0.)?
@ ! !<0$1%&'A0&B:#)C: :";(#
!D(EF!G'!
( :C: :";%HI!.J)&%,$%&
'
Mọithắc mắc vui lòng xin liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
81)XM$%J#BM0";'!KT7
!8K&%,$
4.%&'YK&%,$
Z[-%&')#8
\[-%&'Q0#8
@;90:%!<0%&'9#-]+)"#)!),8
@;90:%!<0%&'-$!!!.+)]S"@89C: :
";-]+)"#)!),8
8!'!A!#
+ Giao nhiệm vụ học tập
T^!0:_%!!M$!E%-$N/M$Q8
+ Thực hiện nhiệm vụ học tập:KA!##$F(
+ Báo cáo, thảo luận
PT^$$1K!";L)&(!!K"!M%=()(%&#!0)
P;)K`"G&L); !(T^!MS =!K
+ Kết luận, nhận địnhT^!B:";'!
2. Hoạt động 2: Hình thành kiến thức mới/giải quyết vấn đề/ thực thi nhiệm vụ đặt
ra từ Hoạt động 1.
Hoạt động 2.1. Kiến thức cần nhớ
Mục tiêu:4<!B!K";'!+C: M0!
Hoạt động của GV và HS Sản phẩm dự kiến
Giao nhiệm vụ học tập: T^!0:_%:$
aM$(%;)E%0)b
PHIẾU BÀI TẬP SỐ 1
@;
90:%!<0%&'
9#-]+)"#)
Mọithắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Viết công thức tính nhiệt tạo thành
của chất tham gia phản ứng và sản
phẩm phản ứng.
Hoàn thành bài tập số 1 và số 2
trong SGK.
T^ !0 K a M$( $N M$
$1%J1)%;)!E%B
/(!!M$&:)E+&
%F
cM$/(24G'!@ @#
!<0!.0$0%&'
&%,$%&'dE%B/
cM$e( a4G'!@ @#
!<0!.0$0%&'
&%,$%&'dE%B2
Thực hiện nhiệm vụ: K
%;)E%9aM$
Báo cáo, thảo luận: X#M$K
0 0 1 ) "; L)& & :)E !<0
M$
Kết luận, nhận định:T^Efg(0
0";:)E
!),8
WMh0!G'!@#
!<0!.0$0%&'
&%,$%&'
@;90:%!<0%&'
-$!!!.+)]S"@89C
: : "; - ] +) "# )
!),8
X%E%B/(2
Bài 1: Đáp án A
Z[⇒i&')#
⇒iQ+jik
Bài 2: Đáp án A
l -4m
2
-88/n
-4m-88c -m
2
-88 o
⇒P26elPe5e(3/n -4m-88
c[ o
⇒ -4m-88lP//[(3"p
Mọithắc mắc vui lòng xin liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Hoạt động 2.2. Bài tập
Mục tiêu:iSC:A! %!(C:A!@M0!!!
+ Giao nhiệm vụ học tập
PT^!0KaM$
cM$/(edE%e(a
cM$2(adE%3
+ Thực hiện nhiệm vụ học tập: &
:)EA!##$F
+ Báo cáo, thảo luận
HĐ chung cả lớp:
PT^$$1K!";L)&(!!
K"!M%=()( %&#!
0)
+ Kết luận, nhận địnhT^!B:";
'!
X%E%e(a(3
Bài 3: Đáp án A.
7B: !<0:)!93[[$O
)?!:)!93q:
$
:)!9
l l23(30$
mfM0/6[0$-/$:8:)!9&0
#: :26[e(["p
⇒ mf M0 23(3 0$ :)!9 & 0
#: : "p
Bài 4: Đáp án C
2r
-448c6r
-48
l2easc6a/6la[es"p
/r
-4l48c6r
-48
l/s/2c6a/6le53s"p
⇒ l
a[ese53sl6["p
Bài 5:
l
P
Mọithắc mắc vui lòng xin liên hệ hotline: 084 283 45 85























