Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có đáp án) SỞ GIÁO D C Ụ VÀ ĐÀO T O Ạ KỲ THI CH N Ọ H C Ọ SINH GI I Ỏ C P Ấ C Ơ SỞ ĐI N Ệ BIÊN NĂM H C Ọ 2022-2023 Môn: Hóa h c ọ – L p ớ 10 Đ C Ề HÍNH Ngày thi: 02/4/2023 TH C Ứ (Đ ề thi có 03 trang) Th i
ờ gian làm bài: 150 phút (không k ể th i ờ gian giao đ ) ề Đ Ề BÀI
Cho số hiệu nguyên t
ử và nguyên t ử kh i
ố các nguyên tố H B C N O F N M Al Si P S Cl K C F a g a e Z 1 5 6 7 8 9 11 12 13 14 15 16 17 19 20 26 NTK 1 11 12 14 16 19 23 24 27 28 31 32 35, 39 40 56 5
Câu 1 (4,5 điểm)
Nguyên tố M có trong máu ngư i ờ n ng ồ đ ộ bình thư ng
ờ là 3,5 – 5,0 mmol/l. Trong cơ th , ể nguyên tố M giúp đi u ề hòa cân b ng ằ nư c ớ và đi n ệ gi i, ả giúp duy trì ho t ạ đ ng ộ bình thư ng, ờ đặc bi t ệ là c a ủ hệ tim m c ạ h, cơ b p ắ , tiêu hóa, ti t ế ni u
ệ . Trên cơ tim ion M+ làm giảm l c ự co bóp, gi m ả tính ch u ị kích thích và gi m ả d n ẫ truy n. ề T ng ổ s ố h t ạ proton, neutron
và electron trong nguyên tử nguyên tố M là 58, trong đó s ố h t ạ mang đi n ệ nhi u ề h n ơ s ố h t ạ không mang đi n ệ là 18.
Nguyên tố X có trong thành ph n ầ c a ủ các ch t ấ có tác d ng ụ oxi hoá và sát khu n ẩ c c ự mạnh, thư ng ờ đư c ợ sử d ng ụ v i ớ m c
ụ đích khử trùng và t y ẩ tr ng ắ trong lĩnh v c ự thu ỷ s n, ả dệt nhu m, ộ xử lí nư c ớ c p ấ , nư c ớ th i, ả nư c ớ b ể b i. ơ Oxide cao nh t ấ c a ủ X có công th c ứ là X2O7. Trong h p ợ ch t ấ hydride (h p ợ ch t ấ c a ủ X v i ớ H) nguyên tố X chi m ế 97,26% v ề kh i ố lư ng. ợ 1. Vi t
ế cấu hình electron nguyên t ử c a ủ nguyên t ố M và X. Xác đ nh ị v ịtrí c a ủ M và X trong
bảng tuần hoàn các nguyên t ố hóa h c ọ . 2. Bi u ể di n ễ electron hóa trị c a
ủ M và X vào ô orbital, xác đ nh ị b ộ b n ố s ố lư ng ợ t ử electron cuối cùng c a ủ M và X. 3. Vi t ế công th c ứ oxide ng ứ v i ớ hóa trị cao nh t ấ và hydroxide tư ng ơ ng ứ c a ủ M và X, nêu tính acid-base c a ủ chúng. 4. Mô tả s ự hình thành liên k t ế trong phân t ử MX. 5. So sánh (có gi i
ả thích) bán kính ion M+ và X-.
Câu 2 (1,5 điểm) Đồng (Copper) là v t â d ng ụ d ễ dát m ng, o có kh ả năng d n ẫ đi n ệ và d n ẫ nhi t ệ t t. ố Vì th ế đồng đư c ợ s ử d ng ụ r t ấ nhi u ề trong đ i ờ sống. Các đ ồ dùng t ư đ ng ồ nh : ư dây đi n, ệ que hàn đ ng ồ , tay c m ầ và các đ ồ dùng n i ộ
thất trong nhà, đúc tư ng ợ , các đ ng ộ cơ
máy móc,… Nguyên tố này có hai đ ng ồ vị b n ề v i ớ số kh i ố l n ầ lư t ợ là 63 và 65. Bi u ể đồ bên thể hi n ệ phổ kh i ố lư ng ợ c a ủ m t ộ m u ẫ Copper t ự nhiên. M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có đáp án) 1. Tính nguyên t ử khối trung bình c a ủ m u ẫ Copper. 2. Tính hàm lư ng ợ 65 ặ ặ ọ ấ 2 C 9
u trong qu ng chalcopyrit CuFeS2 (đây là qu ng quan tr ng nh t c a ủ Copper trong t ự nhiên).
Câu 3 (3,5 điểm)
1. Hai nguyên tố X, Y n m
ằ trong cùng 1 chu kì, thu c ộ hai nhóm A liên ti p. ế T ng ổ số h t ạ mang đi n ệ trong hai nguyên t ử X và Y là 26. a) Xác đ nh ị kí hi u ệ hóa h c ọ c a ủ X, Y. b) Xác đ nh ị tính ch t ấ hóa h c ọ c a ủ X, Y (kim lo i, ạ phi kim, khí hi m) ế . So sánh tính ch t ấ hóa h c ọ của hai nguyên t ố này. c) Vi t ế công th c ứ Lewis, công th c ứ c u ấ t o ạ c a ủ hydroxide ng ứ v i ớ hóa trị cao nh t ấ c a ủ X,
Y. So sánh tính acid-base c a ủ chúng.
2. Ethene (C2H4) là m t ộ ch t ấ sinh trư n
ở g tự nhiên, có khả năng thúc đ y ẩ quá trình chín c a ủ nhi u ề lo i
ạ trái cây. Ammonia (NH3) ở đi u ề ki n ệ thư n ờ g là ch t
ấ khí, có mùi hôi khó ch u ị . Khi hít ph i ả NH3 n n ồ g đ ộ cao có th ể t n ổ thư n ơ g ph i ổ , th m â chí t ử vong. a) Áp d ng ụ lai hóa orbital, mô t ả s ự hình thành liên k t
ế trong phân tử NH3 và C2H4. b) D ự đoán (có gi i ả thích) tính tan c a ủ hai khí trên trong nư c ớ .
Câu 4 (4,0 điểm)
1. Copper (II) sulfate đư c ợ dùng để di t ệ t o, ả rong rêu trong nư c ớ bể b i, ơ dùng để pha chế thuốc Bordaux (trư b nh ệ m c ố sư ng
ơ trên cây cà chua, khoai tây, b nh ệ th i ố thân trên cây ăn qu , ả cây công nghi p) ệ ,… Trong công nghi p
ệ copper (II) sulfate thư ng ờ đư c ợ s n ả xu t ấ b ng ằ cách ngâm đ ng ồ ph ế li u ệ trong dung d c
ị h sulfuric acid loãng và s c ụ không khí:
Cu + H2SO4 + O2 → CuSO4 + H2O (1)
Copper (II) sulfate còn đư c ợ đi u ề chế b ng ằ cách cho đ ng ồ phế li u ệ tác d ng ụ v i ớ sulfuric acid đ c ặ nóng:
Cu + H2SO4 đặc, nóng → CuSO4 + SO2 + H2O (2) a) Cân b ng ằ hai ph n ả ng ứ trên b ng ằ phư ng ơ pháp thăng b ng ằ electron.
b) Trong hai cách trên cách nào sử d ng ụ ít sulfuric acid h n,
ơ cách nào ít gây ô nhi m ễ môi trư ng ờ h n? ơ 2. Sự có m t ặ c a
ủ khí SO2 trong không khí là m t ộ trong nh ng ữ nguyên nhân gây ra hi n ệ tư ng ợ m a ư acid. N ng ồ độ c a ủ SO2 có thể xác đ nh ị b ng ằ cách chu n ẩ độ v i ớ dung d c ị h
potassium permanganate theo ph n ả ng ứ sau:
SO2 + KMnO4 + H2O → K2SO4 + MnSO4 + H2SO4 a) Cân b ng ằ ph n ả ng
ứ oxi hoá - khử trên theo phư ng ơ pháp thăng b ng ằ electron. b) Bi t ế m t ộ m u ẫ không khí ph n ả ng ứ v a ư đ ủ v i ớ 8,600 mL dung d c ị h KMnO4 0,008M. Tính khối lư ng ợ (miligam) c a ủ SO2 có trong m u ẫ không khí đó.
3. Đốt cháy hoàn toàn 7,8 gam h n ỗ h p ợ A g m ồ Mg và Al c n ầ v a ư đ ủ 5,6 lít h n ỗ h p ợ khí X
gồm O2 và Cl2 (đktc), thu đư c ợ 19,7 gam ch t ấ r n. ắ Tính thành ph n ầ ph n ầ trăm kh i ố lư ng ợ tưng kim loại trong A.
Câu 5 (2,5 điểm) 1. Phản ng ứ phân h y ủ m t ộ lo i ạ h p ợ ch t ấ kháng sinh có h ệ s ố nhi t ệ đ ộ là 2,7. Ở 270C sau 10 giờ thì lư ng ợ hoạt chất giảm đi m t ộ n a ử . M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có đáp án) a) Khi đ a ư vào c ơ th ể ngư i ờ (370C) thì lư ng ợ chất giảm đi m t ộ n a ử sau bao lâu? b) Sau bao lâu thì ho t ạ ch t ấ kháng sinh này trong c ơ th ể ngư i ờ còn l i ạ 12,5% so v i ớ ban đ u ầ . 2. Cho phản ng: ứ
BrO -3(aq) + 5Br-(aq) + 6H+(aq) → 3Br2(aq) + 3H2O(l) Tốc độ c a ủ ph n ả ng ứ có th ể đo đư c ợ d a ự vào s ự ph ụ thu c ộ n ng ồ đ ộ đ u ầ c a ủ các ch t ấ phản ứng. K t ế quả c a ủ thí nghi m ệ đư c ợ cho ở b ng ả sau: Nồng đ ộ đầu c a ủ các ch t ấ (mol/L) v Thí nghi m ệ 0 BrO -3 Br- H+ (mol/L.s) 1 0,10 0,10 0,10 1,2.10-3 2 0,20 0,10 0,10 2,4.10-3 3 0,10 0,30 0,10 3,5.10-3 4 0,20 0,10 0,15 5,4.10-3 Vi t ế bi u ể thức t c ố đ ộ ph n ả ng. ứ
Câu 6 (2,0 điểm)
1. Nescafe đã s n ả xu t
ấ thành công lon cafe tự làm nóng. Đ ể làm nóng cafe, ch ỉc n ầ n ấ nút (trên lon) để tr n ộ nguyên li u ệ g m ồ 1 dung d c ị h KOH ho c ặ NaOH r t ấ loãng và CaO; 210 mL cafe trong lon s ẽ đư c ợ hâm nóng đ n ế kho ng ả 400C. a) Vi t ế phư ng ơ trình ph n ả ng ứ x y ả ra gi a ữ các nguyên li u ệ dùng đ ể đun nóng cafe (khi n ấ nút). Hãy tính hi u ệ ng ứ nhi t ệ c a ủ ph n ả ng ứ này. Cho bi t: ế Ca(OH)2 CaO H2O ∆ 0 (kJ/mo -1003 -635 -286 f H 298 l) b) Giả sử nhi t ệ dung riêng c a ủ cafe là 4,18 J/K.g (Nhi t ệ dung riêng là nhi t ệ lư ng ợ c n ầ cung cấp để 1 gam ch t ấ tăng lên 1 đ ) ộ . Hãy tính lư ng ợ nhi t ệ c n ầ cung c p ấ đ ể làm nóng 210mL cafe tư 00C đ n
ế 400C (d = 1,0 g/mL). Hãy tính lư ng ợ CaO c n ầ đ ể th c ự hi n ệ nhi m ệ v ụ này. Giả s ử hi u ệ ng ứ nhi t ệ c a ủ ph n ả ng ứ
trên không đổi trong khoảng nhi t ệ đ ộ đang xét.
2. Khi cho 32,69 gam Zn tác d n ụ g v i ớ dung d c
ị h H2SO4 loãng dư trong bom nhi t ệ lư n ợ g
kế (V = const) ở 250C, ngư i ờ ta th y ấ có thoát ra m t ộ nhi t ệ lư ng ợ là 71,48 kJ. Tính hi u ệ ng ứ nhiệt (kJ) c a ủ phản ng ứ ở nhi t ệ đ
ộ đó. Cho NTK Zn = 65,38 đvC.
Câu 7 (2,0 điểm) 1. Khi chi u ế m t ộ chùm b c ứ x ạ đi n ệ t ư có bư c
ớ sóng λ = 58,40 nm lên m t ộ m u ẫ Kripton (Kr) thì th y ấ chùm electron b t â ra kh i o Kripton và chuy n ể đ ng ộ v i ớ t c ố đ ộ v = 1,59.106 m/s. Xác định năng lư ng ợ ion hóa th ứ nh t ấ c a ủ Kripton (eV).
Cho h = 6,626.10-34Js; c = 3.108m/s; me = 9,1.10-31kg. 2. Thực nghi m ệ cho bi t, ế NH3 phản ng ứ v i ớ BF3 tạo ra m t ộ ch t ấ r n ắ X duy nh t, ấ có màu trắng. a) Vi t ế phư ng ơ trình hóa h c ọ c a ủ ph n ả ng. ứ b) Vi t ế công th c ứ Lewis c a ủ m i ỗ phân tử trong ph n ả ng ứ trên. Cho bi t ế d ng ạ hình h c ọ c a ủ mỗi phân t ử đó theo thuy t ế VSEPR.
c) Dự đoán giá trị c a ủ góc liên k t ế trong phân t ử ch t ấ X. M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có đáp án)
3. Sử dụng thuyết orbital phân tử (thuy t ế MO) để gi i ả thích t i ạ sao năng lư n ợ g ion hóa
thứ nhất của phân tử nitrogen (1501 kJ/mol) l n ớ h n ơ năng lư n ợ g ion hóa thứ nh t ấ c a ủ
nguyên tử nitrogen (1402 kJ/mol).
Lưu ý: Thí sinh không đư c ợ phép s ử d ng ụ tài li u ệ (bao g m ồ c ả b ng ả tu n
ầ hoàn các nguyên tố hóa h c ọ ), cán b
ộ coi thi không gi i ả thích gì thêm.
-------------H t- ế ----------- SỞ GIÁO D C Ụ VÀ ĐÀO T O Ạ KỲ THI CH N Ọ H C Ọ SINH GI I Ỏ C P Ấ C Ơ SỞ ĐI N Ệ BIÊN NĂM H C Ọ 2022-2023 Môn: Hóa h c ọ – L p ớ 10 HƯ N Ớ G D N Ẫ CH M Ấ Ngày thi: 02/4/2023 (HDC có 07 trang)
Câu 1 (4,5 điểm)
Nguyên tố M có trong máu ngư i ờ n ng ồ đ ộ bình thư ng
ờ là 3,5 – 5,0 mmol/l. Trong cơ th , ể nguyên tố M giúp đi u ề hòa cân b ng ằ nư c ớ và đi n ệ gi i, ả giúp duy trì ho t ạ đ ng ộ bình thư ng, ờ đặc bi t ệ là c a ủ hệ tim m c ạ h, cơ b p ắ , tiêu hóa, ti t ế ni u
ệ . Trên cơ tim ion M+ làm giảm l c ự co bóp, gi m ả tính ch u ị kích thích và gi m ả d n ẫ truy n. ề T ng ổ s ố h t ạ proton, neutron
và electron trong nguyên tử nguyên tố M là 58, trong đó s ố h t ạ mang đi n ệ nhi u ề h n ơ s ố h t ạ không mang đi n ệ là 18.
Nguyên tố X có trong thành ph n ầ c a ủ các ch t ấ có tác d ng ụ oxi hoá và sát khu n ẩ c c ự mạnh, thư ng ờ đư c ợ sử d ng ụ v i ớ m c
ụ đích khử trùng và t y ẩ tr ng ắ trong lĩnh v c ự thu ỷ s n, ả dệt nhu m, ộ xử lí nư c ớ c p ấ , nư c ớ th i, ả nư c ớ b ể b i. ơ Oxide cao nh t ấ c a ủ X có công th c ứ là X2O7. Trong h p ợ ch t ấ hydride (h p ợ ch t ấ c a ủ X v i ớ H) nguyên tố X chi m ế 97,26% v ề kh i ố lư ng. ợ 1. Vi t
ế cấu hình electron nguyên t ử c a ủ nguyên t ố M và X. Xác đ nh ị v ịtrí c a ủ M và X trong
bảng tuần hoàn các nguyên t ố hóa h c ọ . 2. Bi u ể di n ễ electron hóa trị c a
ủ M và X vào ô orbital, xác đ nh ị b ộ b n ố s ố lư ng ợ t ử electron cuối cùng c a ủ M và X. 3. Vi t ế công th c ứ oxide ng ứ v i ớ hóa trị cao nh t ấ và hydroxide tư ng ơ ng ứ c a ủ M và X, nêu tính acid-base c a ủ chúng. 4. Mô tả s ự hình thành liên k t ế trong phân t ử MX. 5. So sánh (có gi i
ả thích) bán kính ion M+ và X-. Ý Nội dung Đi m ể 1. Do t ng ổ số h t ạ T ng ổ số h t ạ proton, Oxide cao nh t ấ c a ủ X có công th c ứ là 0,75x2
neutron và electron trong nguyên tử nguyên X2O7 nên công th c ứ h p ợ ch t ấ hydride = 1,5 đ
tố M là 58, trong đó số h t ạ mang đi n ệ là HX nhi u ề h n ơ số h t ạ không mang đi n ệ là 18 Trong HX nguyên t ố X chi m ế 97,26% nên ta có h ệ phư ng ơ trình v ề khối lư ng ợ nên ta có phư ng ơ trình {2p+n=58 M → % m X .100 2 p {p=19 −n=18 n=20 X = MX +1
→ M X=35,5 g/mol Vây X là Cl Cấu hình electron c a
ủ M: 1s22s22p63s23p64s1 Cấu hình electron c a ủ X: 0,5 x 2 M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đề HSG Hóa 10 Sở Điện Biên năm 2023 có đáp án
1.9 K
0.9 K lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Tài liệu được cập nhật liên tục trong gói này từ nay đến hết tháng 3/2024. Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu Đề HSG Hóa 10 Sở Điện Biên năm 2023 có đáp án.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(1891 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 10
Xem thêmTài liệu bộ mới nhất

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có đáp án)ả ử ệ ể ế
S GIÁO D C VÀ ĐÀO T OỞ Ụ Ạ
ĐI N BIÊNỆ
(Đ thi có 03 trang)ề
KỲ THI CH N H C SINH GI I C P C SỌ Ọ Ỏ Ấ Ơ Ở
NĂM H C 2022-2023Ọ
Môn: Hóa h c – L p 10 ọ ớ
Ngày thi: 02/4/2023
Th i gian làm bài: 150 phút (không k th i gian giao đ )ờ ể ờ ề
Đ BÀIỀ
Cho s hi u nguyên t và nguyên t kh i các nguyên tố ệ ử ử ố ố
H B C N O F N
a
M
g
Al Si P S Cl K C
a
F
e
Z 1 5 6 7 8 9 11 12 13 14 15 16 17 19 20 26
NTK 1 11 12 14 16 19 23 24 27 28 31 32 35,
5
39 40 56
Câu 1 (4,5 đi m) ể
Nguyên t M có trong máu ng i n ng đ bình th ng là 3,5 – 5,0 mmol/l. Trong c
th , nguyên t M giúp đi u hòa cân b ng n c và đi n gi i, giúp duy trì ho t đ ng bình
th ng, đ c bi t là c a h tim m ch, c b p, tiêu hóa, ti t ni u. Trên c tim ion M
+
làm
gi m l c co bóp, gi m tính ch u kích thích và gi m d n truy n. T ng s h t proton, neutron
và electron trong nguyên t nguyên t M là 58, trong đó s h t mang đi n nhi u h n s h t
không mang đi n là 18.
Nguyên t X có trong thành ph n c a các ch t có tác d ng oxi hoá và sát khu n c c
m nh, th ng đ c s d ng v i m c đích kh trùng và t y tr ng trong lĩnh v c thu s n,
d t nhu m, x lí n c c p, n c th i, n c b b i. Oxide cao nh t c a X có công th c là
X
2
O
7
. Trong h p ch t hydride (h p ch t c a X v i H) nguyên t X chi m 97,26% v kh i
l ng.
1. Vi t c u hình electron nguyên t c a nguyên t M và X. Xác đ nh v trí c a M và X trong
b ng tu n hoàn các nguyên t hóa h c.
2. Bi u di n electron hóa tr c a M và X vào ô orbital, xác đ nh b b n s l ng t electron
cu i cùng c a M và X.
3. Vi t công th c oxide ng v i hóa tr cao nh t và hydroxide t ng ng c a M và X, nêu
tính acid-base c a chúng.
4. Mô t s hình thành liên k t trong phân t MX.
5. So sánh (có gi i thích) bán kính ion M
+
và X
-
.
Câu 2 (1,5 đi m)ể
Đ ng (Copper) là v t d ng d dát m ng, có kh năng d n đi n và d n nhi t t t. Vì !
th đ ng đ c s d ng r t nhi u trong đ i s ng . Các đ dùng t đ ng nh : " dây đi n, que
hàn đ ng, tay c m và các đ dùng n i
th t trong nhà, đúc t ng , các đ ng c
máy móc,… Nguyên t này có hai đ ng v
b n v i s kh i l n l t là 63 và 65.
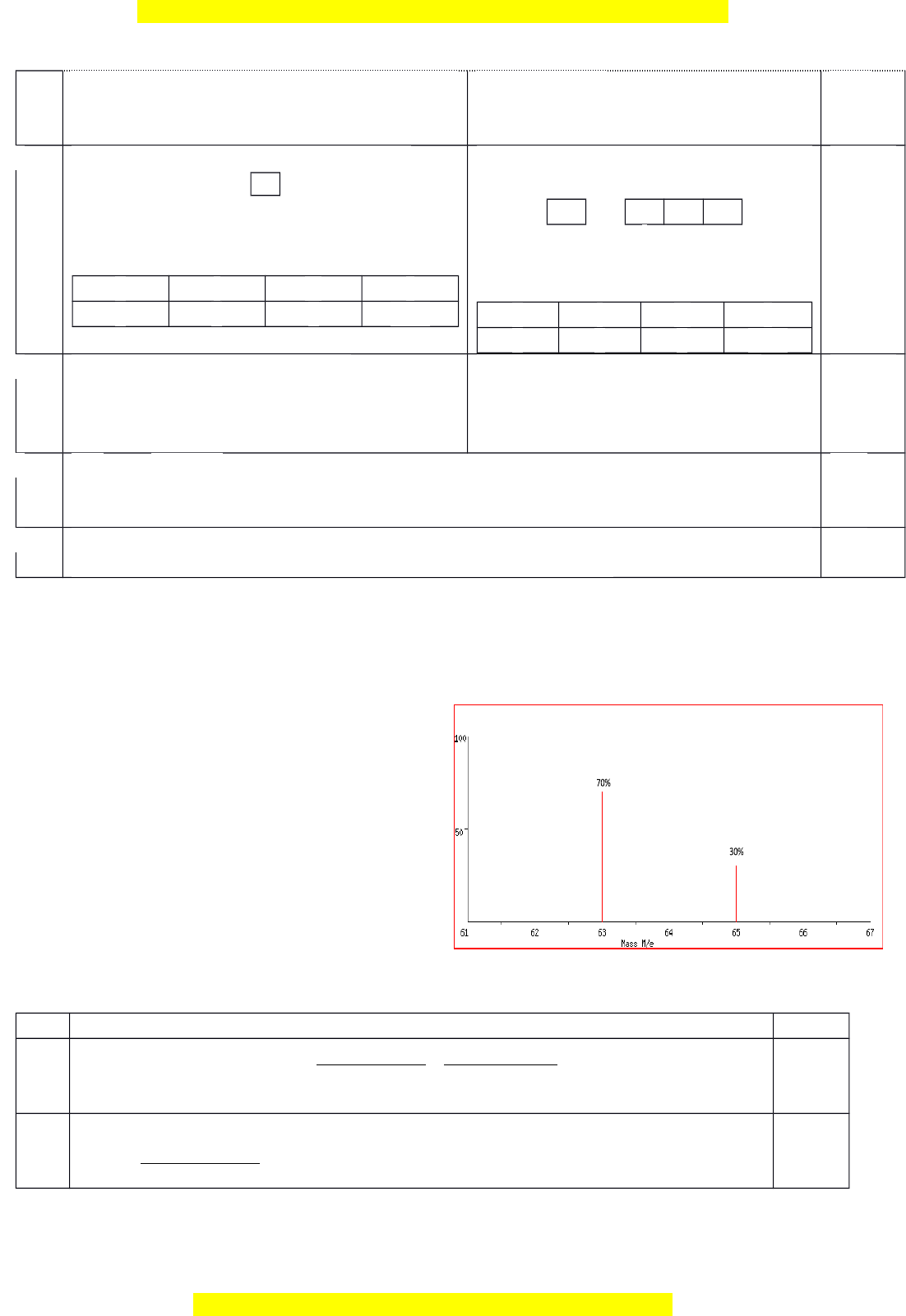
Bi u đ bên th hi n ph kh i l ng
c a m t m u Copper t nhiên.
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ
Đ CHÍNHỀ
TH CỨ

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có đáp án)ả ử ệ ể ế
1. Tính nguyên t kh i trung bình c a m u Copper.
2. Tính hàm l ng
C
29
65
u
trong qu ng chalcopyrit CuFeS
2
(đây là qu ng quan tr ng nh t
c a Copper trong t nhiên).
Câu 3 (3,5 đi m)ể
1. Hai nguyên t X, Y n m trong cùng 1 chu kì, thu c hai nhóm A liên ti p. T ng s h t
mang đi n trong hai nguyên t X và Y là 26.
a) Xác đ nh kí hi u hóa h c c a X, Y.
b) Xác đ nh tính ch t hóa h c c a X, Y (kim lo i, phi kim, khí hi m). So sánh tính ch t hóa
h c c a hai nguyên t này.
c) Vi t công th c Lewis, công th c c u t o c a hydroxide ng v i hóa tr cao nh t c a X,
Y. So sánh tính acid-base c a chúng.
2. Ethene (C2H4) là m t ch t sinh tr ng t nhiên, có kh năng thúc đ y quá trình chín c a #
nhi u lo i trái cây. Ammonia (NH3) đi u ki n th ng là ch t khí, có mùi hôi khó ch u. Khi#
hít ph i NH3 n ng đ cao có th t n th ng ph i, th m chí t vong.
a) Áp d ng lai hóa orbital, mô t s hình thành liên k t trong phân t
NH3 và
C2H4.
b) D đoán (có gi i thích) tính tan c a hai khí trên trong n c.
Câu 4 (4,0 đi m)ể
1. Copper (II) sulfate đ c dùng đ di t t o, rong rêu trong n c b b i, dùng đ pha ch
thu c Bordaux (tr b nh m c s ng trên cây cà chua, khoai tây, b nh th i thân trên cây ăn "
qu , cây công nghi p),… Trong công nghi p copper (II) sulfate th ng đ c s n xu t b ng
cách ngâm đ ng ph li u trong dung d ch sulfuric acid loãng và s c không khí:
Cu + H
2
SO
4
+ O
2
→ CuSO
4
+ H
2
O (1)
Copper (II) sulfate còn đ c đi u ch b ng cách cho đ ng ph li u tác d ng v i sulfuric
acid đ c nóng:
Cu + H
2
SO
4 đ c, nóng
→ CuSO
4
+ SO
2
+ H
2
O (2)
a) Cân b ng hai ph n ng trên b ng ph ng pháp thăng b ng electron.
b) Trong hai cách trên cách nào s d ng ít sulfuric acid h n, cách nào ít gây ô nhi m môi
tr ng h n?
2. S có m t c a khí SO
2
trong không khí là m t trong nh ng $ nguyên nhân gây ra hi n
t ng m a acid. N ng đ c a SO
2
có th xác đ nh b ng cách chu n đ v i dung d ch
potassium permanganate theo ph n ng sau:
SO
2
+ KMnO
4
+ H
2
O → K
2
SO
4
+ MnSO
4
+ H
2
SO
4
a) Cân b ng ph n ng oxi hoá - kh trên theo ph ng pháp thăng b ng electron.
b) Bi t m t m u không khí ph n ng v a đ v i 8,600 " mL dung d ch KMnO
4
0,008M. Tính
kh i l ng (miligam) c a SO
2
có trong m u không khí đó.
3. Đ t cháy hoàn toàn 7,8 gam h n h p A g m Mg và Al c n v a đ 5,6 lít h n h p khí X % " %
g m O
2
và Cl
2
(đktc), thu đ c 19,7 gam ch t r n. Tính thành ph n ph n trăm kh i l ng
t ng kim lo i trong A. "
Câu 5 (2,5 đi m)ể
1. Ph n ng phân h y m t lo i h p ch t kháng sinh có h s nhi t đ là 2,7. 27 &
0
C sau 10
gi thì l ng ho t ch t gi m đi m t n a.
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ
Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có đáp án)ả ử ệ ể ế
a) Khi đ a vào c th ng i (37
0
C) thì l ng ch t gi m đi m t n a sau bao lâu?
b) Sau bao lâu thì ho t ch t kháng sinh này trong c th ng i còn l i 12,5% so v i ban đ u.
2. Cho ph n ng: BrO
3
-
(aq)
+ 5Br
-
(aq)
+ 6H
+
(aq)
→ 3Br
2(aq)
+ 3H
2
O
(l)
T c đ c a ph n ng có th đo đ c d a vào s ph thu c n ng đ đ u c a các ch t
ph n ng. K t qu c a thí nghi m đ c cho b ng sau: #
Thí nghi m
N ng đ đ u c a các ch t (mol/L)
v
0
(mol/L.s)
BrO
3
-
Br
-
H
+
1 0,10 0,10 0,10 1,2.10
-3
2 0,20 0,10 0,10 2,4.10
-3
3 0,10 0,30 0,10 3,5.10
-3
4 0,20 0,10 0,15 5,4.10
-3
Vi t bi u th c t c đ ph n ng.
Câu 6 (2,0 đi m) ể
1. Nescafe đã s n xu t thành công lon cafe t làm nóng. Đ làm nóng cafe, ch c n n nút '
(trên lon) đ tr n nguyên li u g m 1 dung d ch KOH ho c NaOH r t loãng và CaO; 210 mL
cafe trong lon s đ c hâm nóng đ n kho ng 40(
0
C.
a) Vi t ph ng trình ph n ng x y ra gi a các nguyên li u dùng đ đun nóng cafe (khi n $
nút). Hãy tính hi u ng nhi t c a ph n ng này. Cho bi t:
Ca(OH)
2
CaO H
2
O
∆
f
H
298
0
(kJ/mo
l)
-1003 -635 -286
b) Gi s nhi t dung riêng c a cafe là 4,18 J/K.g (Nhi t dung riêng là nhi t l ng c n cung
c p đ 1 gam ch t tăng lên 1 đ ). Hãy tính l ng nhi t c n cung c p đ làm nóng 210mL
cafe t 0"
0
C đ n 40
0
C (d = 1,0 g/mL). Hãy tính l ng CaO c n đ th c hi n nhi m v này.
Gi s hi u ng nhi t c a ph n ng trên không đ i trong kho ng nhi t đ đang xét.
2. Khi cho 32,69 gam Zn tác d ng v i dung d ch H
2
SO
4
loãng d trong bom nhi t l ng
k ( V = const) 25#
0
C, ng i ta th y có thoát ra m t nhi t l ng là 71,48 kJ. Tính hi u ng
nhi t (kJ) c a ph n ng nhi t đ đó. Cho NTK Zn = 65,38 đvC. #
Câu 7 (2,0 đi m)ể
1. Khi chi u m t chùm b c x đi n t có b c sóng " λ = 58,40 nm lên m t m u Kripton (Kr)
thì th y chùm electron b t ra kh i Kripton và chuy n đ ng v i t c đ v = 1,59.10 !
6
m/s. Xác
đ nh năng l ng ion hóa th nh t c a Kripton (eV).
Cho h = 6,626.10
-34
Js; c = 3.10
8
m/s; m
e
= 9,1.10
-31
kg.
2. Th c nghi m cho bi t, NH
3
ph n ng v i BF
3
t o ra m t ch t r n X duy nh t, có màu
tr ng.
a) Vi t ph ng trình hóa h c c a ph n ng.
b) Vi t công th c Lewis c a m i phân t trong ph n ng trên. Cho bi t d ng hình h c c a %
m i phân t đó theo thuy t VSEPR.%
c) D đoán giá tr c a góc liên k t trong phân t ch t X.
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có đáp án)ả ử ệ ể ế
3. S d ng thuy t orbital phân t (thuy t MO) đ gi i thích t i sao năng l ng ion hóa
th nh t c a phân t nitrogen (1501 kJ/mol) l n h n năng l ng ion hóa th nh t c a
nguyên t nitrogen (1402 kJ/mol).
L u ýư : Thí sinh không đ c phép s d ng tài li u (bao g m c b ng tu n hoàn các nguyên tượ ử ụ ệ ồ ả ả ầ ố
hóa h c), cán b coi thi không gi i thích gì thêmọ ộ ả .
-------------H t------------ế
S GIÁO D C VÀ ĐÀO T OỞ Ụ Ạ
ĐI N BIÊNỆ
(HDC có 07 trang)
KỲ THI CH N H C SINH GI I C P C SỌ Ọ Ỏ Ấ Ơ Ở
NĂM H C 2022-2023Ọ
Môn: Hóa h c – L p 10 ọ ớ
Ngày thi: 02/4/2023
Câu 1 (4,5 đi m) ể
Nguyên t M có trong máu ng i n ng đ bình th ng là 3,5 – 5,0 mmol/l. Trong c
th , nguyên t M giúp đi u hòa cân b ng n c và đi n gi i, giúp duy trì ho t đ ng bình
th ng, đ c bi t là c a h tim m ch, c b p, tiêu hóa, ti t ni u. Trên c tim ion M
+
làm
gi m l c co bóp, gi m tính ch u kích thích và gi m d n truy n. T ng s h t proton, neutron
và electron trong nguyên t nguyên t M là 58, trong đó s h t mang đi n nhi u h n s h t
không mang đi n là 18.
Nguyên t X có trong thành ph n c a các ch t có tác d ng oxi hoá và sát khu n c c
m nh, th ng đ c s d ng v i m c đích kh trùng và t y tr ng trong lĩnh v c thu s n,
d t nhu m, x lí n c c p, n c th i, n c b b i. Oxide cao nh t c a X có công th c là
X
2
O
7
. Trong h p ch t hydride (h p ch t c a X v i H) nguyên t X chi m 97,26% v kh i
l ng.
1. Vi t c u hình electron nguyên t c a nguyên t M và X. Xác đ nh v trí c a M và X trong
b ng tu n hoàn các nguyên t hóa h c.
2. Bi u di n electron hóa tr c a M và X vào ô orbital, xác đ nh b b n s l ng t electron
cu i cùng c a M và X.
3. Vi t công th c oxide ng v i hóa tr cao nh t và hydroxide t ng ng c a M và X, nêu
tính acid-base c a chúng.
4. Mô t s hình thành liên k t trong phân t MX.
5. So sánh (có gi i thích) bán kính ion M
+
và X
-
.
Ý N i dungộ Đi m ể
1. Do t ng s h t T ng s h t proton,
neutron và electron trong nguyên t nguyên
t M là 58, trong đó s h t mang đi n
nhi u h n s h t không mang đi n là 18
nên ta có h ph ng trình
{
2 p+n=58
2 p−n=18
→
{
p=19
n=20
Oxide cao nh t c a X có công th c là
X
2
O
7
nên công th c h p ch t hydride
là HX
Trong HX nguyên t X chi m 97,26%
v kh i l ng nên ta có ph ng trình
%m
X
=
M
X
M
X
+1
.100
→ M
X
=35,5 g/mol
V y X là Cl
0,75x2
= 1,5 đ
C u hình electron c a M: 1s
2
2s
2
2p
6
3s
2
3p
6
4s
1
C u hình electron c a X: 0,5 x 2
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ
H NG D N CH MƯỚ Ẫ Ấ
Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có đáp án)ả ử ệ ể ế
V trí trong b ng tu n hoàn ô 19, chu kì 4
nhóm IA
1s
2
2s
2
2p
6
3s
2
3p
5
V trí trong b ng tu n hoàn ô 17, chu
kì 3 nhóm VIIA
= 1đ
3. Bi u di n electron hóa tr vào ô orbital
↑
4s
1
Electron cu i cùng có các s l ng t
n l m s
4 0 0 +1/2
Bi u di n electron hóa tr vào ô
orbital
↑↓
↑↓
↑↓
↑
3s
2
3p
5
Electron cu i cùng có các s l ng t
n l m s
3 1 1 +1/2
0,25x 2
= 0,5 đ
0,25x 2
= 0,5 đ
4. Công th c oxide cao nh t: K
2
O
Công th c hydroxide t ng ng: KOH
Chúng đ u có tính base.
Công th c oxide cao nh t: Cl
2
O
7
Công th c hydroxide t ng ng:
HClO
4
Chúng đ u có tính acid
0,25 x2
=0,5đ
5. K
→
K
+
+ 1e
Cl + 1e
→
Cl
-
Cl
-
+ K
+
→
KCl
0,25
6. C hai ion đ u có 18 electron nh ng đi n tích h t nhân c a K
+
l n h n đi n tích
h t nhân c a Cl
-
nên bán kính ion K
+
nh h n bán kính ion Cl!
-
0,25
Câu 2 (1,5 đi m)ể
Đ ng (Copper) là v t d ng d dát m ng, có kh năng d n đi n và d n nhi t t t. Vì !
th đ ng đ c s d ng r t nhi u trong đ i s ng . Các đ dùng t đ ng nh : dây đi n, que "
hàn đ ng, tay c m và các đ dùng n i th t
trong nhà, đúc t ng , các đ ng c máy móc, …
Nguyên t này có hai đ ng v b n v i s kh i
l n l t là 63 và 65. Bi u đ bên th hi n ph
kh i l ng c a m t m u Copper t nhiên.
1. Tính nguyên t kh i trung bình c a m u
Copper.
2. Tính hàm l ng
C
29
65
u
trong qu ng
chalcopyrit CuFeS
2
(đây là qu ng quan tr ng
nh t c a Copper trong t nhiên).
Ý N i dungộ Đi mể
1.
ADCT
´
A
X
=
a
1
. A
1
+a
2
. A
2
100
=
70. 63+30. 65
100
=63,6 g/mol
0,75
2.
Hàm l ng ượ
C
29
65
u
trong qu ng chalcopyrit CuFeS
2
là
%m=
0,3.65
63,6+56+32.2
.100=10,62 %
0,75
Câu 3 (3,5 đi m)ể
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ























