ĐỀ CƯƠNG THI GIỮA HỌC KÌ II – MÔN HOÁ HỌC 10
(Dùng chung cho cả 3 bộ sách) I. Nội dung
- Thời điểm kiểm tra: Kiểm tra giữa học kì 2 gồm toàn bộ phần phản ứng oxi hoá khử và năng lượng hoá học
- Thời gian làm bài: 45 phút.
- Hình thức kiểm tra: Kết hợp giữa trắc nghiệm và tự luận (tỉ lệ 70% trắc nghiệm, 30% tự luận). - Cấu trúc:
+ Mức độ đề:40% Nhận biết; 30% Thông hiểu; 20% Vận dụng; 10% Vận dụng cao.
+ Phần trắc nghiệm: 7,0 điểm (bao gồm trắc nghiệm nhiều lựa chọn, trắc nghiệm đúng sai
và trắc nghiệm trả lời ngắn).
+ Phần tự luận: 3,0 điểm (Vận dụng: 2,0 điểm; Vận dụng cao: 1,0 điểm).
II. Nội dung ôn tập 1. Phần trắc nghiệm
PHẢN ỨNG OXI HOÁ – KHỬ
* Trắc nghiệm nhiều phương án lựa chọn
Câu 1. Số oxi hóa là một số đại số đặc trưng cho đại lượng nào sau đây của nguyên tử trong
phân tử? (với giả định phân tử là hợp chất ion) A. Hóa trị. B. Điện tích. C. Khối lượng. D. Số hiệu.
Câu 2. Phản ứng oxi hóa – khử là phản ứng có sự nhường và nhận A. electron. B. neutron. C. proton. D. cation.
Câu 3. Dấu hiệu để nhận biết một phản ứng oxi hóa – khử là dựa trên sự thay đổi đại lượng
nào sau đây của nguyên tử? A. Số khối. B. Số oxi hóa. C. Số hiệu D. Số mol.
Câu 4. Trong phản ứng oxi hoá – khử, chất nhường electron được gọi là A. chất khử. B. chất oxi hoá. C. acid. D. base.
Câu 5. Trong hợp chất SO3, số oxi hóa của sulfur (lưu huỳnh) là A. +2. B. +3. C. + 5. D. +6.
Câu 6. Số oxi hóa của chromium (Cr) trong Na2CrO4 là A. -2 B. +2 C. +6 D. -6
Câu 7. Số oxi hóa của carbon và oxygen trong lần lượt là A. +3, -2. B. +4, -2. C. +1, -3. D. +3, -6.
Câu 8. Iron (sắt) có số oxi hoá +2 trong hợp chất nào sau đây? A. Fe(OH)3. B. FeCl3. C. FeSO4. D. Fe2O3.
Câu 9. Trong phản ứng hoá học: Fe + H2SO4 → FeSO4 + H2, mỗi nguyên tử Fe đã
A. nhường 2 electron. B. nhận 2 electron.
C. nhường 1 electron. D. nhận 1 electron.
Câu 10. Trong phản ứng hoá học: 2Na + 2H2O → 2NaOH + H2, chất oxi hoá là A. H2O. B. NaOH. C. Na. D. H2.
Câu 11. Cho nước Cl2 vào dung dịch NaBr xảy ra phản ứng hoá học: Cl2 + 2NaBr → 2NaCl + Br2
Trong phản ứng hoá học trên, xảy ra quá trình oxi hoá chất nào? A. NaCl. B. Br2. C. Cl2. D. NaBr.
Câu 12. Cho quá trình Al → Al3+ + 3e, đây là quá trình A. khử. B. oxi hóa.
C. tự oxi hóa – khử. D. nhận proton.
Câu 13. Cho phản ứng: SO2 + Br2 + H2O → HBr + H2SO4. Trong phản ứng trên, vai trò của Br2: A. là chất oxi hóa. B. là chất khử.
C. vừa là chất oxi hóa, vừa là chất tạo môi trường.
D. vừa là chất khử, vừa là chất tạo môi trường.
Câu 14. Phản ứng nào sau đây là phản ứng oxi hóa – khử? A. B. C. D.
Câu 15. Cho phương trình hóa học: aFe + bH ↑
2SO4 → cFe2(SO4)3 + dSO2 + eH2O Tỉ lệ a: b là A. 1: 3. B. 1: 2. C. 2: 3. D. 2: 9
Câu 16. Cho phương trình hóa học: aAl + bH2SO4 → cAl2(SO4)3 + dSO2 + eH2O Tỉ lệ a: b là A. 1: 1. B. 2: 3. C. 1: 3. D. 1: 2.
Câu 17. Cho phương trình phản ứng aAl + bHNO3 cAl(NO3)3 + dNO + eH2O. Tỉ lệ a: b là A. 1: 3. B. 2: 3. C. 2: 5. D. 1: 4.
Câu 18. Cho phản ứng: FeO + HNO3 → Fe(NO3)3 + NO + H2O. Trong phương trình của
phản ứng trên, khi hệ số của FeO là 3 thì hệ số của HNO3 là A. 6. B. 8. C. 4. D. 10.
Câu 19. Cho phương trình phản ứng sau: Nếu hệ số
của HNO3 là 8 thì tổng hệ số của Zn và NO là A. 4. B. 3. C. 6. D. 5.
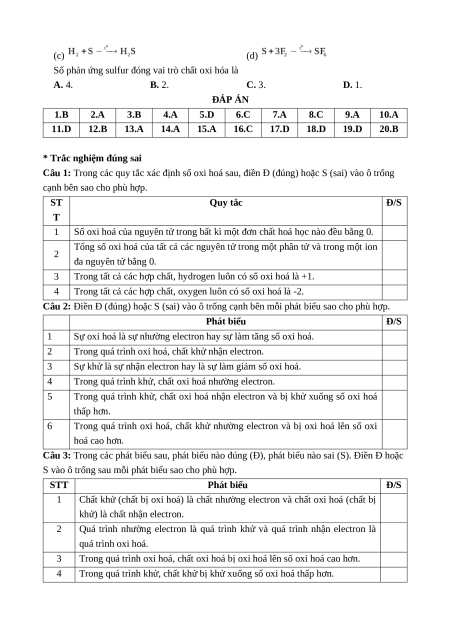
Câu 20. Thực hiện các phản ứng hóa học sau: (a) (b) (c) (d)
Số phản ứng sulfur đóng vai trò chất oxi hóa là A. 4. B. 2. C. 3. D. 1. ĐÁP ÁN 1.B 2.A 3.B 4.A 5.D 6.C 7.A 8.C 9.A 10.A 11.D 12.B 13.A 14.A 15.A 16.C 17.D 18.D 19.D 20.B
* Trắc nghiệm đúng sai
Câu 1: Trong các quy tắc xác định số oxi hoá sau, điền Đ (đúng) hoặc S (sai) vào ô trống
cạnh bên sao cho phù hợp. ST Quy tắc Đ/S T 1
Số oxi hoá của nguyên tử trong bất kì một đơn chất hoá học nào đều bằng 0.
Tổng số oxi hoá của tất cả các nguyên tử trong một phân tử và trong một ion 2 đa nguyên tử bằng 0. 3
Trong tất cả các hợp chất, hydrogen luôn có số oxi hoá là +1. 4
Trong tất cả các hợp chất, oxygen luôn có số oxi hoá là -2.
Câu 2: Điền Đ (đúng) hoặc S (sai) vào ô trống cạnh bên mỗi phát biểu sao cho phù hợp. Phát biểu Đ/S 1
Sự oxi hoá là sự nhường electron hay sự làm tăng số oxi hoá. 2
Trong quá trình oxi hoá, chất khử nhận electron. 3
Sự khử là sự nhận electron hay là sự làm giảm số oxi hoá. 4
Trong quá trình khử, chất oxi hoá nhường electron. 5
Trong quá trình khử, chất oxi hoá nhận electron và bị khử xuống số oxi hoá thấp hơn. 6
Trong quá trình oxi hoá, chất khử nhường electron và bị oxi hoá lên số oxi hoá cao hơn.
Câu 3: Trong các phát biểu sau, phát biểu nào đúng (Đ), phát biểu nào sai (S). Điền Đ hoặc
S vào ô trống sau mỗi phát biểu sao cho phù hợp. STT Phát biểu Đ/S 1
Chất khử (chất bị oxi hoá) là chất nhường electron và chất oxi hoá (chất bị
khử) là chất nhận electron. 2
Quá trình nhường electron là quá trình khử và quá trình nhận electron là quá trình oxi hoá. 3
Trong quá trình oxi hoá, chất oxi hoá bị oxi hoá lên số oxi hoá cao hơn. 4
Trong quá trình khử, chất khử bị khử xuống số oxi hoá thấp hơn. 5
Phản ứng trong đó có sự trao đổi electron là phản ứng oxi hoá - khử. 6
Trong phản ứng oxi hoá - khử, sự oxi hoá và sự khử luôn xảy ra đồng thời.
Câu 4: Cho sơ đồ phản ứng hoá học sau: NH3 + CuO Cu + N2 + H2O
Chỉ ra các phát biểu đúng/ sai trong các phát biểu sau?
a. Phản ứng trên là phản ứng oxi hoá – khử. b. NH3 là chất khử. c. N2 là chất oxi hoá.
d. Tổng hệ số (là các số nguyên tối giản) của các chất phản ứng là 9.
Câu 5: Cho các phản ứng hoá học sau:
(1) AgNO3 + NaCl → AgCl + NaNO3;
(2) Cl2 + 2NaOH → NaCl + NaClO + H2O.
Chỉ ra các phát biểu đúng/ sai trong các phát biểu sau?
a. Phản ứng (1) là phản ứng oxi hoá – khử.
b. Cả (1) và (2) đều là phản ứng oxi hoá – khử.
c. Trong phản ứng (1) NaCl là chất oxi hoá.
d. Trong phản ứng (2) Cl2 vừa là chất oxi hoá, vừa là chất khử.
Câu 6: Cho phản ứng hoá học sau:
Fe(OH)2 + HNO3 → Fe(NO3)3 + NO + H2O
Trong các phát biểu dưới đây, phát biểu nào đúng, phát biểu nào sai?
a. Phản ứng trên là phản ứng oxi hoá – khử.
b. Fe(OH)2 đóng vai trò là chất oxi hoá trong phản ứng.
c. Nếu hệ số của Fe(OH)2 là 3 thì hệ số của HNO3 là 10.
d. Khí NO sinh ra được gọi là sản phẩm khử của phản ứng.
Câu 7: Cho phản ứng hoá học sau: Fe + CuSO4 → FeSO4 + Cu
Trong các phát biểu dưới đây, phát biểu nào đúng, phát biểu nào sai?
a. Phản ứng trên là phản ứng oxi hoá khử.
b. Fe là chất bị khử trong phản ứng.
c. Quá trình oxi hoá trong phản ứng là quá trình Fe nhận 2 electron.
d. Nếu có 0,1 mol Fe phản ứng sẽ thu được 6,4 gam Cu.
Câu 8: Cho phản ứng hoá học sau:
HCl + PbO2 → PbCl2 + Cl2 + H2O
Trong các phát biểu dưới đây, phát biểu nào đúng, phát biểu nào sai?
a. HCl là chất bị khử trong phản ứng.
b. Nếu hệ số của HCl là 4 thì hệ số của PbO2 là 1.
c. Số mol Cl2 sinh ra bằng số mol HCl phản ứng.
Đề cương giữa kì 2 Hóa học 10 (cả 3 sách) 2024
501
251 lượt tải
50.000 ₫
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
- Bộ giáo án Đề cương giữa kì 2 Hóa học 10 (dùng chung cho cả 3 sách) năm 2024 mới, chuẩn nhất được thiết kế theo phong cách hiện đại, đẹp mắt, trình bày chi tiết cho từng bài học và bám sát chương trình Sách giáo khoa Hóa 10.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(501 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)