SỞ GIÁO D C Ụ VÀ ĐÀO T O Ạ KỲ THI CH N Ọ H C Ọ SINH GI I Ỏ T N Ỉ H L P Ớ 10 THPT HÀ TĨNH NĂM HỌC 2022-2023 Môn thi: HÓA HỌC 10 Đ Ề THI CHÍNH TH C Ứ Th i
ờ gian làm bài: 150 phút (không k ể th i ờ gian giao đ ) ề
(Đề thi có 02 trang, g m ồ 9 câu) - Cho bi t ế nguyên t ử kh i ố các nguyên t :
ố H=1; C=12; N=14; O=16; S=32; K=39; Cr=52; Ag=108; Pb=207. - S ố hi u ệ nguyên t c ử a ủ m t ộ s nguy ố ên t :
ố 1H, 2He, 3Li, 6C, 7N, 15P, 16S, 17Cl, 19K, 24Cr, 29Cu; NA = 6,022.1023. Câu 1. (4,0 điêm) 1. Nguyên tử c a ủ nguyên tố R t ở rạng thái c b ơ ản có t ng ổ s e ố lectron c ở ác phân l p s ớ là 7.
a. Viết cấu hình electron nguyên t c ử ủa R t
ở rạng thái cơ bản, g i o tên nguyên t R. ố
b. Viết cấu hình electron c a ủ R2+, R3+ ng ư v i ớ R có s e ố lectron đ c ô thân l n ớ nh t ấ t ở r ng t ạ hái c b ơ n. ả 2. T ng ổ s h ố ạt mang đi n ệ và không mang đi n c ệ a ủ n nguyên tử Y b ng 18. ằ Vi t ế kí hi u nguyê ệ n t c ử a ủ Y. 3. Nguyên t X ố rất cân cho s s ư ng t ố rên trái đ t ấ , X thu c ô nhóm VA, chu kì 2. a. Xác đ nh i X và b 4 s ô l ố ư ng ơ t c ử a ủ eletron cu i ố cung trong X. b. Xác đ nh
i trạng thái lai hóa nguyên t t ử rung tâm và d ng hì ạ nh h c o c a ủ XO - + 2, XO2 , XO2 .
c. So sánh góc liên k t ế OXO trong XO - +
2, XO2 , XO2 và giải thích. Câu 2. (2,0 điêm)
1. Tiến hành đo phổ kh i ố c a ủ m t ô h n ỗ h p ơ g m ồ các h p ơ chất tạo t
ư iodine và chlorine, thu đư c ơ m t ô số giá tr
i m/z, trong đó có 164, 466, 476. Cho rằng các ti u ê phân ng ư v i
ớ các giá tri m/z trên là s n ả ph m ẩ ion hoá đâu tiên c a ủ m i ỗ phân t , ử I ch c ỉ ó 1 đ ng v ồ i 127I và Cl có hai đ ng ồ v l i à 35Cl và 37Cl. a. Xác đ nh i công th c ư phân tử (ghi rõ s kh ố i ố c a
ủ nguyên tử chlorine) ng v ư i
ớ m/z = 164, 466 và 476. b. V c
ẽ ấu trúc của phân tử tạo thành tiêu phân có m/z = 476. 2. Khi n ,
ổ phân tử ammonium dinitroamide, NH4N(NO2)2 có thê bi phân h y ủ thành khí nitrogen, h i ơ nư c ớ và khí oxygen. Vi t ế phư ng t ơ rình hóa h c o và tính hi u ệ ng nhi ư t ệ c a ủ ph n ả ng ư đó. Cho biết: Liên k t ế N–H N–N N=N N–O N=O N N H–O O=O E (kJ.mol–1) 391 160 418 201 607 941 467 495 Câu 3. (2,0 điêm) 131 130 Đ n ồ g vi I Te 53 dung trong y h c o thư n ờ g đư c ơ đi u ề chế b n ằ g cách b n ắ phá bia ch a ư 52 b n ằ g 130 neutron trong lò ph n ả n ư g h t ạ nhân. Trong phư n ơ g pháp này, trư c ớ tiên Te 52 nh n ậ 1 neutron chuy n ê hóa 131 131 thành Te I 52 , r i ồ đ ng v ồ nà i
y phân rã - tạo thành 53 . 131 1. Viết phư ng ơ trình các phản ng h ư
ạt nhân xảy ra khi đi u c ề h ế I 53 . 131
2. Trong thời gian 3 gi , 1 m ờ L dung dich I
53 ban đâu phát ra 1,08.1014 hạt -. 131 a. Tính n ng đ ồ ba ô n đ u c â a ủ I 53 trong dung d c i h theo đ n ơ v imol/L. 131
b. Sau bao nhiêu ngày, hoạt đô phóng xạ riêng c a ủ dung d c i h I 53 chỉ còn 103 Bq/mL? 131 Biết chu kì bán rã c a ủ I 53 là 8,02 ngày. Câu 4. (2,0 điêm) 1. D a
ư vào cấu tạo nguyên t ,
ử phân tử hãy giải thích: a. Năng lư ng i ơ on hóa th nh ư ất c a ủ phosphorus l n ớ h n nă ơ ng lư ng i ơ on th nh ư ất c a ủ sulfur.
b. Các phân tử H2O có thê hình thành các c m ụ phân tử d ng (H ạ 2O)n.
c. NO2 có khả năng dimer hóa tạo thành N2O4. d. SO2 tan trong nư c ớ nhi u ề h n ơ CO2.
2. Ba nguyên tố X, Y, Z ở trong cung m t ô chu kỳ thu c ô b ng ả h ệ th ng ố tu n â hoàn có t ng ổ s ố hi u ệ nguyên tử là 48. S ố hi u ệ nguyên t ử c a ủ Y b ng ằ trung bình c ng ô s ố hi u ệ nguyên t ử c a
ủ X và Z. Các hydroxide cao nhất đư c ơ tạo ra t X ư , Y, Z tư ng ơ ng l ư à A, B, C. a. Xác đ nh i X, Y, Z. Trang 1/2
b. So sánh tính acid của A, B, C. Câu 5. (2,0 điêm)
1. Cân bằng các phư ng t ơ rình phản ng s ư au theo phư ng ơ pháp thăng b ng e ằ lectron:
a. H2O2 + KMnO4 + H2SO4 → MnSO4 + O2 + K2SO4 + H2O.
b. Cr2S3 + Mn(NO3)2 + K2CO3 → K2CrO4 + K2SO4 + K2MnO4 + NO + CO2 2. M t ô mẫu h i ơ thở c a ủ ngư i ờ bi nghi v n ấ có sử d ng ụ c n
ồ khi tham gia giao thông có thê tích 52,5 ml đươc th i ổ vào thi t ế bi Breathalyzer ch a ư 3,0 ml dung d c i h K2Cr2O7 n ng ồ đ
ô 0,042 mg/ml trong môi trư ng ờ acid H + 2SO4 30% và n ng ồ đô ion Ag n ổ đ nh
i 0,25 mg/ml (chất xúc tác). Bi t ế r ng ằ ph n ả ng ư x y ả ra hoàn toàn, C 2- 2H5OH b
i oxi hóa thành CH3COOH và toàn bô dung d c i h màu da cam c a ủ Cr2O7 chuyên hoàn toàn thành màu xanh lá cây c a ủ Cr3+. Viết phư ng ơ trình hóa h c o và tính s ố mg ethanol/1 lít khí th ở c a ủ ngư i ờ trên. Câu 6. (2,0 điêm) Công đoạn đ u â tiên c a ủ quá trình s n ả xu t ấ silicon có đ ô tinh khi t ế cao ph c ụ v ụ cho công ngh ệ bán dẫn đư c ơ th c ư hiện bằng phản ng: ư
SiO2(s) + 2C(s) ⇌ Si(s) + 2CO(g) (1).
1. Không cân tính toán, ch ỉ d a ư vào s hi ư u ê bi t ế v ề hàm entropy, hãy d ư đoán s ư thay đ i ổ (tăng hay gi m ả ) entropy c a ủ h khi ệ x y ra ả phản ng ư (1). 0 2. Tính H r 298 , 0 S G r 298 , 0 r
298 của quá trình điều chế silicon theo phản ng ư (1). 3. Phản ng ư (1) sẽ di n ễ ra u ư thế theo chi u ề thu n ậ b t ắ đ u â tư nhi t ệ đô nào? (Coi s ư ph ụ thu c ô c a ủ ΔS và ΔH vào nhiệt đ l ô à không đáng k ). ê Bi t ế ở đi u ề ki n ệ chu n ẩ , t i
ạ 298 K, entropy và enthanpy c a ủ các chất: Chât SiO2(s) C(s) Si(s) CO(g) 0 S298 (J/mol.K) 41,8 5,7 18,8 197,6 0 H f 298 (KJ/mol) - 910,9 0,0 0,0 - 110,5 Câu 7. (2,0 điêm) Các nhiên li u ệ hóa th c ạ h có nhi u ề m c
ư sulfur khác nhau (0,05- 6,0% v i ớ d u â thô, 0,5 -3% v i ớ than và khoảng 10 ppm v i
ớ khí thiên nhiên, về kh i ố lư ng). ơ Du đã tr i ả qua quá trình lo i ạ bỏ sulfur kh i ỏ các nhiên li u ệ hóa th c ạ h nh ng ư c n ặ sulfur còn l i ạ (t i
ố đa là 10 ppm sulfur trong xăng và d u â diesel theo tiêu chuẩn Châu Âu V) v n ẫ gây ra nhi u ề v n ấ đề vì s n ả ph m ẩ cháy c a
ủ nó là SO2, là chất làm ô nhi m ễ không khí chính. Ngư i ờ ta đã ư c ớ tính t ng ổ m c ư tiêu thụ năng lư ng ơ toàn c u
â hàng năm 4,8.1022 J, trong đó 30,6% đ n t
ế ư các sản phẩm dâu. Hãy tính lư ng ơ SO2 (theo tấn) sinh ra t ư các s n ả ph m ẩ d u. â Gi ả s r ử ng ằ thành phân chính các s n ả ph m ẩ d u
â là octane (C8H18) và hàm lư ng ơ sulfur là 10 ppm. Đ ng ồ th i ờ giả sử rằng 90% năng lư ng ơ tư s đ
ư ốt cháy hoàn toàn octane đã đư c ơ s d ử ng. ụ Biết 1ppm = 10-6, m t ô s gi ố á tr nă i ng lư ng l ơ
iên kết (E, tính theo kJ.mol-1) dưới đây: Liên k t ế H-H C-H C-C C=O O=O H-O E 436 414 347 (799 trong CO2) 498 464 Câu 8. (2,0 điêm) H p ơ ch t ấ A có thành ph n â ch ỉg m
ồ nitrogen và hydrogen. Ch t ấ A đư c ơ sử d n ụ g làm nhiên li u ệ cho tên l a ử . 1. Xác đ nh i công th c ư phân tử c a ủ A. Bi t ế phân t kh ử i ố c a ủ A là 32. 2. Ngư i ờ ta th c ư hi n ệ thí nghi m ệ sau: cho 25,00 mL dung d c i h A n ng ồ đ ô 0,025M vào dung d c i h Fe2(SO4)3 d , ư đun nóng, thu đư c ơ dung d c i h B và m t ô ch t ấ khí X. Đ ê ph n ả ng ư h t ế 1/2 dung d c i h B c n â v a ư đủ 12,40 mL dung d c i h KMnO4 trong môi trư ng ờ acid H2SO4 loãng. Đ ê ph n ả ng ư h t ế 10,00 mL dung d c i h
H2C2O4 0,05M (trong môi trư ng ờ acid H2SO4) cân v a ư đ ủ 9,95 mL dung d c i h KMnO4 ở trên. Xác đ nh i ch t ấ X. Câu 9. (2,0 điêm) M t ô số h p ơ ch t ấ ion c a
ủ các ion hóa tr iII cũng k t ế tinh cung ki u ê c u ấ trúc tinh th ê nh ư NaCl, ví dụ như galena PbS. H ng s ằ m
ố ạng của nó là a = 5,94 Å. 1. V c
ẽ ấu trúc ô mạng cơ s c ở ủa galena và tính kh i ố lư ng ơ riêng của galena. 2. M t ô mẫu galena ch a ư silver, trong đó m t ô ph n â ion Pb2+ bi thay thế b i ở ion Ag+ và sư gi m ả đi n ệ tích đươc bu trư b i ở các l ỗ tr ng ố c a ủ ion S2-, có kh i ố lư ng
ơ riêng là 7,21 g/cm3, hằng s ố m ng ạ c a ủ m u ẫ này là Trang 2/2 a = 5,88 Å và thành ph n â c a
ủ tinh thê khi đó có thê đư c ơ bi u ê di n ễ b i ở công th c ư t ng ổ quát Pb(1-x)AgxSy. Xác đ nh i công th c ư đ n gi ơ ản nhất c a ủ mẫu galena ch a ư silver.
------------------------H T
Ế --------------------
- Thí sinh không đư c ợ s ử d n ụ g tài li u ệ (k ể b n ả g h ệ th n ố g tu n
ầ hoàn các nguyên t ố hóa h c ọ ).
- Cán bộ coi thi không giải thích gì thêm. H t
o ên thí sinh: ………………………………………………….; S bá ố o danh: …………………. SỞ GIÁO D C Ụ VÀ ĐÀO T O Ạ KỲ THI CH N Ọ H C Ọ SINH GI I Ỏ T N Ỉ H L P Ớ 10 THPT HÀ TĨNH NĂM HỌC 2022-2023 Đ Ề THI CHÍNH TH C Ứ Môn thi: HÓA H C Ọ HƯ N Ớ G D N Ẫ CH M Ấ Câu 1. (4,0 điêm) 1. Nguyên tử c a ủ nguyên tố R t ở rạng thái c b ơ ản có t ng ổ s e ố lectron c ở ác phân l p s ớ là 7.
a. Viết cấu hình electron nguyên t c ử ủa R t
ở rạng thái cơ bản, g i o tên nguyên t R. ố
b. Viết cấu hình electron c a ủ R2+, R3+ ng ư v i ớ R có s e ố lectron đ c ô thân l n ớ nh t ấ t ở r ng t ạ hái c b ơ n. ả 2. T ng ổ s h ố ạt mang đi n ệ và không mang đi n c ệ a ủ n nguyên tử Y b ng 18. ằ Vi t ế kí hi u nguyê ệ n t c ử a ủ Y. 3. Nguyên t X ố rất cân cho s s ư ng t ố rên trái đ t ấ , X thu c ô nhóm VA, chu kì 2. a. Xác đ nh i X và b 4 s ô l ố ư ng ơ t c ử a ủ eletron cu i ố cung trong X. b. Xác đ nh
i trạng thái lai hóa nguyên t t ử rung tâm và d ng hì ạ nh h c o c a ủ XO - + 2, XO2 , XO2 .
c. So sánh góc liên k t ế OXO trong XO - +
2, XO2 , XO2 và giải thích. Ý N i ộ dung Đi m ể a) Trong v ỏ nguyên t ử c a ủ nguyên t ố R electron phân b ố vào các phân l p ớ s theo thư t l
ư à: 1s2; 2s2; 3s2; 4s1 => Các cấu hình electron th a ỏ mãn là
1s22s22p63s23p64s1 => Z = 19 R là Potassium 1
1s22s22p63s23p63d54s1 => Z = 24 R là Chromium 3x0,25
1s22s22p63s23p63d104s1 => Z = 29 R là Copper b) R có s e ố đ c ô thân l n nh ớ ất là Chromium
=> Cấu hình Cr2+ là 1s22s22p63s23p63d4; Cr3+ là 1s22s22p63s23p63d3 2x0,25
n(2P + N) = 18 2P + N = 18/n 4x0,25
Vì P, N nguyên 18 chia h t
ế cho n n = 1; 2; 3; 6; 9
n = 1 2P + N = 18 p = 6 n = 6 A = 12 66C 2
n = 2 2P + N = 9 p = 3 n = 3 A = 6 63Li
n = 3 2P + N = 6 p = 2 n = 2 A = 4 42He
n = 6 2P + N = 3 p = 1 n = 1 A = 2 21H
n = 9 2P + N = 2 p = 1 n = 0 A = 1 11H 3 a. X có 5e hóa tr và i có 2 l p e ớ lectron → X là N 0,25 Z = 7: 1s22s22p3. 4 s l ố ư ng ơ t n = ử
2, l = 1, ml = + 1, ms = + 1/2 0,25 b. 3x0,25 N O O NO2: N lai hóa sp2 , Hình ch ư V (góc) N O N O O O NO -2 : N lai hóa sp2, Hình ch ư V (góc) ch÷ V th¼ng Trang 3/2 N O N O O N O O + 2 : N lai hóa sp, dạng đư ng ờ thăng + - ch÷ V c. Góc ONOth t¼ng rong NO2 > NO2 > NO2 . 0,25 (1800) (1320) (1150) - Do NO + 2 nguyên t N
ử lai hóa sp nên góc l n nh ớ ất - NO - 2 2 và NO2 nguyên t N ử đ u l ề ai hóa sp , nh ng
ư NO2 trên N còn 1 electron ch a ư liên 0,25
kết đẩy cặp electron liên k t ế y u h ế n c ơ a
ủ N trong NO -2 còn 1 cặp electron chưa liên kết. Câu 2. (2,0 điêm)
1. Tiến hành đo phổ kh i ố c a ủ m t ô h n ỗ h p ơ g m ồ các h p ơ chất tạo t
ư iodine và chlorine, thu đư c ơ m t ô số giá tr
i m/z, trong đó có 164, 466, 476. Cho rằng các ti u ê phân ng ư v i
ớ các giá tri m/z trên là s n ả ph m ẩ ion hoá đâu tiên c a ủ m i ỗ phân t , ử I ch c ỉ ó 1 đ ng v ồ i 127I và Cl có hai đ ng ồ v l i à 35Cl và 37Cl. a. Xác đ nh i công th c ư phân tử (ghi rõ s kh ố i ố c a
ủ nguyên tử chlorine) ng v ư i
ớ m/z = 164, 466 và 476. b. V c
ẽ ấu trúc của phân tử tạo thành tiêu phân có m/z = 476. 2. Khi n ,
ổ phân tử ammonium dinitroamide, NH4N(NO2)2 có thê bi phân h y ủ thành khí nitrogen, h i ơ nư c ớ và khí oxygen. Vi t ế phư ng t ơ rình hóa h c o và tính hi u ệ ng nhi ư t ệ c a ủ ph n ả ng ư đó. Cho biết: Liên k t ế N–H N–N N=N N–O N=O N N H–O O=O E (kJ.mol–1) 391 160 418 201 607 941 467 495 Y Nội dung Điểm a. m/z 164 466 476 3x0,25 1 Phân tử I 37Cl I 35 37 37 2 Cl5 Cl I2 Cl6 b. 37 37 0,25 Cl Cl 37Cl I I 37Cl 37Cl 37Cl Theo đâu bài, phư ng ơ trình hóa h c o của phản ng phâ ư n h y nh ủ ư sau: NH4N(NO2)2 → 2N2 + 2H2O + O2 0,25 2 N H N O N N O O N N O H N H O O H O O D C 0 H r
298 = 4.EN–H + 1.EN–N + 1.EN=N +3.EN–O + 1.EN=O - 2ENN -4.EH–O – 1.EO=O = 0,75 - 893 (kJ·mol–1). Câu 3. (2,0 điêm) 131 130 Đ n ồ g vi I Te 53 dung trong y h c o thư n ờ g đư c ơ đi u ề chế b n ằ g cách b n ắ phá bia ch a ư 52 b n ằ g 130 neutron trong lò ph n ả n ư g h t ạ nhân. Trong phư n ơ g pháp này, trư c ớ tiên Te 52 nh n ậ 1 neutron chuy n ê hóa 131 131 thành Te I 52 , r i ồ đ ng v ồ nà i
y phân rã - tạo thành 53 . 131 1. Viết phư ng ơ trình các phản ng h ư
ạt nhân xảy ra khi đi u c ề h ế I 53 . 131
2. Trong thời gian 3 gi , 1 m ờ L dung dich I
53 ban đâu phát ra 1,08.1014 hạt -. 131 a. Tính n ng đ ồ ba ô n đ u c â a ủ I 53 trong dung d c i h theo đ n ơ v imol/L. Trang 4/2
Đề HSG Hóa 10 Sở Hà Tĩnh năm 2023 có đáp án
6 K
3 K lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Tài liệu được cập nhật liên tục trong gói này từ nay đến hết tháng 3/2024. Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu Đề HSG Hóa 10 Sở Hà Tĩnh năm 2023 có đáp án.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(6016 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 10
Xem thêmTài liệu bộ mới nhất

S GIÁO D C VÀ ĐÀO T OỞ Ụ Ạ
HÀ TĨNH
(Đ thi có 02 trang, g m 9 câu)ề ồ
KỲ THI CH N H C SINH GI I T NH L P 10 THPTỌ Ọ Ỏ Ỉ Ớ
NĂM H C 2022-2023Ọ
HÓA H C 10Ọ
150(không k th i gian giao đ )ể ờ ề
- Cho bi t nguyên t kh i các nguyên t :ế ử ố ố H=1; C=12; N=14; O=16; S=32; K=39; Cr=52; Ag=108; Pb=207.
- S hi uố ệ nguyên t c a m t s nguyên t : ử ủ ộ ố ố
1
H,
2
He,
3
Li,
6
C,
7
N,
15
P,
16
S,
17
Cl,
19
K,
24
Cr,
29
Cu; N
A
= 6,022.10
23
.
Câu 1.
1. ! ""# $ !%&
a.' (""# &
b. ' (""#
)*
+*
, ! ""# $ &
2. ! ,- . /0&' -1 .&
3. 2 #! ! 2 '3-()&
a.2 2, ! ""# 4#2&
b.2 $,5 ( 26
)
26
)
7
26
)
*
&
c.8#! - 626#26
)
26
)
7
26
)
*
, 1&
Câu 2. )
1. # - # #5",#" !
9:# /;;;%;&<# $ , m/z! #
# $ = / ,
/)%
=,< ,
+>
<,
+%
<&
a. 2 $ ?! - #" , m/z@/;;;,%;&
b. ' $ # $ m/z@%;&
2.A $ #5#5"B
6
)
)
$ -1#"
,-1#C"&' ( ,1 & <#
D- EB E @ E6 @6
BE6 6@6
F-G&#
E/
+H/ /; /0 )/ ;% H/ ;% H>
Câu 3. )
I ,
/+/
>+
=
54#
/+
>)
"
"##J $&#
/+
>)
"
/ "#
/+/
>)
"
, $K
7
#
/+/
>+
=
&
1.' ( $C -
/+/
>+
=
&
2.# + /D55
/+/
>+
=
/0&/
/
7
&
a.1
/+/
>+
=
#55 "# , #9D&
b.8## C 55
/+/
>+
=
J/
+
LM9DN
L -(K
/+/
>+
=
0)&
Câu 4. )
1. O ,# # $ K 1
a.P # #!#! P # !Q&
b.<$ B
)
6 ( $ 5 B !
)
6
&
c.6
)
- P5" #
)
6
&
d.86
)
# <6
)
&
2. L 2.R #4 -S # !
0&8 . ( ! 2,R&<5#C5"#
# 2.R 3L<&
a.2 2.R&
/9)
Đ THI CHÍNH TH CỀ Ứ

b.8#!15 3L<&
Câu 5. )
1. <$ ( !"# P ""#
a. B
)
6
)
*A6
*B
)
86
T86
*6
)
*A
)
86
*B
)
6&
b.<
)
8
+
*6
+
)
*A
)
<6
+
TA
)
<6
*A
)
86
*A
)
6
*6*<6
)
2. , ! 5 -# 1>)> " !
,# L":" +55 A
)
<
)
6
%
)9#
5B
)
86
+U, #3
*
)>9 C &L C #
#<
)
B
>
6B #C <B
+
<66B,# 55 5 <
)
6
%
)7
##
C$ <
+*
&' ( , 1! "#9/1-1
&
Câu 6. )
<# M(! C !# - # , # ! !
5 86"
)
!*)<!⇌8!*)<6/&
1. A 1# 5 ,#! , "#K5 #! P
"# -C /&
2. 1
)H0
B
0
r 298
S
0
r 298
G
M( !#"# /&
3.V /! 5 "# #N<#! # !
W8
,
WB
,# -- &
L - )H0A"#,"
Ch tâ 86
)
! <! 8! <6
)H0
8
G9#&A
/0 >% /00 /H%;
Q )H0
B
AG9#
7H/H 7//>
Câu 7. )
< !Q->7;U, 5 >7+U,
,-# /, -1, - &O4K MM(# !Q- $ $
!QJ /!Q#CP,5 5"!""# %
<$X', $ , ,(! 86 "
)
- #
-11& K 1 P # P0&/ !
))
G#
+;U ! 5 &BK1 86
)
"# ! ! 5 &Y !
1! 5 #"<
0
B
/0
, !Q/&I !
HUP ! ###"K ! 5 & !
L /@/
7;
! P - F1"#-G&#
7/
5 $
D- B7B <7B <7< <@6 6@6 B76
F +; / +% %HH#<6
)
H0 ;
Câu 8. )
B 3 #",5#"&< 3 ! 5 ! #
&
1.2 $ 3&L $ - 3+)&
2. 1 !#)>D55 3 )>,#55 Z"
)
86
+
5 55 L, -12&I /9)55 L ,
/)D55 A6
# 5B
)
86
#K&I /D55
B
)
<
)
6
># 5B
)
86
, HH>D55 A6
&2
2&
Câu 9. )
! # # ==[- 4- <,15 !
"V8&B ! @>H\&
1.' ! ",1- "&
2. " !,"# #V "
)*
#3
*
,! 1
4 #8
)7
- %)/9
+
! "
)9)

@>00\, - 5 MV #
/7C
3
C
8
&
2 " !,"& "
------------------------H T--------------------Ế
- Thí sinh không đ c s d ng tài li u (k b ng h th ng tu n hoàn các nguyên t hóa h c).ượ ử ụ ệ ể ả ệ ố ầ ố ọ
- Cán b coi thi không gi i thích gì thêm.ộ ả
B 1!]]]]]]]]]]]]]]]]]]]&^8 #5]]]]]]]&
S GIÁO D C VÀ ĐÀO T OỞ Ụ Ạ
HÀ TĨNH
KỲ THI CH N H C SINH GI I T NH L P 10 THPTỌ Ọ Ỏ Ỉ Ớ
NĂM H C 2022-2023Ọ
: HÓA H CỌ
H NG D N CH MƯỚ Ẫ Ấ
Câu 1.
1. ! ""# $ !%&
a.' (""# &
b. ' (""#
)*
+*
, ! ""# $ &
2. ! ,- . /0&' -1 .&
3. 2 #! ! 2 '3-()&
a.2 2, ! ""# 4#2&
b.2 $,5 ( 26
)
26
)
7
26
)
*
&
c.8#! - 626#26
)
26
)
7
26
)
*
, 1&
Ý N i dungộ Đi mể
1
#, ""#$ ,#$ !"#$
/!
)
^)!
)
^+!
)
^!
/
@_< (""# K $
/!
)
)!
)
)
;
+!
)
+
;
!
/
@_R@/HV#!!
/!
)
)!
)
)
;
+!
)
+
;
+5
>
!
/
@_R@)<#
/!
)
)!
)
)
;
+!
)
+
;
+5
/
!
/
@_R@)H<#"
! " $ <#
@_< (<
)*
/!
)
)!
)
)
;
+!
)
+
;
+5
^<
+*
/!
)
)!
)
)
;
+!
)
+
;
+5
+
3x0,25
2x0,25
2
)V*@/0)V*@/09
'(V/0 # @/^)^+^;^H
@/)V*@/0@;@;3@/)
;
;
<
@))V*@H@+@+3@;
;
+
D
@+)V*@;@)@)3@
)
B"
@;)V*@+@/@/3@)
)
/
B
@H)V*@)@/@3@/
/
/
B
4x0,25
3 a.2 >" , ) ""#T2
R@%/!
)
)!
)
)
+
&
! @) l @/
l
@*/
!
@*/9)
0,25
0,25
b.
6
)
N
O
O
!
)
B( ' &
6
)
7
N
O
O
N
O
O
ch÷ V
th¼ng
!
)
B( ' &
3x0,25
+9)
Đ THI CHÍNH TH CỀ Ứ
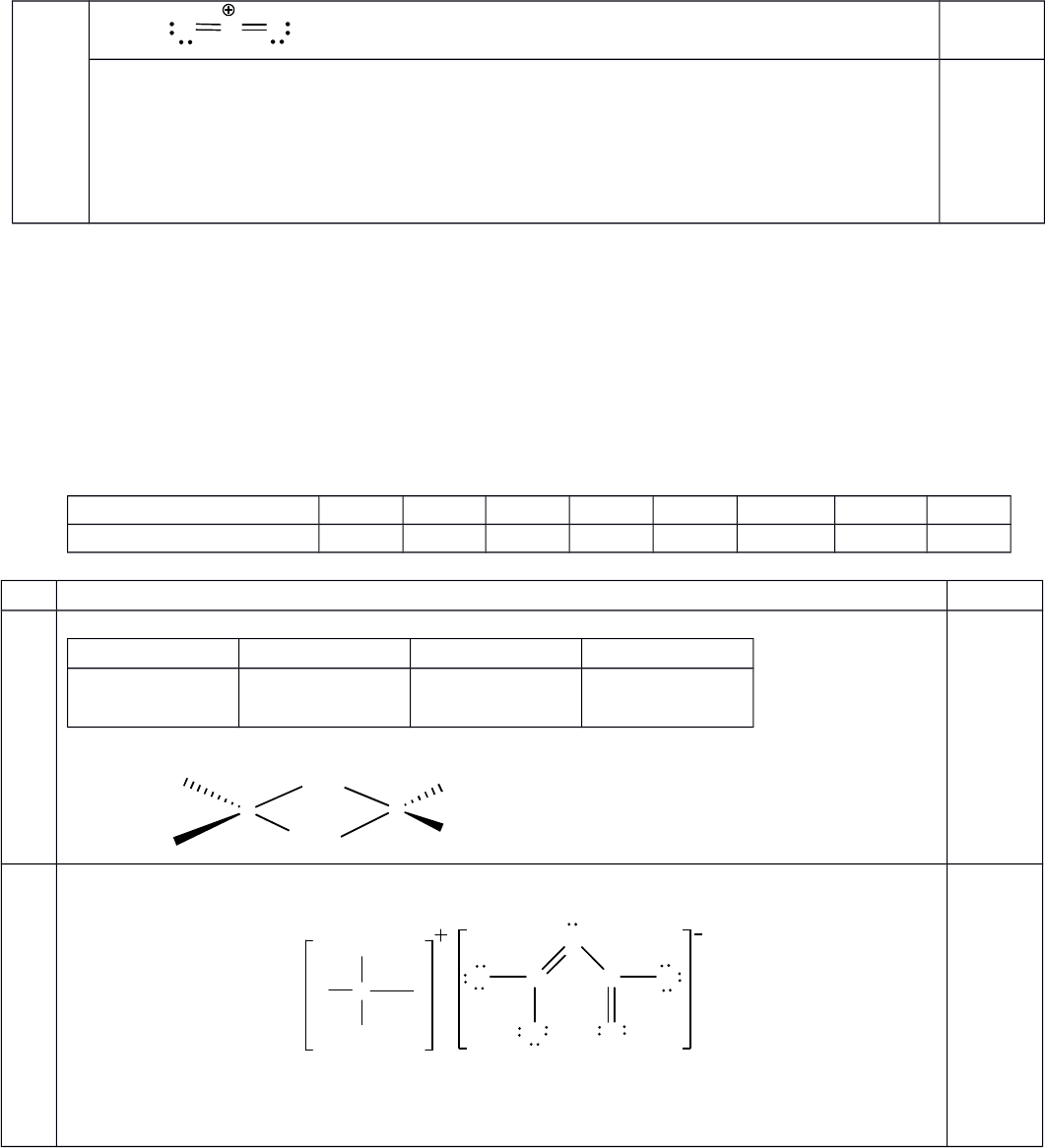
6
)
*
N
O
O
N
O
O
ch÷ V
th¼ng
!5 '
c. Y 66#6
)
*
_6
)
_6
)
7
&
/0
/+)
//>
7O#6
)
*
!
76
)
,6
)
7
!
)
6
)
J/""#
- ""#- #6 %
)
7
J/ ""# %
- &
0,25
0,25
Câu 2. )
1. # - # #5",#" !
9:# /;;;%;&<# $ , m/z! #
# $ = / ,
/)%
=,< ,
+>
<,
+%
<&
a. 2 $ ?! - #" , m/z@/;;;,%;&
b. ' $ # $ m/z@%;&
2.A $ #5#5"B
6
)
)
$ -1#"
,-1#C"&' ( ,1 & <#
D- EB E @ E6 @6
BE6 6@6
F-G&#
E/
+H/ /; /0 )/ ;% H/ ;% H>
Y Ni dung Đim
1
a.
m/z
164 466 476
Phân tử I
37
Cl I
2
35
Cl
5
37
Cl I
2
37
Cl
6
b.
3x0,25
0,25
2
"# ( $ !
B
6
)
)
T)
)
*)B
)
6*6
)
B
B
B
B
O N
O
N
N
O
O
O N
O
N
N
O
O
C
D
)H0
B
@&F
EB
*/&F
E
*/&F
@
*+&F
E6
*/&F
@6
7)F
7&F
BE6
E/&F
6@6
@
- 893 (kJ·mol
–1
).
0,25
0,75
Câu 3. )
I ,
/+/
>+
=
54#
/+
>)
"
"##J $&#
/+
>)
"
/ "#
/+/
>)
"
, $K
7
#
/+/
>+
=
&
1.' ( $C -
/+/
>+
=
&
2.# + /D55
/+/
>+
=
/0&/
/
7
&
a.1
/+/
>+
=
#55 "# , #9D&
9)
=
+%
<
+%
<
=
+%
<
+%
<
+%
<
+%
<
b.8## C 55
/+/
>+
=
J/
+
LM9DN
L -(K
/+/
>+
=
0)&
Ý N i dungộ Đi m ể
1
`V ( $C -
/+/
>+
=
&
/+ / /+/
>) >)
Te n Te
^
/+/ /+/
>) >+
Te I
2x0,25
2
* Y
!
/+/
>+
I
#/D55 &
8
/+/
>+
I
#/D55 ! @
&"
7-
&
' -@;H+90)&)&;@;&/
7>
7/
&
a.8
7
# @+&;@/0
7@
/7"
7-
@/0&/
/
@/&/
/;
8
/+/
>+
I
@/&/
/;
9;))&/
)+
9/@16,6 mol/L.
0,5
0,5
b.B# C 1#/D55
3
!#
@-
@;&/
7>
&/&/
/;
9;@/&/
/
LM9D&
3
!
93
!#
@
/9)
9
/9 )
t t
@/
+
9/
/
@/
7%
9
/9)
/9)@7%t = 186,49 ngày
0,5
Câu 4. )
1. O ,# # $ K 1
a.P # #!#! P # !Q&
b.<$ B
)
6 ( $ 5 B !
)
6
&
c.6
)
- P5" #
)
6
&
d.86
)
# <6
)
&
2. L 2.R #4 -S # !
0&8 . ( ! 2,R&<5#C5"#
# 2.R 3L<&
a.2 2.R&
b.8#!15 3L<&
Ý N dungộ Đi m ể
1
&V/!
)
)!
)
)
;
+!
)
+
+
8/!
)
)!
)
)
;
+!
)
+
V (""#K#J $ /""#- $
V- 8&
' P # V 8&
0,25
&O#$ B
)
6 #- 5#", 0,25
c. O##6
)
/""# $)$ 6
)
- , #
)
6
&
0,25
5& 5$
V$ <6
)
5 -$ #" & ' (
V$ 86
)
5 -$ #" _ (
0,25
2 a) D C 2V.8R<
b) 15B
+
V6
aB
)
86
aB<6
0,5
0,5
Câu 5. )
1. <$ ( !"# P ""#&
a. B
)
6
)
*A6
*B
)
86
T86
*6
)
*A
)
86
*B
)
6&
b.<
)
8
+
*6
+
)
*A
)
<6
+
TA
)
<6
*A
)
86
*A
)
6
*6*<6
)
2. , ! 5 -# 1>)> " !
,# L":" +55 A
)
<
)
6
%
)9#
5B
)
86
+U, #3
*
)>9 C &L C #
#<
)
B
>
6B #C <B
+
<66B,# 55 5 <
)
6
%
)7
##
>9)