Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có đáp án) SỞ GIÁO D C Ụ VÀ ĐÀO T O Ạ KỲ THI H C Ọ SINH GI I Ỏ C P Ấ T NH Ỉ THPT Đ T Ợ 2 TỈNH QU NG Ả NAM NĂM H C Ọ 2022-2023 Đ Ê CHINH TH C Ư
Môn thi: HÓA H C Ọ 10 (Đ
ề thi gồm có 04 trang)
Thời gian: 180 phút (không k ể th i ờ gian giao đ ) ề
Khóa thi ngày: 15/3/2023 Cho bi t ế : H n ằ g s ố Faraday F= 96485 C. 1 mol ; S
ố Avogađro NA = 6,023.1023 1
mol ; T(K) = toC + 273; RT 0,059 1
1W = 1 J.s ; 1 bar = 1,0.105 Pa; 1atm = 1,01325.105Pa , lnX =
lgX , ΔH và ΔS không phụ nF n thu c ộ vào nhi t ệ đ . ộ Nguyên t ử kh i
ố : H = 1; C = 12; O = 16; F = 19; Mg = 24; Cl = 35,5; Ca = 40; Br = 80; Ag = 108. Câu 1. (4,0 đi m ể )
1.1. Iron (Fe) có Z = 26 là nguyên t ố hóa h c ọ r t ấ ph ổ bi n ế và quan tr ng ọ . a. Xác đ nh ị bộ 4 số lư ng
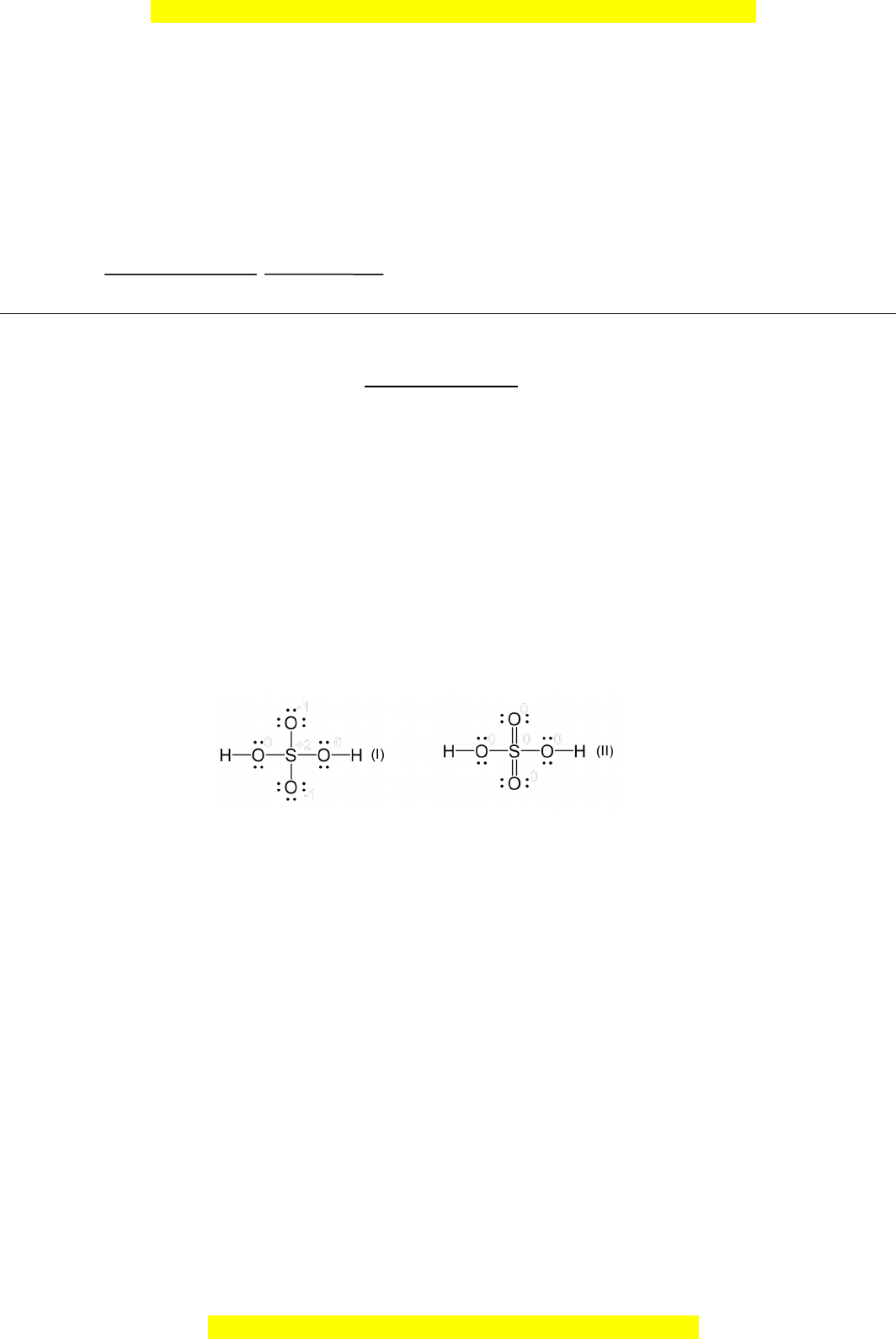
ợ tử cho electron có năng lư ng ợ cao nh t ấ trong nguyên tử ở trạng thái c ơ bản. (Quy ư c ớ giá tr ịmℓ x p ế theo th ứ t ự t ừ âm đ n ế dư ng) ơ . b. Khi tham gia ph n ả ng ứ hóa h c ọ , nguyên t ử Fe như ng ờ 2 electron t o ạ thành ion Fe2+, có th ể có các c u ấ hình electron nh ư sau: 1s22s22p63s23p63d44s2 (1) 1s22s22p63s23p63d6 (2) Sử d n ụ g công th c ứ tính năng lư n ợ g AO c a ủ Slater, hãy cho bi t ế c u ấ hình electron b n ề c a ủ ion Fe2+. 1.2. Hai công th c ứ Lewis c a ủ phân t ử H2SO4 đã đư c ợ đề xu t. ấ Công th c ứ (I) th a ỏ mãn qui tắc bát t , ử công th c ứ (II) không th a ỏ mãn qui t c ắ bát t . ử Các nghiên c u ứ g n ầ đây ch ỉra r ng, ằ công th c ứ (II) là phù h p ợ h n. ơ a. Dựa vào đi n ệ tích hình th c ứ đ ể gi i ả thích công th c ứ (II) phù h p ợ h n ơ .
b. Vì sao oxygen và sulfur thu c ộ cùng nhóm VIA nh ng
ư sulfur có thể có hóa trị VI mà oxygen thì không? c. Xác đ nh ị tr ng ạ thái lai hóa c a ủ nguyên t ử sulfur trong phân t ử H2SO4.
1.3. 131I phóng xạ đư c ợ dùng dư i ớ d ng ạ NaI để đi u ề trị ung thư tuy n ế giáp. Chất này phóng xạ β v i ớ chu kỳ bán h y ủ là 8,05 ngày. a. Vi t ế phư ng ơ trình của phản ng ứ phân rã h t ạ nhân 131I . b. N u ế m u ẫ ban đ u ầ ch a
ứ 1,0 microgam 131I thì trong m i ỗ phút bao nhiêu h t ạ β đư c ợ phát ra? 1.4. Tại nhi t
ệ độ phòng, tinh thể h p ợ ch t
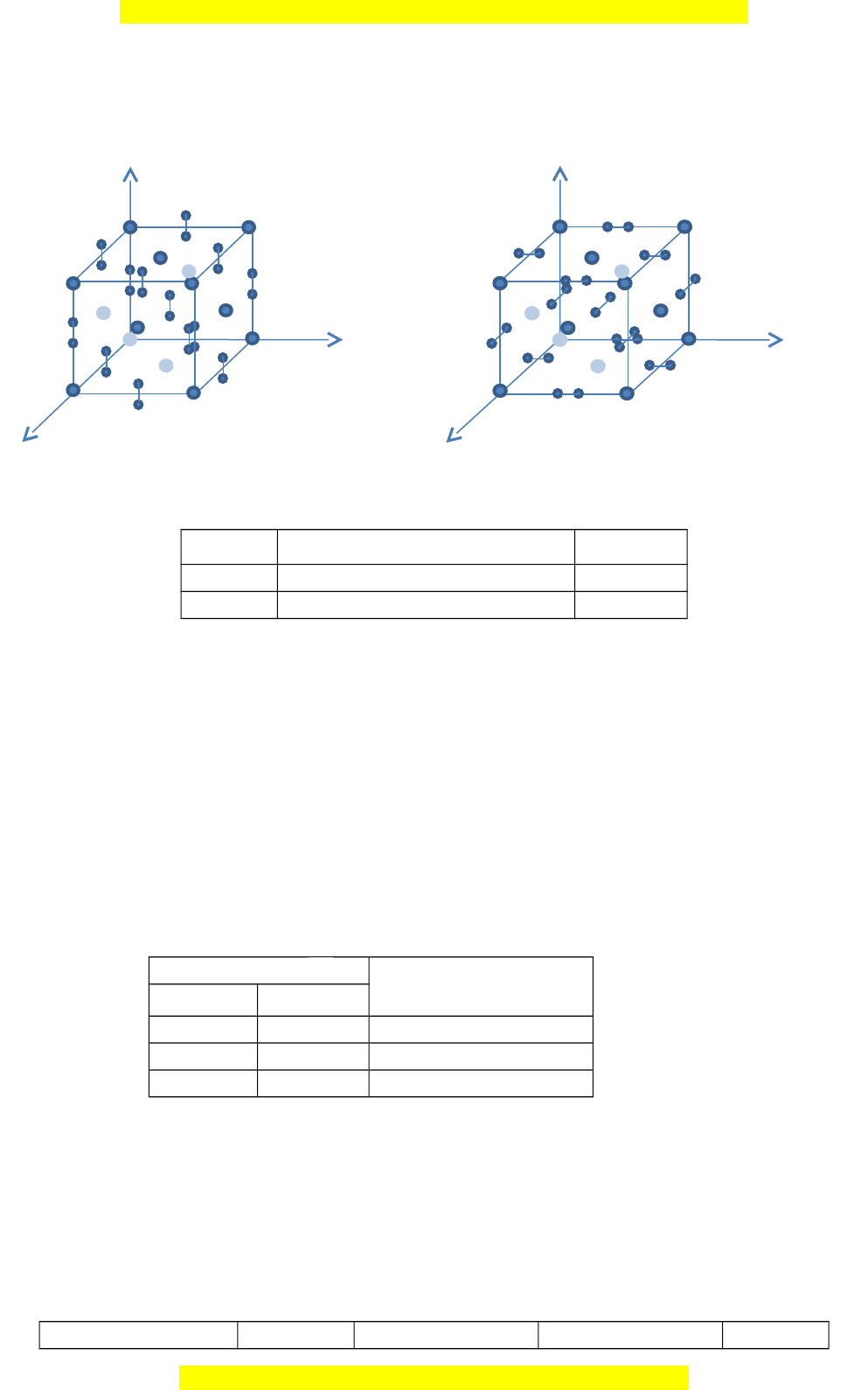
ấ carbide (cacbua) MC2 (M là Mg, Ca, Sr, Ba) đ u ề có c u ấ trúc tinh thể ki u ể NaCl bi n ế d ng ạ theo tr c ụ z (h ệ t ứ phư ng ơ a = b ≠ c). C ụ thể
là các cation M2+ tạo thành m ng ạ l p ậ phư ng ơ tâm di n ệ bi n ế d ng ạ theo tr c ụ z, các anion 2 C 2 sẽ chi m ế các lỗ tr ng ố bát di n ệ c a ủ m ng ạ này. Trong m ng ạ tinh thể c a ủ MC2 (M là Ca, Sr, M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có đáp án) Ba) các anion đ nh ị hư ng ớ song song v i ớ tr c ụ z. Trong m ng
ạ tinh thể MgC2, các anion 2 C 2 trong cùng 1 l p ớ (theo tr c ụ z) có đ nh ị hư ng
ớ như nhau và song song v i ớ 1 trong 2 tr c ụ x ho c ặ y và các l p ớ anion k ế ti p ế đ nh ị hư ng ớ vuông góc v i ớ nhau. (Nh ư hình dư i) ớ z z C 2- C 2- 2 2 Ca2++ Mg2+ y y x x C u t ấ rúc mạng tinh th c ể a ủ CaC Cấu trúc m ng t ạ inh th c ể ủa MgC 2 2 Dựa trên thông s t ố h c ự nghi m ệ trong bảng sau: MC 3 2 Khối lư ng ợ riêng (g/cm ) Tỉ s ố c/a MgC2 2,065 0,9025 CaC2 2,207 1,1619 Xác đ nh ị các thông s ố m ng ạ (a, b, c) c a ủ tinh th ể MgC2 và CaC2. Câu 2. (4,0 đi m ể ) 2.1. Cho 150 gam CO 5
2 ở 273,15K và 1,01325.10 Pa. Xác đ nh ị nhi t ệ và công trong các quá trình sau đây đư c ợ ti n ế hành thu n ậ ngh c ị h nhi t ệ đ ng: ộ a. Dãn đẳng nhi t ệ đ n ế thể tích 300 lít. b. Dãn đ ng ẳ áp đ n ế th ể tích 200 lít. Chấp nh n ậ r ng ằ CO2 là khí lý tư ng ở và nhi t ệ dung đ ng ẳ áp c a ủ nó không đ i ổ trong đi u ề kiện khảo sát và b ng ằ 37,1 1 1 J.mol .K . 2.2. Khí CO gây đ c ộ vì tác d ng ụ v i ớ Hemoglobin (Hb) c a ủ máu theo phư ng ơ trình: 3CO + 4Hb → Hb4(CO)3 Số li u ệ thực nghi m ệ tại 200C và đ ng ộ h c ọ ph n ả ng ứ nh ư sau: Nồng đ ộ (μmol. 1 l ) Tốc độ phân h y ủ Hb CO Hb (μmol. 1 1 l .s ) 1,50 2,50 1,05 2,50 2,50 1,75 2,50 4,00 2,80 Hãy tính t c ố đ ộ ph n ả ng ứ khi n ng ồ đ
ộ CO là 1,30; Hb là 3,20 (đ u ề theo μmol. 1 l ) ở 200C.
2.3. Muối CoCl2 đư c ợ sử d ng ụ là ch t ấ chỉ thị độ m ẩ , b i
ở vì CoCl2 ở dạng khan có màu xanh, khi hút m ẩ t o
ạ ra CoCl2.2H2O(s) có màu tím và CoCl2.6H2O(s) có màu h ng. ồ Các ph n ả ứng có th ể đư c ợ bi u ể di n ễ nh ư sau:
CoCl2(s) + 2H2O(g) → CoCl2.2H2O(s) (1)
CoCl2.2H2O(s) + 4H2O(g) → CoCl2.6H2O(s) (2) Dữ ki n ệ nhi t ệ đ ng ộ h c ọ c a ủ các ch t ấ đư c ợ cho ở b ng ả dư i ớ . H p ợ chất CoCl2(s) CoCl2.2H2O(s) CoCl2.6H2O(s) H2O(g) M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có đáp án) 0 1 Δ H (kJ.mol ) -312,54 -922,99 -2115,43 -241,82 f 298 0 1 1 S (J.K .mol ) 109,16 188,28 343,09 188,72 298 a. Tính bi n ế thiên năng lư ng ợ Gibbs và h ng ằ s ố cân b ng ằ c a ủ các ph n ả ng ứ trên ở 298K. b. Khi đ t ặ ch t
ấ chỉ thị CoCl2(s) ở môi trư ng ờ m, ẩ màu s c ắ c a ủ nó sẽ thay đ i ổ như thế nào khi áp su t ấ h i ơ nư c ớ l n ầ lư t ợ là 2,0. 5 10 atm và 2,0. 3 10 atm? c. Ch t
ấ chỉ thị CoCl2 có thể đư c ợ tái sử d n ụ g b n
ằ g cách đun nóng. Dự đoán nhi t ệ độ để ch t ấ ch ỉth ịđư c
ợ hoàn nguyên hoàn toàn trong môi trư n ờ g khí quy n ể có áp suất h i ơ nư c ớ là 2,0. 2 10 atm. Câu 3. (4,0 đi m ể ) 3.1. Dung d c ị h X ch a
ứ 2 acid HCl 0,001M và HCOOH 0,1M. Hòa tan 2,856 gam KOH vào dung dịch X, thu đư c ợ 1 lít dung d c ị h Y. Tính pH c a ủ dung d c ị h Y. Bi t ế Ka(HCOOH) = 1,8. 4 10 . 3.2. Aspirin là thu c ố gi m ả đau, hạ s t ố và ch ng ố viêm. Trong môi trư ng ờ nư c ớ , Aspirin là m t
ộ acid và phân li proton theo ph n ả ng: ứ Tại 25oC bi n ế thiên năng lư ng ợ Gibbs chu n ẩ c a ủ ph n ả ng ứ là +19,9 kJ. a. Dựa vào d u ấ c a ủ giá trị 0 ΔG có k t ế lu n ậ đư c ợ ph n ả ng ứ phân li proton c a ủ Aspirin là 298
không xảy ra hay không? N u ế có x y ả ra, tính pH c a ủ dung d c ị h Aspirin 0,1 M t i ạ 298K. b. Trong môi trư n ờ g cơ th , ể nhờ vào các hệ đ m ệ tự nhiên, pH s ẽ đư c ợ duy trì ở giá tr ị n ổ đ n ị h. Tính ph n ầ trăm các d n ạ g t n ồ t i ạ (trung hòa và anion) c a ủ Aspirin trong môi trư n ờ g dạ dày (pH = 2,0) và ru t ộ non (pH = 7,8). c. Khả năng khu c ế h tán c a ủ m t ộ ch t
ấ qua màng lipid không phân c c ự c a ủ d ạ dày và ru t ộ để vào máu phụ thu c ộ m nh ạ vào tỉ lệ gi a ữ d ng
ạ không ion hóa và ion hóa c a ủ ch t ấ đó. Trong môi trư ng ờ dạ dày hay ru t ộ non, Aspirin s ẽ đư c ợ h p ấ th ụ vào máu nhi u ề h n? ơ 3.3. Dung d c ị h A g m
ồ Fe(NO3)3 0,05M; Pb(NO3)2 0,10M; Zn(NO3)2 0,01M. S c ụ khí H2S vào dung d c ị h A đ n
ế bão hòa ([H2S] = 0,10M), thu đư c ợ h n ỗ h p ợ k t ế t a ủ B. Nh ng ữ k t ế t a ủ nào có trong B? Bi t ế H 17,2 2S có các h ng
ằ số acid là pK1 = 7,02; pK2 = 12,90. Tích số tan c a ủ FeS là 10 ; ZnS là 21,6 10 ; PbS là 26,6 10 . 0 E = 0,771 V 0 E = 0,141 V 0 E = - 0,126 V 0 E = - 0,763V 0 E = - 0,44 V 3+ 2+ ; ; ; ; . Fe /Fe S/H 2+ 2+ 2+ 2S Pb /Pb Zn /Zn Fe /Fe Câu 4. (4,0 đi m ể ) 4.1. Pin nhiên li u ệ hydrogen đư c ợ phát minh năm 1839 b i ở nhà khoa h c ọ William Robert Grove. Nguyên t c ắ ho t ạ đ ng ộ c a ủ pin là chuy n ể tr c ự ti p ế năng lư ng ợ hóa h c ọ thành năng lư ng ợ điện. Phản ng ứ x y ả ra trong pin gi ng ố nh ư ph n ả ng ứ đ t ố cháy H2, các h p ợ ch t ấ trong pin đư c ợ xét ở đi u ề ki n ệ chu n
ẩ (298K) và không thay đ i ổ trong c ả quá trình. Bi t ế phản ng ứ x y ả ra ở các đi n ệ c c ự nh ư sau: Cực âm: H H 2(g) → 2 + (aq) + 2e 1 Cực dư ng: ơ O H + 2e → H 2 2(g) + 2 + (aq) 2O(l) M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có đáp án) a. Tính suất đi n ệ đ ng ộ c a ủ pin. (Cho 0 E = 0,00 V 0 E = 1,23 V + ; ) 2H / H O / H O 2 2 2 b. Tính năng lư ng ợ đi n ệ c c ự đ i ạ theo lý thuy t ế có th ể thu đư c ợ khi đ t ố cháy 1 mol H2. c. Giả sử m t ộ xe đi n
ệ tiêu thụ từ 10 – 20 kWh/100km. Tính th ể tích khí H2 cần thi t ế để tạo ra năng lư ng ợ đi n ệ là 20kWh ở 1,0 bar. 4.2. Trong m t ộ h n ỗ h p ợ g m
ồ KMnO4 0,010 M, H2SO4 0,500 M, FeSO4 0,020 M, Fe2(SO4)3 0,005 M.
a. Tính hằng số cân b ng ằ c a ủ phư ng ơ trình ion x y ả ra ở 250C.
b. Tính nồng độ các ion khi ph n ả ng ứ k t ế thúc. (Cho 0 E = +1,51V 0 E ) = +0,77V - + 2+ ; Mn 3 2+ 4 O ,H / Mn Fe / Fe 4.3. Dung d c ị h H2O2 đư c
ợ dùng để sát trùng trong y h c ọ , tr ng ạ thái b n ề c a ủ H2O2 so sánh v i
ớ O2 và H2O theo giản đồ sau: + 0,68V + 1,77V
O H O H O 2 2 2 2 a. Hãy so sánh đ ộ b n ề gi a ữ các d ng ạ oxi hóa – kh ử và t ừ đó cho bi t ế c n ầ l u ư ý gì khi sử dụng dung d c ị h H2O2. b. Tính 0 E 0 E O và . 2 ,H / H2O O2 /OH Câu 5. (4,0 đi m ể )
5.1. Giải thích vì sao khi cho HF tác d ng ụ v i ớ dung d c
ị h NaOH hay KOH thì tỉ lệ t o ạ
muối fluoride (NaF hay KF) th p ấ h n ơ mu i
ố hydrogen fluoride (NaHF2 hay KHF2)? 5.2. Có ba mu i ố A, B, C c a ủ cùng kim lo i ạ Mg và t o ạ ra t ừ cùng m t ộ acid. Cho A, B, C tác dụng v i ớ nh ng ữ lư ng ợ như nhau c a
ủ acid HCl thì có cùng m t ộ ch t ấ khí X thoát ra v i ớ t ỉlệ mol tư ng ơ ng ứ là 2:4:1. Xác đ nh ị A, B, C và vi t ế phư ng ơ trình hóa h c ọ c a ủ các ph n ả ng ứ xảy ra. Bi t ế khí X làm m t ấ màu dung d c ị h Br2. 5.3. Cho h n ỗ h p ợ A g m ồ hai mu i
ố NaX, NaY (X, Y là hai halogen k ế ti p) ế . Đ ể k t ế t a ủ hoàn toàn 2,2 gam h n ỗ h p ợ A c n ầ 150 ml dung d c ị h AgNO3 0,2M. a. Tính khối lư ng ợ k t ế tủa thu đư c ợ . b. Bi t ế có ph n ả n
ứ g sau đây: X2 + KYO3 → KXO3 + Y2. Xác đ n ị h X, Y. c. Từ k t ế luận ở câu b, hãy cho bi t ế chi u ề c a ủ ph n ả ng: ứ X2 + 2KY Y2 + 2KX 5.4. Vi t ế phư ng ơ trình hóa h c ọ c a ủ các ph n ả ng ứ x y ả ra theo s ơ đ ồ sau: Trong đó: A0 là h p ợ ch t ấ c a ủ m t ộ kim lo i ạ và m t ộ phi kim. A, A1, A2, C, Q là các h p ợ ch t ấ c a ủ l u ư huỳnh. B, B1, B2, C là các h p ợ ch t ấ c a ủ đ ng ồ ho c ặ đ ng ồ kim lo i. ạ ---------- H T Ế ---------- M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đề HSG Hóa 10 Sở Quảng Nam năm 2023 có đáp án
1 K
519 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Tài liệu được cập nhật liên tục trong gói này từ nay đến hết tháng 3/2024. Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu Đề HSG Hóa 10 Sở Quảng Nam năm 2023 có đáp án.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(1037 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 10
Xem thêmTài liệu bộ mới nhất

! "#$$ %
% &'() &&*+
,-%'' "&' " .% &'%'.% %/
&0+' "/1//2/1/3
"'4&'%' "
(Đ thi g m có ề ồ 04 trang)
+56 '7*' "81
% 6 891:(không k th i gian giao đ )ể ờ ề
,6 8;<3</1/3
Cho bi t:ế H ng s Faraday F= 96485 C.ằ ố
1
mol
; S Avogađro Nố
A
= 6,023.10
23
1
mol
; T(K) = t
o
C + 273;
1
1W = 1 J.s
; 1 bar = 1,0.10
5
Pa; 1atm = 1,01325.10
5
Pa ,
RT 0,059
lnX = lgX
nF n
, ΔH và ΔS không phụ
thu c vào nhi t đ .ộ ệ ộ
Nguyên t kh i: H = 1; C = 12; O = 16; F = 19; Mg = 24; Cl = 35,5; Ca = 40; ử ố Br = 80; Ag = 108.
"8=>1
8=8=Iron (Fe) có Z = 26 là nguyên t hóa h c r t ph bi n và quan tr ngố ọ ấ ổ ế ọ .
= Xác đ nh b 4 s l ng t cho electron có năng l ng cao nh t trong nguyên t ị ộ ố ượ ử ượ ấ ử ở
tr ng thái c b n. (Quy c giá tr mạ ơ ả ướ ị
ℓ
x p theo th t t âm đ n d ng).ế ứ ự ừ ế ươ
= Khi tham gia ph n ng hóa h c, nguyên t Fe nh ng 2 electron t o thành ion Feả ứ ọ ử ườ ạ
2+
, có
th có các c u hình electron nh sau:ể ấ ư
1s
2
2s
2
2p
6
3s
2
3p
6
3d
4
4s
2
(1)
1s
2
2s
2
2p
6
3s
2
3p
6
3d
6
(2)
S d ng công th c tính năng l ng AO c a Slater, hãy cho bi t c u hình electron b n c a ionử ụ ứ ượ ủ ế ấ ề ủ
Fe
2+
.
8=/= Hai công th c Lewis c a phân t Hứ ủ ử
2
SO
4
đã đ c đ xu t. Công th c (I) th a mãn quiượ ề ấ ứ ỏ
t c bát t , công th c (II) không th a mãn qui t c bát t . Các nghiên c u g n đây ch ra r ng,ắ ử ứ ỏ ắ ử ứ ầ ỉ ằ
công th c (II) là phù h p h n.ứ ợ ơ
= D a vào đi n tích hình th c đ gi i thích công th c (II) phù h p h n.ự ệ ứ ể ả ứ ợ ơ
= Vì sao oxygen và sulfur thu c cùng nhóm VIA nh ng sulfur có th có hóa tr VI màộ ư ể ị
oxygen thì không?
= Xác đ nh tr ng thái lai hóa c a nguyên t sulfur trong phân t Hị ạ ủ ử ử
2
SO
4
.
8=3=
131
I
phóng x đ c dùng d i d ng ạ ượ ướ ạ NaI đ đi u tr ung th tuy n giáp. ể ề ị ư ế Ch t nàyấ
phóng x ạ
β
v i chu kỳ bán h y là 8,05 ngày.ớ ủ
= Vi t ph ng trình c a ph n ng phân rã h t nhân ế ươ ủ ả ứ ạ
131
I
.
= N u m u ban đ u ch a 1,0 microgam ế ẫ ầ ứ
131
I
thì trong m i phút bao nhiêu h t ỗ ạ
β
đ c phátượ
ra?
8=>=T i nhi t đ phòng, tinh th h p ch t carbide (cacbua) MCạ ệ ộ ể ợ ấ
2
(M là Mg, Ca, Sr, Ba)
đ u có c u trúc tinh th ki u NaCl bi n d ng theo tr c z (h t ph ng a = b ≠ c). C thề ấ ể ể ế ạ ụ ệ ứ ươ ụ ể
là các cation M
2+
t o thành m ng l p ph ng tâm di n bi n d ng theo tr c z, các anion ạ ạ ậ ươ ệ ế ạ ụ
2
2
C
s chi m các l tr ng bát di n c a m ng này. Trong m ng tinh th c a MCẽ ế ỗ ố ệ ủ ạ ạ ể ủ
2
(M là Ca, Sr,
+ ? @619>/93>;9;
Ba) các anion đ nh h ng song song v i tr c z. Trong m ng tinh th MgCị ướ ớ ụ ạ ể
2
, các anion
2
2
C
trong cùng 1 l p (theo tr c z) có đ nh h ng nh nhau và song song v i 1 trong 2 tr c xớ ụ ị ướ ư ớ ụ
ho c y và các l p anion k ti p đ nh h ng vuông góc v i nhau. (Nh hình d i)ặ ớ ế ế ị ướ ớ ư ướ
D a trên ự thông s th c nghi m trong b ng sau:ố ự ệ ả
MC
2
Kh i l ng riêng (g/cmố ượ
3
) T s c/aỉ ố
MgC
2
2,065 0,9025
CaC
2
2,207 1,1619
Xác đ nh các thông s m ng (a, b, c) c a tinh th MgCị ố ạ ủ ể
2
và CaC
2
.
"/=>1
/=8=Cho 150 gam CO
2
273,15K và 1,01325.10ở
5
Pa. Xác đ nh nhi t và công trong các quáị ệ
trình sau đây đ c ti n hành thu n ngh ch nhi t đ ng:ượ ế ậ ị ệ ộ
= Dãn đ ng nhi t đ n th tích 300 lít.ẳ ệ ế ể
= Dãn đ ng áp đ n th tích 200 lít. ẳ ế ể
Ch p nh n r ng COấ ậ ằ
2
là khí lý t ng và nhi t dung đ ng áp c a nó không đ i trong đi uưở ệ ẳ ủ ổ ề
ki n kh o sát và b ng 37,1 ệ ả ằ
1 1
J.mol .K
.
/=/=Khí CO gây đ c vì tác d ng v i Hemoglobin (Hb) c a máu theo ph ng trình:ộ ụ ớ ủ ươ
3CO + 4Hb → Hb
4
(CO)
3
S li u th c nghi m t i 20ố ệ ự ệ ạ
0
C và đ ng h c ph n ng nh sau:ộ ọ ả ứ ư
N ng đ (μmol.ồ ộ
1
l
) T c đ phân h y Hbố ộ ủ
(μmol.
1 1
l .s
)
CO Hb
1,50 2,50 1,05
2,50 2,50 1,75
2,50 4,00 2,80
Hãy tính t c đ ph n ng khi n ng đ CO là 1,30; Hb là 3,20 (đ u theo μmol.ố ộ ả ứ ồ ộ ề
1
l
) 20ở
0
C.
/=3= Mu i CoClố
2
đ c s d ng là ch t ch th đ m, b i vì CoClượ ử ụ ấ ỉ ị ộ ẩ ở
2
d ng khan có màuở ạ
xanh, khi hút m t o ra CoClẩ ạ
2
.2H
2
O(s) có màu tím và CoCl
2
.6H
2
O(s) có màu h ng. Các ph nồ ả
ng có th đ c bi u di n nh sau:ứ ể ượ ể ễ ư
CoCl
2
(s) + 2H
2
O(g) → CoCl
2
.2H
2
O(s) (1)
CoCl
2
.2H
2
O(s) + 4H
2
O(g) → CoCl
2
.6H
2
O(s) (2)
D ki n nhi t đ ng h c c a các ch t đ c cho b ng d i.ữ ệ ệ ộ ọ ủ ấ ượ ở ả ướ
H p ch tợ ấ CoCl
2
(s) CoCl
2
.2H
2
O(s) CoCl
2
.6H
2
O(s) H
2
O(g)
+ ? @619>/93>;9;
A
y
x
C
2
2-
Ca
2+
+
C u trúc m ng tinh th c a CaCấ ạ ể ủ
2
A
y
x
C
2
2-
Mg
2+
C u trúc m ng tinh th c a MgCấ ạ ể ủ
2

0 1
f 298
Δ H (kJ.mol )
-312,54 -922,99 -2115,43 -241,82
0 1 1
298
S (J.K .mol )
109,16 188,28 343,09 188,72
= Tính bi n thiên năng l ng Gibbs và h ng s cân b ng c a các ph n ng trên 298K.ế ượ ằ ố ằ ủ ả ứ ở
= Khi đ t ch t ch th CoClặ ấ ỉ ị
2
(s) môi tr ng m, màu s c c a nó s thay đ i nh thở ườ ẩ ắ ủ ẽ ổ ư ế
nào khi áp su t h i n c l n l t là 2,0.ấ ơ ướ ầ ượ
5
10
atm và 2,0.
3
10
atm?
= Ch t ch th CoClấ ỉ ị
2
có th đ c tái s d ng b ng cách đun nóng. D đoán nhi t đ để ượ ử ụ ằ ự ệ ộ ể
ch t ch th đ c hoàn nguyên hoàn toàn trong môi tr ng khí quy n có áp su t h i n c là 2,0.ấ ỉ ị ượ ườ ể ấ ơ ướ
2
10
atm.
"3=>1
3=8=Dung d ch X ch a 2 acid HCl 0,001M và HCOOH 0,1M. Hòa tan 2,856 gam KOH vàoị ứ
dung d ch X, thu đ c 1 lít dung d ch Y. Tính pH c a dung d ch Y. Bi t Kị ượ ị ủ ị ế
a(HCOOH)
= 1,8.
4
10
.
3=/=Aspirin là thu c gi m đau, h s t và ch ng viêm. Trong môi tr ng n c, Aspirin làố ả ạ ố ố ườ ướ
m t acid và phân li proton theo ph n ng:ộ ả ứ
T i 25ạ
o
C bi n thiên năng l ng Gibbs chu n c a ph n ng là +19,9 kJ.ế ượ ẩ ủ ả ứ
= D a vào d u c a giá tr ự ấ ủ ị
0
298
ΔG
có k t lu n đ c ph n ng phân li proton c a Aspirin làế ậ ượ ả ứ ủ
không x y ra hay không? N u có x y ra, tính pH c a dung d ch Aspirin 0,1 M t i 298K.ả ế ả ủ ị ạ
= Trong môi tr ng c th , nh vào các h đ m t nhiên, pH s đ c duy trì giá tr nườ ơ ể ờ ệ ệ ự ẽ ượ ở ị ổ
đ nh. Tính ph n trăm các d ng t n t i (trung hòa và anion) c a Aspirin trong môi tr ng dị ầ ạ ồ ạ ủ ườ ạ
dày (pH = 2,0) và ru t non (pH = 7,8). ộ
= Kh năng khu ch tán c a m t ch t qua màng lipid không phân c c c a d dày và ru tả ế ủ ộ ấ ự ủ ạ ộ
đ vào máu ph thu c m nh vào t l gi a d ng không ion hóa và ion hóa c a ch t đó.ể ụ ộ ạ ỉ ệ ữ ạ ủ ấ
Trong môi tr ng d dày hay ru t non, Aspirin s đ c h p th vào máu nhi u h n?ườ ạ ộ ẽ ượ ấ ụ ề ơ
3=3= Dung d ch A g m Fe(NOị ồ
3
)
3
0,05M; Pb(NO
3
)
2
0,10M; Zn(NO
3
)
2
0,01M. S c khí Hụ
2
S
vào dung d ch A đ n bão hòa ([Hị ế
2
S] = 0,10M), thu đ c h n h p k t t a B. Nh ng k t t aượ ỗ ợ ế ủ ữ ế ủ
nào có trong B?
Bi t Hế
2
S có các h ng s acid là pKằ ố
1
= 7,02; pK
2
= 12,90. Tích s tan c a FeS là ố ủ
17,2
10
;
ZnS là
21,6
10
; PbS là
26,6
10
.
3+ 2+
0
Fe /Fe
E = 0,771 V
;
2
0
S/H S
E = 0,141 V
;
2+
0
Pb /Pb
E = - 0,126 V
;
2+
0
Zn /Zn
E = - 0,763V
;
2+
0
Fe /Fe
E = - 0,44 V
.
">=>1
>=8=Pin nhiên li u hydrogen đ c phát minh năm 1839 b i nhà khoa h c William Robertệ ượ ở ọ
Grove. Nguyên t c ho t đ ng c a pin là chuy n tr c ti p năng l ng hóa h c thành năngắ ạ ộ ủ ể ự ế ượ ọ
l ng đi n. Ph n ng x y ra trong pin gi ng nh ph n ng đ t cháy Hượ ệ ả ứ ả ố ư ả ứ ố
2
, các h p ch t trongợ ấ
pin đ c xét đi u ki n chu n (298K) và không thay đ i trong c quá trình. ượ ở ề ệ ẩ ổ ả
Bi t ph n ng x y ra các đi n c c nh sau:ế ả ứ ả ở ệ ự ư
C c âm: ự H
2(g)
→ 2
+
(aq)
H
+ 2e
C c d ng: ự ươ
1
2
O
2(g)
+ 2
+
(aq)
H
+ 2e → H
2
O
(l)
+ ? @619>/93>;9;

= Tính su t đi n đ ng c a pin. ấ ệ ộ ủ (Cho
+
2
0
2H / H
E = 0,00 V
;
2 2
0
O / H O
E = 1,23 V
)
= Tính năng l ng đi n c c đ i theo lý thuy t có th thu đ c khi đ t cháy 1 mol Hượ ệ ự ạ ế ể ượ ố
2
.
= Gi s m t xe đi n tiêu th t 10 – 20 kWh/100km. Tính th tích khí Hả ử ộ ệ ụ ừ ể
2
c n thi t đầ ế ể
t o ra năng l ng đi n là 20kWh 1,0 bar. ạ ượ ệ ở
>=/=Trong m t h n h p g m KMnOộ ỗ ợ ồ
4
0,010 M, H
2
SO
4
0,500 M, FeSO
4
0,020 M, Fe
2
(SO
4
)
3
0,005
M.
= Tính h ng s cân b ng c a ph ng trình ion x y ra 25ằ ố ằ ủ ươ ả ở
0
C.
= Tính n ng đ các ion khi ph n ng k t thúc.ồ ộ ả ứ ế
(Cho
- + 2+
4
0
MnO ,H / Mn
E = +1,51V
;
3 2+
0
Fe / Fe
E = +0,77V
)
>=3=Dung d ch Hị
2
O
2
đ c dùng đ sát trùng trong y h c, tr ng thái b n c a Hượ ể ọ ạ ề ủ
2
O
2
so sánh
v i Oớ
2
và H
2
O theo gi n đ sau:ả ồ
+ 0,68V + 1,77V
2 2 2 2
O H O H O
= Hãy so sánh đ b n gi a các d ng oxi hóa – kh và t đó cho bi t c n l u ý gì khi sộ ề ữ ạ ử ừ ế ầ ư ử
d ng dung d ch Hụ ị
2
O
2
.
= Tính
2 2
0
O ,H /H O
E
và
2
0
O /OH
E
.
";=>1
;=8= Gi i thích vì sao khi cho HF tác d ng v i dung d ch NaOH hay KOH thì t l t oả ụ ớ ị ỉ ệ ạ
mu i fluoride (NaF hay KF) th p h n mu i hydrogen fluoride (NaHFố ấ ơ ố
2
hay KHF
2
)?
;=/= Có ba mu i A, B, C c a cùng kim lo i Mg và t o ra t cùng m t acid. Cho A, B, C tácố ủ ạ ạ ừ ộ
d ng v i nh ng l ng nh nhau c a acid HCl thì có cùng m t ch t khí X thoát ra v i t lụ ớ ữ ượ ư ủ ộ ấ ớ ỉ ệ
mol t ng ng là 2:4:1. Xác đ nh A, B, C và vi t ph ng trình hóa h c c a các ph n ngươ ứ ị ế ươ ọ ủ ả ứ
x y ra. Bi t khí X làm m t màu dung d ch Brả ế ấ ị
2
.
;=3=Cho h n h p A g m hai mu i NaX, NaY (X, Y là hai halogen k ti p). Đ k t t aỗ ợ ồ ố ế ế ể ế ủ
hoàn toàn 2,2 gam h n h p A c n 150 ml dung d ch AgNOỗ ợ ầ ị
3
0,2M.
= Tính kh i l ng k t t a thu đ c.ố ượ ế ủ ượ
= Bi t có ph n ng sau đây: Xế ả ứ
2
+ KYO
3
→ KXO
3
+ Y
2
. Xác đ nh X, Y.ị
= T k t lu n câu b, hãy cho bi t chi u c a ph n ng: Xừ ế ậ ở ế ề ủ ả ứ
2
+ 2KY
Y
2
+ 2KX
;=>= Vi t ph ng trình hóa h c c a các ph n ng x y ra theo s đ sau:ế ươ ọ ủ ả ứ ả ơ ồ
Trong đó: A
0
là h p ch t c a m t kim lo i và m t phi kim.ợ ấ ủ ộ ạ ộ
A, A
1
, A
2
, C, Q là các h p ch t c a l u huỳnh.ợ ấ ủ ư
B, B
1
, B
2
, C là các h p ch t c a đ ng ho c đ ng kim lo i.ợ ấ ủ ồ ặ ồ ạ
---------- H T ----------Ế
+ ? @619>/93>;9;
Thí sinh đ c s d ng B ng tu n hoàn các nguyên t hóa h c.ượ ử ụ ả ầ ố ọ
Thí sinh không đ c s d ng tài li uượ ử ụ ệ ; Cán b coi thi ộ không gi i thích gì thêm.ả
H và tên thí sinhọ : ............................................................... S báo danhố : .....................
! "#$$ %
% &'() &&*+
,-%'' "&' " .% &'%'.% %/
&0+' "/1//2/1/3
+56'7*' "81
' &! &"' +#$.&
(H ng d n ch m này g m có 11 trang)ướ ẫ ấ ồ
"8=>1
8=8=Iron (Fe) có Z = 26 là nguyên t hóa h c r t ph bi n và quan tr ngố ọ ấ ổ ế ọ .
= Xác đ nh b 4 s l ng t cho electron có năng l ng cao nh t trong nguyên t tr ngị ộ ố ượ ử ượ ấ ử ở ạ
thái c b n. (Quy c giá tr mơ ả ướ ị
ℓ
x p theo th t t âm đ n d ng).ế ứ ự ừ ế ươ
= Khi tham gia ph n ng hóa h c, nguyên t Fe nh ng 2 electron t o thành ion Feả ứ ọ ử ườ ạ
2+
, có thể
có các c u hình electron nh sau:ấ ư
1s
2
2s
2
2p
6
3s
2
3p
6
3d
4
4s
2
(1)
1s
2
2s
2
2p
6
3s
2
3p
6
3d
6
(2)
S d ng công th c tính năng l ng AO c a Slater, hãy cho bi t c u hình electron b n c a ion Feử ụ ứ ượ ủ ế ấ ề ủ
2+
.
8=/= Hai công th c Lewis c a phân t Hứ ủ ử
2
SO
4
đã đ c đ xu t. Công th c (I) th a mãn qui t cượ ề ấ ứ ỏ ắ
bát t , công th c (II) không th a mãn qui t c bát t . Các nghiên c u g n đây ch ra r ng, côngử ứ ỏ ắ ử ứ ầ ỉ ằ
th c (II) là phù h p h n.ứ ợ ơ
= D a vào đi n tích hình th c đ gi i thích công th c (II) phù h p h n.ự ệ ứ ể ả ứ ợ ơ
= Vì sao oxygen và sulfur thu c cùng nhóm VIA, nh ng sulfur có th có hóa tr VI mà oxygenộ ư ể ị
thì không?
= Xác đ nh tr ng thái lai hóa c a nguyên t sulfur trong phân t Hị ạ ủ ử ử
2
SO
4
.
8=3=
131
I
phóng x đ c dùng d i d ng ạ ượ ướ ạ NaI đ đi u tr ung th tuy n giáp. ể ề ị ư ế Ch t này phóngấ
x ạ
β
v i chu kỳ bán h y là 8,05 ngày.ớ ủ
= Vi t ph ng trình hóa h c c a ph n ng phân rã h t nhân ế ươ ọ ủ ả ứ ạ
131
I
.
= N u m u ban đ u ch a 1,0 microgam ế ẫ ầ ứ
131
I
thì trong m i phút bao nhiêu h t ỗ ạ
β
đ c phát ra?ượ
8=>=T i nhi t đ phòng, tinh th h p ch t carbide (cacbua) MCạ ệ ộ ể ợ ấ
2
(M là Mg, Ca, Sr, Ba) đ u cóề
c u trúc tinh th ki u NaCl bi n d ng theo tr c z (h t ph ng a = b ≠ c). C th là các cationấ ể ể ế ạ ụ ệ ứ ươ ụ ể
M
2+
t o thành m ng l p ph ng tâm di n bi n d ng theo tr c z, các anion ạ ạ ậ ươ ệ ế ạ ụ
2-
2
C
s chi m các lẽ ế ỗ
tr ng bát di n c a m ng này. Trong m ng tinh th c a MCố ệ ủ ạ ạ ể ủ
2
(M là Ca, Sr, Ba) các anion đ nhị
h ng song song v i tr c z. Trong m ng tinh th MgCướ ớ ụ ạ ể
2
, các anion
2-
2
C
trong cùng 1 l p (theoớ
tr c z) có đ nh h ng nh nhau và song song v i 1 trong 2 tr c x ho c y và các l p anion kụ ị ướ ư ớ ụ ặ ớ ế
ti p đ nh h ng vuông góc v i nhau. (Nh hình d i)ế ị ướ ớ ư ướ
+ ? @619>/93>;9;























