Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t (c ế ó đáp án) UBND T N Ỉ H THÁI NGUYÊN KÌ THI CHỌN H C Ọ SINH GI I Ỏ T N Ỉ H SỞ GIÁO D C Ụ VÀ ĐÀO T O Ạ L P
Ớ 10 NĂM HỌC 2022-2023 MÔN THI: HÓA HỌC Th i
ờ gian: 150 phút (không k th ể i ờ gian giao đ ) ề
(Đề thi có 02 trang, g m ồ 10 câu) Câu 1. (2,0 đi m) ể Chỉ dùng m t
ộ hóa chất duy nhất duy nhất làm thu c ố th , b ử ng ph ằ ư ng phá ơ p hóa h c ọ
hãy nhận biết các dung dịch đ ng t ự rong các lọ riêng bi t
ệ sau: H2SO4, HCl, NaOH, K2SO4. Viết PTHH của các phản ng x ứ ảy ra. Câu 2. (2,0 đi m) ể Lập phư ng ơ trình hóa h c ọ c a ủ các ph n ả ng oxi ứ hóa kh s ử au theo phư ng phá ơ p thăng bằng electron:
a. Na2SO3 + NaHSO4 + KMnO4 Na2SO4 + MnSO4 + K2SO4 + ...
b. FeO + HNO3 Fe(NO3)3 + NxOy + ...
c. Cu + H2SO4 (đặc nóng) ……. + SO2 + H2O
d. Cu2S + HNO3 Cu(NO3)2 + CuSO4 + NO + ... Câu 3. (2,0 đi m)
ể Cho các phân tử H2O, NCl3, CH4, CS2, SO3. a. Viết công th c ứ Lewis c a
ủ các phân tử trên và cho bi t ế nguyên t t ử rung tâm trong m i ỗ phân t ử t ở r ng ạ thái lai hóa nào?
b. Phân tử nào phân cực, phân tử nào không phân cực? Vì sao? Câu 4. (2,0 đi m)
ể Cho X, Y, Z là bao nguyên tố hóa h c ọ . T ng s ổ h ố ạt mang đi n t ệ rong ba phân tử X2Y, ZY2, X2Z là 200. S h ố ạt mang đi n ệ c a ủ phân t X ử 2Y bằng 15/16 lần s h ố ạt mang đi n ệ c a ủ phân t Z ử Y2. Ở
trạng thái cơ bản, nguyên t Z ử có s e ố lectron trên phân l p ớ p b ng 1,667 l ằ n s ầ e ố lectron trên phân l p ớ s. Phân tử T g m ồ 6 nguyên t t ử ạo b i
ở 3 nguyên tố X, Y, Z. Xác đ nh c ị ông th c ứ phân t c ử a ủ T. Câu 5. (2,0 đi m)
ể Trong quá trình t ng h ổ p ni ợ tric acid, giai đoạn đ t
ố cháy NH3 bằng O2 có xúc tác xảy ra phản ng t ứ rong pha khí nh s
ư au: 4NH3(g) + 5O2(g) 4NO(g) + 6H2O(g). Trong m t ộ thí nghiệm, cho vào bình phản ng (bì ứ
nh kín) 619,75 mL khí NH3 và 743,7 mL khí O2 (có xúc tác, các thể tích khí đo đkc ở ). Sau khi th c ự hi n ệ phản ng ứ 2,5 gi , t ờ hấy có 0,432 gam nư c ớ đư c ợ t o t ạ hành.
a. Viết biểu thức tính t c ố đ t ộ rung bình c a ủ ph n ả ng t ứ heo chất tham gia và ch t ấ t o t ạ hành trong ph n ả ng. ứ b. Tính t c ố đ t ộ rung bình c a ủ ph n ả ng t ứ heo đ n v ơ m ị ol/h.
c. Tính số mol NH3 và O2 sau 2,5 gi . ờ Câu 6. (2,0 đi m) ể
a. Ban đầu có một mẫu phóng xạ X nguyên chất. T i ạ th i ờ đi m
ể t1 giây thì có 80% mẫu phóng xạ đã bị phân rã. Đ n t ế hời đi m
ể t2 = (t1 + 100) giây thì s h ố ạt nhân X ch a ư b phâ ị n rã còn lại 5% so v i ớ ban đ u. ầ Tính chu kì bán h y c ủ a
ủ hạt nhân nguyên tử X và th i ờ gian t1, t2. M i
ọ thắc mắc vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t (c ế ó đáp án)
b. Tính năng lư ng gi ợ ải phóng (đ n ơ vi J) ng v ứ i ớ 1 nguyên t và ử
1 mol nguyên tử 92U235 theo phản ng ứ sau:
92U235 + 0n1 47La146 + 35Br87 + ? Biết kh i ố lư ng c ợ
ủa 92U235, 0n1, 47La146, 35Br87 lần lượt là 235,044 u; 1,00861 u; 145,943 u; 86,912 u. Năng lư ng t ợ ư ng ơ ng v ứ i
ớ 1u là 931,2 MeV và 1eV = 1,602.10-19J; NA = 6,02.1023. Câu 7. (2,0 đi m)
ể Công đoạn đầu tiên của quá trình sản xuất Silicon có độ tinh khi t ế cao ph c ụ v c ụ ho công ngh bá ệ n dẫn được th c ự hi n b ệ ằng phản ng ứ nh s
ư au: SiO2(s) + 2C(s) Si(s) + 2CO(g)
a. Không cần tính toán, chỉ d a ự vào s hi ự u bi ể t ế v hà ề
m entropy, hãy dự đoán s t ự hay đổi (tăng hay gi m ả ) entropy c a ủ h khi ệ x y ra ả phản ng. ứ o b. Tính S r 298 c a ủ quá trình đi u ề ch S ế ilicon theo ph n ả ng t ứ rên. o
Biết S298 (J.K-1.mol-1): SiO2(s) là 41,8; C(s): là 5,7; Si(s) là 18,8 ; CO(g) là 197,6. o c. Tính giá trị G 298 c a ủ phản ng t ứ rên. o Biết H f
298 (kJ.mol-1) : SiO2(s) là -910,9 ; CO(g) là -110,5. d. Cho biết phản ng ứ trên s x ẽ ảy ra b t ắ đ u t ầ nhi ừ t ệ đ nà ộ o? (Coi s ph ự t ụ hu c ộ c a ủ S và H vào nhi t ệ độ là không đáng kể). Câu 8. (2,0 đi m) ể Hòa tan h t ế 35,1 gam h n h ỗ p M ợ g, Al trong 300 gam dung d c ị h H2SO4 98% thu đư c ợ dung d c ị h X và h n h ỗ p ợ khí Y g m ồ H2S, SO2. Cho Y l i
ộ chậm qua bình đ ng dung d ự c ị h KMnO4 d , t ư hấy
có 9,6 gam kết tủa xuất hi n, l ệ ọc tách k t ế t a ủ , cho nư c ớ l c ọ tác d ng v ụ i ớ dung dịch BaCl2 d t ư hu được 104,85 gam k t ế t a ủ n a ữ . Tính n ng đ ồ ộ % c a ủ H2SO4 trong X và % kh i ố lư ng c ợ a ủ Mg trong h n h ỗ p ợ ban đầu. Câu 9. (2,0 đi m) ể Tính bi n t
ế hiên enthalpy theo các phư ng t ơ rình ph n ả ng ứ sau, bi t ế nhi t ệ sinh c a ủ NH3 bằng -46kJ/mol. N (g) 3H (g) 2NH (g) (1) 2 2 3 1 3 N (g) H (g) NH (g) (2) 2 2 3 2 2 0 0 So sánh H (1) H (2) r 298 và r 298 . Khi t ng h ổ p đ ợ ược 1 tấn NH3 thì nhi t ệ lư ng t ợ a ỏ ra hay thu vào là bao
nhiêu ? Tính theo hai phư ng t ơ rình ph n ả ng ứ trên thì k t ế qu t ả hu đư c ợ gi ng ố nhau hay khác nhau ? Câu 10. (2,0 đi m)
ể Khi đốt cháy vật li u ệ d ở ạng kh i ố r n t ắ hì quá trình x y ra ả t t ừ ừ ; nh ng t ư c ố độ đ t ố cháy s r
ẽ ất nhanh, có thể gây nổ nếu khối vật liệu trên được nghi n t ề hành b t ộ m n và ị phân tán trong không khí dư i ớ dạng b i ụ . M i
ọ thắc mắc vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t (c ế ó đáp án) a. Vì sao có s khá ự c nhau khi cháy vật li u ệ d ở ng kh ạ ối r n và ắ khi x y ra ả hi n t ệ ư ng n ợ ổ b i ụ .
b. Cho một quả cầu nặng 1000 gam đư c ợ làm từ vật li u ệ có kh i ố lư ng ri ợ
êng là 1g/cm3. Khi chế biến trong xư ng s ở n xu ả ất, kh i ố c u t ầ rên được nghi n t ề hành các h t ạ b i ụ hình c u c ầ ó đư ng ờ kính là 0,005 cm. Bằng s s ự o sánh t l ỉ di ệ n ệ tích b m ề ặt c a ủ kh i ố c u và ầ t ng di ổ n t ệ ích b m ề t ặ các h t ạ b i ụ , ch ng m ứ inh s ự khác bi t ệ gi a ữ quá trình cháy c a ủ khối cầu và nổ b i ụ . -------------H T Ế ------------- M i
ọ thắc mắc vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t (c ế ó đáp án) HƯỚNG D N Ẫ GI I Ả Câu 1. (2,0 đi m) ể Chỉ dùng m t
ộ hóa chất duy nhất duy nhất làm thu c ố th , b ử ng ph ằ ư ng phá ơ p hóa h c ọ
hãy nhận biết các dung dịch đ ng t ự rong các lọ riêng bi t
ệ sau: H2SO4, HCl, NaOH, K2SO4. Viết PTHH của các phản ng x ứ ảy ra. Hướng d n ẫ giải Hóa chất được s d ử ng l ụ
à Ba(HCO3)2, cho Ba(HCO3)2 lần lượt vào các dung d c ị h đ ng t ự rong các l . ọ - Dung d c ị h v a ừ tạo k t ế tủa, v a
ừ tạo khí là H2SO4: H2SO4 + Ba(HCO3)2 BaSO4 + 2CO2 + 2H2O. - Dung d c ị h ch c
ỉ ó khí tạo thành là HCl: 2HCl + Ba(HCO3)2 BaCl2 + 2CO2 + 2H2O. - Dung d c ị h có k t ế t a ủ màu trắng xuất hi n ệ là NaOH ho c ặ K2SO4:
2NaOH + Ba(HCO3)2 BaCO3 + Na2CO3 + 2H2O
K2SO4 + Ba(HCO3)2 BaSO4 + 2KHCO3 - Lấy dung d c ị h HCl v a ừ nhận bi t ế được t ở rên cho vào 2 k t ế t a ủ v a ừ t o t ạ hành, k t ế t a ủ nào tan và t o ạ
khí thì đó là BaCO3, qua đó nhận ra đư c ợ dung d c
ị h NaOH, còn lại là dung d c ị h K2SO4
2HCl + BaCO3 BaCl2 + CO2 + H2O
HCl + BaSO4 không phản ng. ứ Câu 2. (2,0 đi m) ể Lập phư ng ơ trình hóa h c ọ c a ủ các ph n ả ng oxi ứ hóa kh s ử au theo phư ng phá ơ p thăng bằng electron:
a. Na2SO3 + NaHSO4 + KMnO4 Na2SO4 + MnSO4 + K2SO4 + ...
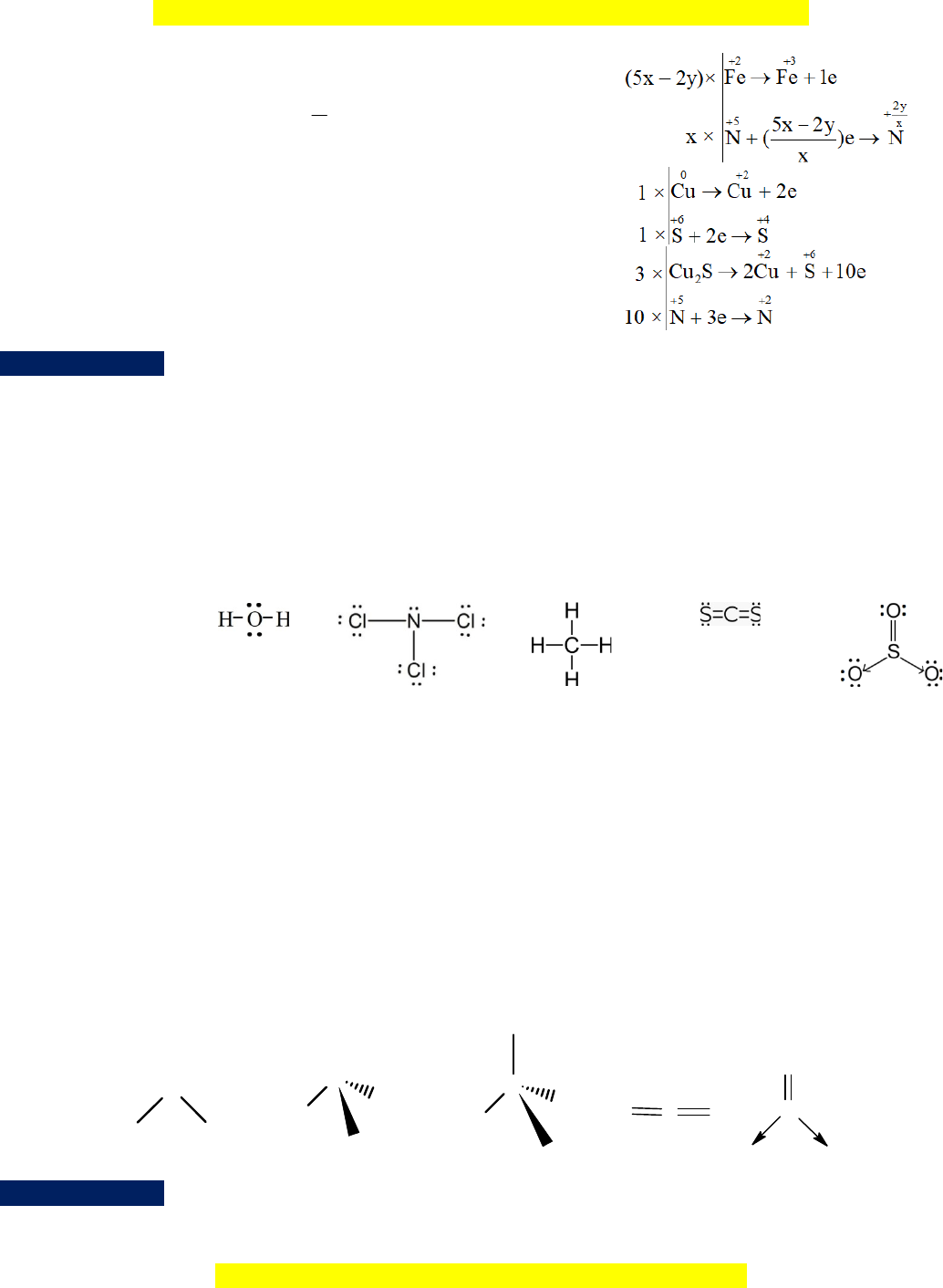
b. FeO + HNO3 Fe(NO3)3 + NxOy + ...
c. Cu + H2SO4 (đặc nóng) ……. + SO2 + H2O
d. Cu2S + HNO3 Cu(NO3)2 + CuSO4 + NO + ... Hướng d n ẫ giải a. 4 7 5Na S O aNaHSO 2K Mn O 2 3 4 4 G i ọ h s ệ c ố ân bằng c a ủ NaHSO4, 6 2 Na ầ ượ
bNa S O 2Mn SO K SO cH O 2 4 4 2 4 2 2SO4, H2O l n l t là a, b, c. Áp Ta có: d ng
ụ bảo toàn nguyên tố cho các ố 4 nguyên t Na, H, S ta có: 7 5Na S O 6NaHSO 2K Mn O 2 3 4 4 Na :10 a 2 b a 6 6 2 H : a 2 c b 8
8Na S O 2Mn SO K SO 3H O 2 4 4 2 4 2 S : 5 a b 2 1 c 3 M i
ọ thắc mắc vui lòng xin liên h h
ệ otline: 084 283 45 85
Đề HSG Hóa 10 Sở Thái Nguyên năm 2023 có đáp án
2.1 K
1.1 K lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Tài liệu được cập nhật liên tục trong gói này từ nay đến hết tháng 3/2024. Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu Đề HSG Hóa 10 Sở Thái Nguyên năm 2023 có đáp án.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(2142 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 10
Xem thêmTài liệu bộ mới nhất

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có đáp án)ả ử ệ ể ế
UBND T NH THÁI NGUYÊNỈ
S GIÁO D C VÀ ĐÀO T OỞ Ụ Ạ
KÌ THI CH N H C SINH GI I T NHỌ Ọ Ỏ Ỉ
L P 10 NĂM H C 202Ớ Ọ 2-2023
MÔN THI: HÓA H CỌ
Th i gian:ờ 150 phút (không k th i gian giao đ )ể ờ ề
(Đ thi có 02 trang, g m 10 câu)ề ồ
Câu 1. (2,0 đi m)ể Ch dùng m t hóa ch t duy nh t duy nh t làm thu c th , b ng ph ng pháp hóa h c ỉ ộ ấ ấ ấ ố ử ằ ươ ọ
hãy nh n bi t các dung d ch đ ng trong các l riêng bi t sau: Hậ ế ị ự ọ ệ
2
SO
4
, HCl, NaOH, K
2
SO
4
. Vi t PTHH c a ế ủ
các ph n ng x y ra.ả ứ ả
Câu 2. (2,0 đi m)ể L p ph ng trình hóa h c c a các ph n ng oxi hóa kh sau theo ph ng pháp thăng ậ ươ ọ ủ ả ứ ử ươ
b ng electron:ằ
a. Na
2
SO
3
+ NaHSO
4
+ KMnO
4
Na
2
SO
4
+ MnSO
4
+ K
2
SO
4
+ ...
b. FeO + HNO
3
Fe(NO
3
)
3
+ N
x
O
y
+ ...
c. Cu + H
2
SO
4 (đ c nóng)ặ
……. + SO
2
+ H
2
O
d. Cu
2
S + HNO
3
Cu(NO
3
)
2
+ CuSO
4
+ NO + ...
Câu 3. (2,0 đi m)ể Cho các phân t Hử
2
O, NCl
3
, CH
4
, CS
2
, SO
3
.
a. Vi t công th c Lewis c a các phân t trên và cho bi t nguyên t trung tâm trong m i phân t tr ng ế ứ ủ ử ế ử ỗ ử ở ạ
thái lai hóa nào?
b. Phân t nào phân c c, phân t nào không phân c c? Vì sao?ử ự ử ự
Câu 4. (2,0 đi m)ể Cho X, Y, Z là bao nguyên t hóa h c. T ng s h t mang đi n trong ba phân t Xố ọ ổ ố ạ ệ ử
2
Y,
ZY
2
, X
2
Z là 200. S h t mang đi n c a phân t Xố ạ ệ ủ ử
2
Y b ng 15/16 l n s h t mang đi n c a phân t ZYằ ầ ố ạ ệ ủ ử
2
. Ở
tr ng thái c b n, nguyên t Z có s electron trên phân l p p b ng 1,667 l n s electron trên phân l p s. ạ ơ ả ử ố ớ ằ ầ ố ớ
Phân t T g m 6 nguyên t t o b i 3 nguyên t X, Y, Z. Xác đ nh công th c phân t c a T.ử ồ ử ạ ở ố ị ứ ử ủ
Câu 5. (2,0 đi m)ể Trong quá trình t ng h p nitric acid, giai đo n đ t cháy NHổ ợ ạ ố
3
b ng Oằ
2
có xúc tác x y ra ả
ph n ng trong pha khí nh sau: 4NHả ứ ư
3
(g) + 5O
2
(g) 4NO(g) + 6H
2
O(g). Trong m t thí nghi m, cho vào ộ ệ
bình ph n ng (bình kín) 619,75 mL khí NHả ứ
3
và 743,7 mL khí O
2
(có xúc tác, các th tích khí đo đkc). ể ở
Sau khi th c hi n ph n ng 2,5 gi , th y có 0,432 gam n c đ c t o thành.ự ệ ả ứ ờ ấ ướ ượ ạ
a. Vi t bi u th c tính t c đ trung bình c a ph n ng theo ch t tham gia và ch t t o thành trong ph n ế ể ứ ố ộ ủ ả ứ ấ ấ ạ ả
ng.ứ
b. Tính t c đ trung bình c a ph n ng theo đ n v mol/h.ố ộ ủ ả ứ ơ ị
c. Tính s mol NHố
3
và O
2
sau 2,5 gi .ờ
Câu 6. (2,0 đi m) ể
a. Ban đ u có m t m u phóng x X nguyên ch t. T i th i đi m tầ ộ ẫ ạ ấ ạ ờ ể
1
giây thì có 80% m u phóng x đã b ẫ ạ ị
phân rã. Đ n th i đi m tế ờ ể
2
= (t
1
+ 100) giây thì s h t nhân X ch a b phân rã còn l i 5% so v i ban đ u. ố ạ ư ị ạ ớ ầ
Tính chu kì bán h y c a h t nhân nguyên t X và th i gian tủ ủ ạ ử ờ
1
, t
2
.
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có đáp án)ả ử ệ ể ế
b. Tính năng l ng gi i phóng (đ n vi J) ng v i 1 nguyên t và 1 mol nguyên t ượ ả ơ ứ ớ ử ử
92
U
235
theo ph n ng ả ứ
sau:
92
U
235
+
0
n
1
47
La
146
+
35
Br
87
+ ?
Bi t kh i l ng c a ế ố ượ ủ
92
U
235
,
0
n
1
,
47
La
146
,
35
Br
87
l n l t là 235,044 u; 1,00861 u; 145,943 u; 86,912 u. Năng ầ ượ
l ng t ng ng v i 1u là 931,2 MeV và 1eV = 1,602.10ượ ươ ứ ớ
-19
J; N
A
= 6,02.10
23
.
Câu 7. (2,0 đi m)ể Công đo n đ u tiên c a quá trình s n xu t Silicon có đ tinh khi t cao ph c v cho ạ ầ ủ ả ấ ộ ế ụ ụ
công ngh bán d n đ c th c hi n b ng ph n ng nh sau: SiOệ ẫ ượ ự ệ ằ ả ứ ư
2
(s) + 2C(s) Si(s) + 2CO(g)
a. Không c n tính toán, ch d a vào s hi u bi t v hàm entropy, hãy d đoán s thay đ i (tăng hay gi m)ầ ỉ ự ự ể ế ề ự ự ổ ả
entropy c a h khi x y ra ph n ng.ủ ệ ả ả ứ
b. Tính
o
r 298
S
c a quá trình đi u ch Silicon theo ph n ng trên.ủ ề ế ả ứ
Bi t ế
o
298
S
(J.K
-1
.mol
-1
): SiO
2
(s) là 41,8; C(s): là 5,7; Si(s) là 18,8 ; CO(g) là 197,6.
c. Tính giá tr ị
o
298
G
c a ph n ng trên.ủ ả ứ
Bi tế
o
f 298
H
(kJ.mol
-1
) : SiO
2
(s) là -910,9 ; CO(g) là -110,5.
d. Cho bi t ph n ng trên s x y ra b t đ u t nhi t đ nào? (Coi s ph thu c c a ế ả ứ ẽ ả ắ ầ ừ ệ ộ ự ụ ộ ủ S và H vào nhi t ệ
đ là không đáng k ).ộ ể
Câu 8. (2,0 đi m)ể Hòa tan h t 35,1 gam h n h p Mg, Al trong 300 gam dung d ch Hế ỗ ợ ị
2
SO
4
98% thu đ c ượ
dung d ch X và h n h p khí Y g m Hị ỗ ợ ồ
2
S, SO
2
. Cho Y l i ch m qua bình đ ng dung d ch KMnOộ ậ ự ị
4
d , th y ư ấ
có 9,6 gam k t t a xu t hi n, l c tách k t t a, cho n c l c tác d ng v i dung d ch BaClế ủ ấ ệ ọ ế ủ ướ ọ ụ ớ ị
2
d thu đ c ư ượ
104,85 gam k t t a n a. Tính n ng đ % c a Hế ủ ữ ồ ộ ủ
2
SO
4
trong X và % kh i l ng c a Mg trong h n h p ban ố ượ ủ ỗ ợ
đ u.ầ
Câu 9. (2,0 đi m)ể Tính bi n thiên enthalpy theo các ph ng trình ph n ng sau, bi t nhi t sinh c a NHế ươ ả ứ ế ệ ủ
3
b ng -46kJ/mol. ằ
2 2 3
2 2 3
N (g) 3H (g) 2NH (g) (1)
1 3
N (g) H (g) NH (g) (2)
2 2
So sánh
0
r 298
H (1)
và
0
r 298
H (2)
. Khi t ng h p đ c 1 t n NHổ ợ ượ ấ
3
thì nhi t l ng t a ra hay thu vào là bao ệ ượ ỏ
nhiêu ? Tính theo hai ph ng trình ph n ng trên thì k t qu thu đ c gi ng nhau hay khác nhauươ ả ứ ế ả ượ ố ?
Câu 10. (2,0 đi m)ể Khi đ t cháy v t li u d ng kh i r n thì quá trình x y ra t tố ậ ệ ở ạ ố ắ ả ừ ừ ; nh ng t c đ đ t ư ố ộ ố
cháy s r t nhanh, có th gây n n u kh i v t li u trên đ c nghi n thành b t m n và phân tán trong ẽ ấ ể ổ ế ố ậ ệ ượ ề ộ ị
không khí d i d ng b i.ướ ạ ụ
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có đáp án)ả ử ệ ể ế
a. Vì sao có s khác nhau khi cháy v t li u d ng kh i r n và khi x y ra hi n t ng n b i.ự ậ ệ ở ạ ố ắ ả ệ ượ ổ ụ
b. Cho m t qu c u n ng 1000 gam đ c làm t v t li u có kh i l ng riêng là 1g/cmộ ả ầ ặ ượ ừ ậ ệ ố ượ
3
. Khi ch bi n ế ế
trong x ng s n xu t, kh i c u trên đ c nghi n thành các h t b i hình c u có đ ng kính là 0,005 cm. ưở ả ấ ố ầ ượ ề ạ ụ ầ ườ
B ng s so sánh t l di n tích b m t c a kh i c u và t ng di n tích b m t các h t b i, ch ng minh s ằ ự ỉ ệ ệ ề ặ ủ ố ầ ổ ệ ề ặ ạ ụ ứ ự
khác bi t gi a quá trình cháy c a kh i c u và n b i.ệ ữ ủ ố ầ ổ ụ
-------------H T-------------Ế
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ
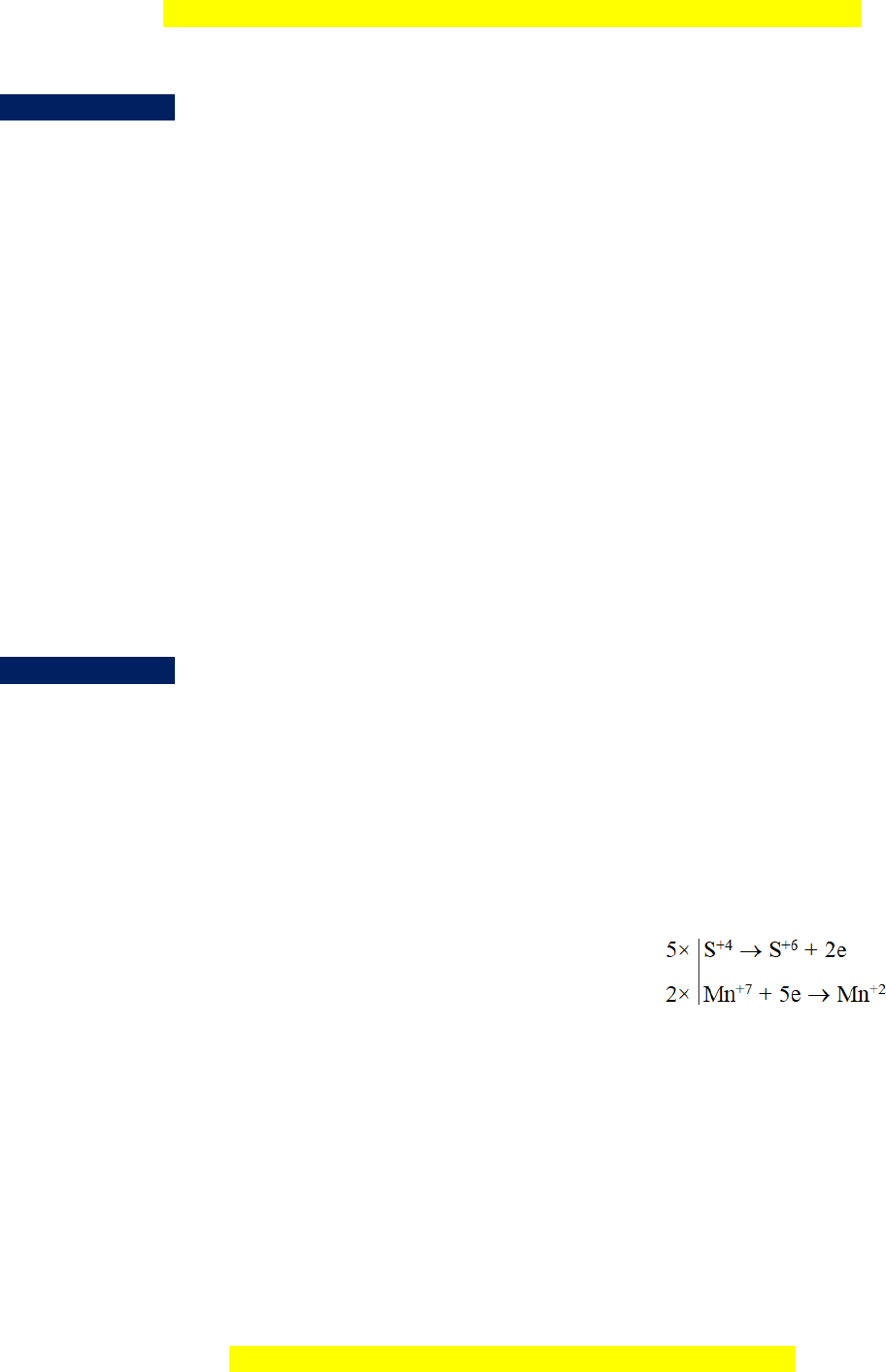
Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có đáp án)ả ử ệ ể ế
H NG D N GI IƯỚ Ẫ Ả
Câu 1. (2,0 đi m)ể Ch dùng m t hóa ch t duy nh t duy nh t làm thu c th , b ng ph ng pháp hóa h c ỉ ộ ấ ấ ấ ố ử ằ ươ ọ
hãy nh n bi t các dung d ch đ ng trong các l riêng bi t sau: Hậ ế ị ự ọ ệ
2
SO
4
, HCl, NaOH, K
2
SO
4
. Vi t PTHH c a ế ủ
các ph n ng x y ra.ả ứ ả
H ng d n gi iướ ẫ ả
Hóa ch t đ c s d ng là Ba(HCOấ ượ ử ụ
3
)
2
, cho Ba(HCO
3
)
2
l n l t vào các dung d ch đ ng trong các l .ầ ượ ị ự ọ
- Dung d ch v a t o k t t a, v a t o khí là Hị ừ ạ ế ủ ừ ạ
2
SO
4
: H
2
SO
4
+ Ba(HCO
3
)
2
BaSO
4
+ 2CO
2
+ 2H
2
O.
- Dung d ch ch có khí t o thành là HCl: 2HCl + Ba(HCOị ỉ ạ
3
)
2
BaCl
2
+ 2CO
2
+ 2H
2
O.
- Dung d ch có k t t a màu tr ng xu t hi n là NaOH ho c Kị ế ủ ắ ấ ệ ặ
2
SO
4
:
2NaOH + Ba(HCO
3
)
2
BaCO
3
+ Na
2
CO
3
+ 2H
2
O
K
2
SO
4
+ Ba(HCO
3
)
2
BaSO
4
+ 2KHCO
3
- L y dung d ch HCl v a nh n bi t đ c trên cho vào 2 k t t a v a t o thành, k t t a nào tan và t o ấ ị ừ ậ ế ượ ở ế ủ ừ ạ ế ủ ạ
khí thì đó là BaCO
3
, qua đó nh n ra đ c dung d ch NaOH, còn l i là dung d ch Kậ ượ ị ạ ị
2
SO
4
2HCl + BaCO
3
BaCl
2
+ CO
2
+ H
2
O
HCl + BaSO
4
không ph n ng.ả ứ
Câu 2. (2,0 đi m)ể L p ph ng trình hóa h c c a các ph n ng oxi hóa kh sau theo ph ng pháp thăng ậ ươ ọ ủ ả ứ ử ươ
b ng electron:ằ
a. Na
2
SO
3
+ NaHSO
4
+ KMnO
4
Na
2
SO
4
+ MnSO
4
+ K
2
SO
4
+ ...
b. FeO + HNO
3
Fe(NO
3
)
3
+ N
x
O
y
+ ...
c. Cu + H
2
SO
4 (đ c nóng)ặ
……. + SO
2
+ H
2
O
d. Cu
2
S + HNO
3
Cu(NO
3
)
2
+ CuSO
4
+ NO + ...
H ng d n gi iướ ẫ ả
a.
4 7
2 3 4 4
5Na S O aNaHSO 2K Mn O
6 2
2 4 4 2 4 2
bNa S O 2Mn SO K SO cH O
Ta có:
4 7
2 3 4 4
5Na S O 6NaHSO 2K Mn O
6 2
2 4 4 2 4 2
8Na S O 2MnSO K SO 3H O
G i h s cân b ng c a NaHSOọ ệ ố ằ ủ
4
,
Na
2
SO
4
, H
2
O l n l t là a, b, c. Áp ầ ượ
d ng b o toàn nguyên t cho các ụ ả ố
nguyên t Na, H, S ta có:ố
Na :10 a 2b a 6
H : a 2c b 8
S:5 a b 2 1 c 3
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ
Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có đáp án)ả ử ệ ể ế
b.
2 5
3
2y
3
x
x
3 y 2
3
(5x 2y) FeO (16x 6y )H N O
(5x 2y) Fe NO N O (8x 3y )H O
c.
0 6 2 4
2 4 nóng) 4 2( 2
Cu 2H S O CuSO S O 2H O
ñaëc
d.
}
0
5
2 3
2 2 6 2
3 4 2
2
3Cu S 16H NO
3Cu NO 3Cu S O 10N O 8H O
Câu 3. (2,0 đi m)ể Cho các phân t Hử
2
O, NCl
3
, CH
4
, CS
2
, SO
3
.
a. Vi t công th c Lewis c a các phân t trên và cho bi t nguyên t trung tâm trong m i phân t tr ng ế ứ ủ ử ế ử ỗ ử ở ạ
thái lai hóa nào?
b. Phân t nào phân c c, phân t nào không phân c c? ử ự ử ự Vì sao?
H ng d n gi iướ ẫ ả
a.
Phân tử H
2
O NCl
3
CH
4
CS
2
SO
3
Công th c Lewisứ
Tr ng thái lai hóaạ
c a nguyên tủ ử
trung tâm
O tr ngở ạ
thái lai hóa
sp
3
N tr ng thái ở ạ
lai hóa sp
3
C tr ng tháiở ạ
lai hóa sp
3
O tr ng tháiở ạ
lai hóa sp
S tr ng tháiở ạ
lai hóa sp
2
b. * Phân t n c có c u t o góc c p electron chung l ch v phía nguyên t O có đ âm đi n l n h n, ử ướ ấ ạ ặ ệ ề ử ộ ệ ớ ơ
phân t n c phân c c.ử ướ ự
* Phân t NClử
3
có c u t o chóp đáy tam giác, c u t o không đ i x ng, phân t NClấ ạ ấ ạ ố ứ ử
3
phân c c.ự
* Phân t CHử
4
có c u t o t di n đ u, c u t o đ i x ng, phân t CHấ ạ ứ ệ ề ấ ạ ố ứ ử
4
không phân c c.ự
* Phân t CSử
2
có c u t o th ng, c u t o đ i x ng, phân t CSấ ạ ẳ ấ ạ ố ứ ử
2
không phân c c.ự
* Phân t SOử
3
có c u t o tam giác đ u, c u t o đ i x ng, phân t SOấ ạ ề ấ ạ ố ứ ử
3
không phân c c.ự
N
Cl
Cl
Cl
O
H H
C
H
H
H
H
S
O
O
O
C S
S
Câu 4. (2,0 đi m)ể Cho X, Y, Z là bao nguyên t hóa h c. T ng s h t mang đi n trong ba phân t Xố ọ ổ ố ạ ệ ử
2
Y,
ZY
2
, X
2
Z là 200. S h t mang đi n c a phân t Xố ạ ệ ủ ử
2
Y b ng 15/16 l n s h t mang đi n c a phân t ZYằ ầ ố ạ ệ ủ ử
2
. Ở
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ























