Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có đáp án) TRƯỜNG THPT CHUYÊN Đ Ề THI H C Ọ SINH GI I Ỏ C P Ấ TRƯ NG Ờ NGUY N Ễ B N Ỉ H KHIÊM NĂM H C Ọ 2022 – 2023 Môn: HÓA H C Ọ 10 ĐỀ CHÍNH TH C Ứ Th i
ờ gian làm bài: 150 phút (không k t ể h i ờ gian giao đ ) ề (Đề có 3 trang) Cho biết: - Nguyên t ử kh i
ố : H=1;N=14;O=16;Cl=35,5;K=39;Ca=40;Mn=55;Ag=108 - Số hi u ệ nguyên t :
ử ZB=5;ZC=6;ZN=7;ZO=8;ZF=9;ZNa=11;ZMg=12;ZAl=13;ZSi=14;ZP=15;ZS=16;ZCl=17;ZBr=35;
ZI=53;ZRn=86;ZFr=87;ZAc=89;ZTh=90;ZPa=91
Câu I (4 đi m) ể
1. Phân tử XY2 có t ng ổ số h t
ạ proton, neutron, electron là 114, trong đó số h t ạ mang đi n ệ nhi u ề h n ơ số h t ạ không mang đi n ệ 38 h t ạ . Số kh i ố c a ủ nguyên tử Y l n ớ h n ơ số kh i ố c a ủ nguyên tử X là 20. T ng ổ số h t
ạ proton, neutron, electron c a ủ nguyên t ử X ít h n ơ nguyên t ử Y là 30 hạt. a) Xác đ nh ị tên nguyên t ố X và Y ? b) Xác đ nh ị v ị trí c a ủ X và Y trong b ng ả tu n ầ hoàn các nguyên t ố hóa h c ọ ?
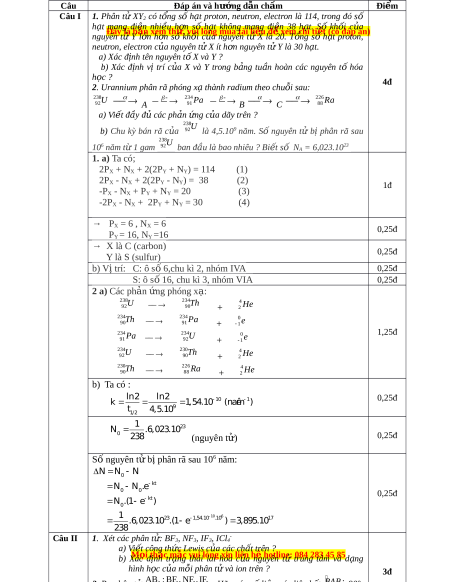
2. Urannium phân rã phóng x ạ thành radium theo chu i ỗ sau: 23 U 8 234 226 Ra 92
A Pa 91 B C 88 a) Vi t ế đ y ầ đ ủ các ph n ả ng ứ c a ủ dãy trên ? 238 238 b) Chu kỳ bán rã c a ủ U U 92
là 4,5.109 năm. Số nguyên t
ử b ịphân rã sau 106 năm t ừ 1 gam 92
ban đầu là bao nhiêu ? Bi t ế s ố NA = 6,023.1023
Câu II (3 đi m) ể 1. Xét các phân t : ử BF - 3, NF3, IF3, ICl4 a) Vi t ế công th c ứ Lewis c a ủ các ch t ấ trên ? b) Xác đ nh ị tr ng ạ thái lai hóa c a ủ nguyên t ử trung tâm và d ng ạ hình h c ọ c a ủ m i ỗ phân tử và ion trên ?
2. Ba phân tử AB : BF , NF , IF 3 3 3 3 . Hãy gán s ố li u ệ góc liên k t
ế BAB : 90°; 107° và 120° phù h p ợ v i ớ ba phân t ử đã cho. Gi i ả thích ?
Câu III (4 đi m) ể 1. Cho ph n ả ng ứ sau v i ớ các d ữ ki n ệ nhi t ệ đ ng ộ c a ủ các ch t ấ ở 250C: CO2 + H2 CO + H2O CO2 H2 CO H2O fH0298 (kJ.mol-1) -393,5 0 -110,5 -241,8 S0298 (J.mol-1.K-1) 213,6 131,0 197,9 188,7
a) Hãy tính rH0298 , rS0298 và rG0298 và cho bi t ế ph n ả ng ứ có t ự x y ả ra theo chi u ề thu n ậ ở 250C hay không? b) Giả sử rH c a ủ ph n ả ng ứ không thay đ i ổ theo nhi t ệ đ . ộ Hãy tính rG c a ủ phản ng ứ thuận ở 10000C và nh n ậ xét v ề chi u ề ph n ả ng ứ ? M i
ọ thắc mắc vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có đáp án) c) Hãy xác đ nh ị nhi t ệ độ (0C) để ph n ả ng ứ thu n ậ b t ắ đ u ầ x y ả ra ( giả s ử b ỏ qua s ự bi n ế đổi rH0, rS0 theo nhi t ệ đ ) ộ . 2. Thi t
ế lập chu trình Born - Haber để tính năng lư ng ợ mạng lư i ớ ion c a ủ CaCl2 từ các dữ kiện th c ự nghi m ệ sau: Nhi t ệ t o ạ thành ở đi u ề ki n ệ chu n ẩ c a ủ CaCl2: -795 kJ.mol-1 0 1 Nhi t ệ nguyên t
ử hóa Ca (s) → Ca (g): ΔH 1 92kJ.mol Năng lư ng ợ
ion hóa Ca: I1 + I2 = 1745 kJ.mol-1. Năng lư ng ợ liên k t
ế Cl - Cl trong Cl2: 243 kJ.mol-1. Ái l c ự electron c a ủ Cl: -364 kJ.mol-1
Câu IV (3 đi m) ể 1. Lập phư ng ơ trình hóa h c ọ c a ủ các ph n ả ng ứ sau:
a) FeSO4 + KMnO4 + KHSO4 → Fe2(SO4)3 + K2SO4 + MnSO4 + H2O
b) FexOy + HNO3 Fe(NO3)3 + NO2 + H2O
c) Cr2S3 + Mn(NO3)2 + K2CO3 → K2CrO4 + K2SO4 + K2MnO4 + NO + CO2 2. Ngư i ờ ta l p ậ m t ộ pin đi n ệ hóa g m ồ hai đi n ệ c c
ự : Zn/Zn(NO3)2 0,1M và Ag/AgNO3 0,1M Eo o =−0 ,76 V E =+0,80V có thế đi n ệ c c ự chu n ẩ tư ng ơ ng ứ là Zn2+/Zn và Ag+/ Ag . a) Thi t ế lập s ơ đồ pin. b) Vi t ế phư ng ơ trình phản ng ứ khi pin làm vi c ệ . c) Tính su t ấ đi n ệ đ ng ộ c a ủ pin. d) Tính nồng đ ộ các ion trong dung d c ị h khi pin ng ng ừ ho t ạ đ ng. ộ Câu V (3 đi m) ể 1. Xét phản ng ứ sau: HI + C2H5I C2H6 + I2 Th c ự hi n ệ ph n ả ng ứ v i ớ n ng ồ độ đ u ầ khác nhau và đo t c ố đ ộ ph n ả ng ứ tư ng ơ ng ứ thu đư c ợ k t ế quả trong bảng sau: Nồng độ C
Tốc độ phản ứng (mol.L-1.s- Thí nghi m ệ Nồng độ HI (M) 2H5I (M) 1) 1 0,010 0,010 1,2.10-5 2 0,010 0,020 2,4.10-5 3 0,020 0,020 4,8.10-5 a) Vi t ế bi u ể th c ứ tính t c ố đ ộ ph n ả ng ứ và tính h ng ằ s ố t c ố đ ộ ph n ả ng ứ ? b) Cho bi t ế n ng ồ đ ộ ban đ u ầ c a
ủ HI và C2H5I bằng nhau và b ng ằ 0,1M. Tính th i ờ gian để C C 0 ,05M HI C H I 2 5 ? 2. Cho ph n ả ng ứ x y
ả ra ở T (K): 2N2O5(k)
4NO2 (k) + O2(k) lần lư t ợ có các thí nghi m ệ sau M i
ọ thắc mắc vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có đáp án) Thí nghi m ệ Nồng đ ộ ban đầu c a ủ N -1 2O5 mol/lit T c ố đ ộ phân h y ủ mol.L TN1 0,17 1,39.10-3 TN2 0,34 2,78.10-3 TN3 0,68 5,56.10-3 Năng lư ng ợ ho t ạ hóa E -1 a c a ủ ph n ả ng
ứ là 24,74 kcal.mol , hằng số t c ố độ ph n ả ng ứ ở
298K bằng 2,03.10-3 s-1. Tính nhi t ệ đ ộ T(K) c a ủ ph n ả ng ứ đã ti n ế hành ?
3. Phản ứng oxi hoá ion I- bằng ClO- trong môi trư ng ờ ki m ề di n ễ ra theo phư ng ơ trình: ClO- + I- → Cl- + IO- (a) và tuân theo đ nh ị lu t ậ t c ố đ ộ th c ự nghi m ệ v = k[ClO-][I-][OH-]-1. Cho r ng ằ ph n ả ng ứ (a) x y ả ra theo c ơ ch : ế ClO- + H 2O HClO + OH- nhanh; I- + HClO → HIO + Cl- ch m; ậ
OH- + HIO → H2O + IO- nhanh. C ơ ch ế trên có phù h p ợ v i ớ th c ự nghi m ệ đ ng ộ h c ọ hay không?
Câu VI (3 đi m) ể 1. Vi t ế phư ng ơ trình hóa h c ọ c a ủ các ph n ả ng ứ xảy ra trong các trư ng ờ h p ợ sau (n u ế có):
a) Sục khí Cl2 vào dung dịch FeBr2.
b) Ion I trong KI bị oxi hóa thành I2 b i ở FeCl3 c) Cho nư c ớ clo qua dung d c ị h KI d . ư d) S c ụ khí clo t ừ t ừ đ n ế d ư vào dung d c ị h KBr.
2. Hòa tan m gam KMnO4 trong dung dịch HCl đ c ặ d ư đư c ợ dung d c
ị h A và V lít khí D (đktc). Pha loãng dung d c ị h A đư c ợ 500 ml dung d c ị h B.
- Để trung hòa axit dư trong 50 ml dung d c ị h B c n ầ dùng v a ừ đủ 24 ml dung d c ị h NaOH 0,5 M. - Thêm AgNO3 d ư vào 100 ml dung d c ị h B đ ể k t ế t a
ủ hoàn toàn ion clorua thu đư c ợ 17,22 gam k t ế t a ủ .
a) Tính nồng độ mol/lít các ch t ấ tan trong B ? b) Tính m, V và th ể tích dung d c
ị h HCl 36,5% (D = 1,18 g/ml) đã dùng ? ----- HẾT ----- Cán b c
ộ oi thi không giải thích gì thêm.
Thí sinh không đư c ợ s d ử ng b ụ ng t ả u n hoàn. ầ M i
ọ thắc mắc vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có đáp án) TRƯỜNG THPT CHUYÊN Đ Ề THI H C Ọ SINH GI I Ỏ C P Ấ TRƯ NG Ờ NGUY N Ễ B N Ỉ H KHIÊM NĂM H C Ọ 2022 – 2023 Môn: HÓA H C Ọ 10 ĐÁP ÁN M i
ọ thắc mắc vui lòng xin liên h h
ệ otline: 084 283 45 85
Đề HSG Hóa 10 Trường THPT Nguyễn Bỉnh Khiêm năm 2023 có đáp án
1.1 K
540 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Tài liệu được cập nhật liên tục trong gói này từ nay đến hết tháng 3/2024. Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu Đề HSG Hóa 10 Trường THPT Nguyễn Bỉnh Khiêm năm 2023 có đáp án.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(1079 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 10
Xem thêmTài liệu bộ mới nhất

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có đáp án)ả ử ệ ể ế
TR NG THPT CHUYÊNƯỜ Đ THI H C SINH GI I C P TR NGỀ Ọ Ỏ Ấ ƯỜ
NGUY N B NH KHIÊMỄ Ỉ NĂM H C 2022 – 2023Ọ
Môn: HÓA H C 10Ọ
Đ CHÍNH TH CỀ Ứ Th i gian làm bài: 150 phút (không k th i gian giao đ )ờ ể ờ ề
(Đ có 3 trangề )
Cho bi t: ế
- Nguyên t kh i: H=1;N=14;O=16;Cl=35,5;K=39;Ca=40;Mn=55;Ag=108ử ố
- S hi u nguyên t : Zố ệ ử
B
=5;Z
C
=6;Z
N
=7;Z
O
=8;Z
F
=9;Z
Na
=11;Z
Mg
=12;Z
Al
=13;Z
Si
=14;Z
P
=15;Z
S=16
;Z
Cl
=17;Z
Br
=35;
Z
I
=53;Z
Rn
=86;Z
Fr
=87;Z
Ac
=89;Z
Th
=90;Z
Pa
=91
Câu I (4 đi m)ể
1. Phân t XYử
2
có t ng s h t proton, neutron, electron là 114, trong đó s h t mang đi nổ ố ạ ố ạ ệ
nhi u h n s h t không mang đi n 38 h t. S kh i c a nguyên t Y l n h n s kh i c aề ơ ố ạ ệ ạ ố ố ủ ử ớ ơ ố ố ủ
nguyên t X là 20. T ng s h t proton, neutron, electron c a nguyên t X ít h n nguyên t Yử ổ ố ạ ủ ử ơ ử
là 30 h t. ạ
a) Xác đ nh tên nguyên t X và Y ?ị ố
b) Xác đ nh v trí c a X và Y trong b ng tu n hoàn các nguyên t hóa h c ?ị ị ủ ả ầ ố ọ
2. Urannium phân rã phóng x thành radium theo chu i sau: ạ ỗ
U
238
92
A
Pa
234
91
B
C
Ra
226
88
a) Vi t đ y đ các ph n ng c a dãy trên ?ế ầ ủ ả ứ ủ
b) Chu kỳ bán rã c a ủ
U
238
92
là 4,5.10
9
năm. S nguyên t b phân rã sau 10ố ử ị
6
năm t 1 gam ừ
U
238
92
ban đ u là bao nhiêu ? Bi t s ầ ế ố N
A
= 6,023.10
23
Câu II (3 đi m)ể
1. Xét các phân t : BFử
3
, NF
3
, IF
3
, ICl
4
-
a) Vi t công th c Lewis c a các ch t trên ?ế ứ ủ ấ
b) Xác đ nh tr ng thái lai hóa c a nguyên t trung tâm và d ng hình h c c a m i phânị ạ ủ ử ạ ọ ủ ỗ
t và ion trên ?ử
2. Ba phân t ử
3 3 3 3
AB : BF , NF ,IF
. Hãy gán s li u gócố ệ liên k t ế
:BAB
90°; 107° và 120° phù h pợ
v i ba phân t đã cho. Gi i thích ?ớ ử ả
Câu III (4 đi m)ể
1. Cho ph n ng sau v i các d ki n nhi t đ ng c a các ch t 25ả ứ ớ ữ ệ ệ ộ ủ ấ ở
0
C:
CO
2
+ H
2
CO + H
2
O
CO
2
H
2
CO H
2
O
f
H
0
298
(kJ.mol
-1
)
S
0
298
(J.mol
-1
.K
-1
)
-393,5
213,6
0
131,0
-110,5
197,9
-241,8
188,7
a) Hãy tính
r
H
0
298
,
r
S
0
298
và
r
G
0
298
và cho bi t ph n ng có t x y ra theo chi u thu n ế ả ứ ự ả ề ậ ở
25
0
C
hay không?
b) Gi s ả ử
r
H c a ph n ng không thay đ i theo nhi t đ . Hãy tính ủ ả ứ ổ ệ ộ
r
G
c a ph n ngủ ả ứ
thu n ậ ở
1000
0
C và nh n xét v chi u ph n ng ?ậ ề ề ả ứ
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có đáp án)ả ử ệ ể ế
c) Hãy xác đ nh nhi t đ (ị ệ ộ
0
C) đ ph n ng thu n b t đ u x y ra ( gi s b qua s bi nể ả ứ ậ ắ ầ ả ả ử ỏ ự ế
đ i ổ
r
H
0
,
r
S
0
theo nhi t đ ).ệ ộ
2. Thi t l p chu trình Born - Haber đ tính năng lế ậ ể ư ng m ng l i ion c a Caợ ạ ướ ủ Cl
2
từ các dữ
ki n th c nghi m sau:ệ ự ệ
Nhi t t o thành đi u ki n chu n c a CaClệ ạ ở ề ệ ẩ ủ
2
: -795 kJ.mol
-1
Nhi t nguyên t hóa Ca (s) → Ca (g): ệ ử
0 1
ΔH 192kJ.mol
Năng l ng ion hóa Ca: Iượ
1
+ I
2
= 1745 kJ.mol
-1
.
Năng l ng liên k t Cl - Cl trong Clượ ế
2
: 243 kJ.mol
-1
.
Ái l c electron c a Cl:ự ủ -364 kJ.mol
-1
Câu IV (3 đi m)ể
1. L p ph ng trình hóa h c c a các ph n ng sau: ậ ươ ọ ủ ả ứ
a) FeSO
4
+ KMnO
4
+ KHSO
4
→ Fe
2
(SO
4
)
3
+ K
2
SO
4
+ MnSO
4
+ H
2
O
b) Fe
x
O
y
+ HNO
3
Fe(NO
3
)
3
+ NO
2
+ H
2
O
c) Cr
2
S
3
+ Mn(NO
3
)
2
+ K
2
CO
3
→ K
2
CrO
4
+ K
2
SO
4
+ K
2
MnO
4
+ NO + CO
2
2. Ng i ta l p m t pin đi n hóa g m hai đi n c c: Zn/Zn(NOườ ậ ộ ệ ồ ệ ự
3
)
2
0,1M và Ag/AgNO
3
0,1M
có th đi n c c chu n t ng ng là ế ệ ự ẩ ươ ứ
E
Zn
2 +
/Zn
o
=−0 ,76V
và
E
Ag
+
/ Ag
o
=+0, 80V
.
a) Thi t l p s đ pin.ế ậ ơ ồ
b) Vi t ph ng trình ph n ng khi pin làm vi c.ế ươ ả ứ ệ
c) Tính su t đi n đ ng c a pin.ấ ệ ộ ủ
d) Tính n ng đ các ion trong dung d ch khi pin ng ng ho t đ ng.ồ ộ ị ừ ạ ộ
Câu V (3 đi m)ể
1. Xét ph n ng sau: ả ứ
HI + C
2
H
5
I C
2
H
6
+ I
2
Th c hi n ph n ng v i n ng đ đ u khác nhau và đo t c đ ph n ng t ng ng thuự ệ ả ứ ớ ồ ộ ầ ố ộ ả ứ ươ ứ
đ c k t ượ ế
qu trong b ng sau:ả ả
Thí nghi mệ N ng đ HI (M)ồ ộ
N ng đ Cồ ộ
2
H
5
I
(M)
T c đ ph n ng (mol.Lố ộ ả ứ
-1
.s
-
1
)
1 0,010 0,010 1,2.10
-5
2 0,010 0,020 2,4.10
-5
3 0,020 0,020 4,8.10
-5
a) Vi t bi u th c tính t c đ ph n ng và tính h ng s t c đ ph n ng ?ế ể ứ ố ộ ả ứ ằ ố ố ộ ả ứ
b) Cho bi t n ng đ ban đ u c a HI và Cế ồ ộ ầ ủ
2
H
5
I b ng nhau và b ng 0,1M. Tính th i gian đằ ằ ờ ể
2 5
HI C H I
C C 0,05M
?
2. Cho ph n ng x y ra T (K): 2Nả ứ ả ở
2
O
5(k)
4NO
2 (k)
+ O
2(k)
l n l t có các thí nghi mầ ượ ệ
sau
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có đáp án)ả ử ệ ể ế
Thí nghi mệ N ng đ ban đ u c a Nồ ộ ầ ủ
2
O
5
mol/lit T c đ phân h y mol.Lố ộ ủ
-1
TN1 0,17 1,39.10
-3
TN2 0,34 2,78.10
-3
TN3 0,68 5,56.10
-3
Năng l ng ho t hóa Eượ ạ
a
c a ph n ng là 24,74 kcal.molủ ả ứ
-1
, h ng s t c đ ph n ng ằ ố ố ộ ả ứ ở
298K b ng 2,03.10ằ
-3
s
-1
. Tính nhi t đ T(K) c a ph n ng đã ti n hành ?ệ ộ ủ ả ứ ế
3. Ph n ng oxi hoá ion Iả ứ
-
b ng ClOằ
-
trong môi tr ng ki m di n ra theo ph ng trình:ườ ề ễ ươ
ClO
-
+ I
-
→ Cl
-
+ IO
-
(a)
và tuân theo đ nh lu t t c đ th c nghi m v = k[ClOị ậ ố ộ ự ệ
-
][I
-
][OH
-
]
-1
.
Cho r ng ph n ng (a) x y ra theo c ch : ằ ả ứ ả ơ ế
ClO
-
+ H
2
O
HClO + OH
-
nhanh;
I
-
+ HClO → HIO + Cl
-
ch m;ậ
OH
-
+ HIO → H
2
O + IO
-
nhanh.
C ch trên có phù h p v i th c nghi m đ ng h c hay không?ơ ế ợ ớ ự ệ ộ ọ
Câu VI (3 đi m)ể
1. Vi t ph ng trình hóa h c c a các ph n ng ế ươ ọ ủ ả ứ x y ra trong các tr ng h p sau (n u có):ả ườ ợ ế
a) S cụ khí Cl
2
vào dung d chị FeBr
2
.
b) Ion
I
trong KI b oxi hóa thành Iị
2
b i FeClở
3
c) Cho n c clo qua dung d ch KI d .ướ ị ư
d) S c khí clo t t đ n d vào dung d ch KBr.ụ ừ ừ ế ư ị
2. Hòa tan m gam KMnO
4
trong dung d ch HCl đ c d đ c dung d ch A và V lít khí D (đktc).ị ặ ư ượ ị
Pha loãng dung d ch A đ c 500 ml dung d ch B.ị ượ ị
- Đ trung hòa axit d trong 50 ml dung d ch B c n dùng v a đ 24 ml dung d ch NaOHể ư ị ầ ừ ủ ị
0,5 M.
- Thêm AgNO
3
d vào 100 ml dung d ch B đ k t t a hoàn toàn ion clorua thu đ c 17,22 gamư ị ể ế ủ ượ
k t ế
t a.ủ
a) Tính n ng đ mol/lít các ch t tan trong B ?ồ ộ ấ
b) Tính m, V và th tích dung d ch HCl 36,5% (D = 1,18 g/ml) đã dùng ?ể ị
----- H T -----Ế
Cán b coi thi không gi i thích gì thêm.ộ ả
Thí sinh không đ c s d ng b ng tu n hoàn.ượ ử ụ ả ầ
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có đáp án)ả ử ệ ể ế
TR NG THPT CHUYÊNƯỜ Đ THI H C SINH GI I C P TR NGỀ Ọ Ỏ Ấ ƯỜ
NGUY N B NH KHIÊMỄ Ỉ NĂM H C 2022 – 2023Ọ
Môn: HÓA H C 10Ọ
ĐÁP ÁN
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có đáp án)ả ử ệ ể ế
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ
Câu Đáp án và h ng d n ch mướ ẫ ấ Đi mể
Câu I 1. Phân t XYử
2
có t ng s h t proton, neutron, electron là 114, trong đó sổ ố ạ ố
h t mang đi n nhi u h n s h t không mang đi n 38 h t. S kh i c aạ ệ ề ơ ố ạ ệ ạ ố ố ủ
nguyên t Y l n h n s kh i c a nguyên t X là 20. T ng s h t proton,ử ớ ơ ố ố ủ ử ổ ố ạ
neutron, electron c a nguyên t X ít h n nguyên t Y là 30 h t. ủ ử ơ ử ạ
a) Xác đ nh tên nguyên t X và Y ?ị ố
b) Xác đ nh v trí c a X và Y trong b ng tu n hoàn các nguyên t hóaị ị ủ ả ầ ố
h c ?ọ
2. Urannium phân rã phóng x thành radium theo chu i sau: ạ ỗ
U
238
92
A
Pa
234
91
B
C
Ra
226
88
a) Vi t đ y đ các ph n ng c a dãy trên ?ế ầ ủ ả ứ ủ
b) Chu kỳ bán rã c a ủ
U
238
92
là 4,5.10
9
năm. S nguyên t b phân rã sauố ử ị
10
6
năm t 1 gam ừ
U
238
92
ban đ u là bao nhiêu ? Bi t s ầ ế ố N
A
= 6,023.10
23
4đ
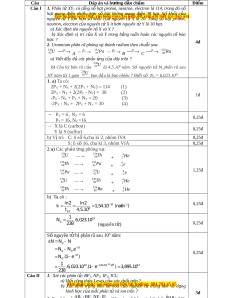
1. a) Ta có;
2P
X
+ N
X
+ 2(2P
Y
+ N
Y
) = 114 (1)
2P
X
- N
X
+ 2(2P
Y
- N
Y
) = 38 (2)
-P
X
- N
X
+ P
Y
+ N
Y
= 20 (3)
-2P
X
- N
X
+ 2P
Y
+ N
Y
= 30 (4)
1đ
→ P
X
= 6 , N
X
= 6
P
Y
= 16, N
Y
=16
0,25đ
→ X là C (carbon)
Y là S (sulfur)
0,25đ
b) V trí: C: ô s 6,chu kì 2, nhóm IVAị ố
0,25đ
S: ô s 16, chu kì 3, nhóm VIAố
0,25đ
2 a) Các ph n ng phóng x :ả ứ ạ
U
238
92
Th
234
90
+
He
4
2
Th
234
90
Pa
234
91
+
e
0
1
Pa
234
91
U
234
92
+
e
0
1
U
234
92
Th
230
90
+
He
4
2
Th
230
90
Ra
226
88
+
He
4
2
1,25đ
b) Ta có :
10 1
9
1/2
ln2 ln2
k 1,54.10 (naêm )
t
4,5.10
0,25đ
23
0
1
N .6,023.10
238
(nguyên t ) ử
0,25đ
S nguyên t b phân rã sau 10ố ử ị
6
năm:
10 6
0
kt
0 0
kt
0
23 1,54.10 .10 17
N N N
N N .e
N .(1 e )
1
.6,023.10 .(1 e ) 3,895.10
238
0,25đ
Câu II 1. Xét các phân t : BFử
3
, NF
3
, IF
3
, ICl
4
-
a) Vi t công th c Lewis c a các ch t trên ?ế ứ ủ ấ
b) Xác đ nh tr ng thái lai hóa c a nguyên t trung tâm và d ngị ạ ủ ử ạ
hình h c c a m i phân t và ion trên ?ọ ủ ỗ ử
2. Ba phân t ử
3 3 3 3
AB : BF , NF , IF
. Hãy gán s li u gócố ệ liên k t ế
:BAB
90°;
3đ