Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có đáp án) TRƯỜNG THPT NGUY N Ễ VĂN KỲ THI CH N Ọ H C Ọ SINH GI I Ỏ L P Ớ 10 TRỖI NĂM HỌC 2022-2023 TỔ HÓA HỌC Môn: HÓA HỌC
Thời gian: 150 phút (không kể th i ờ gian giao đ ) ề (Gồm 10 bài, 2 trang) H và ọ
tên thí sinh: ........................................................................S bá ố
o danh:......................................... Cho bi t:
ế H=1; O=16; C=12; N=14; S=32; Cl=35,5; Na= 23; K=39; Fe=56; Cu=64; Ca= 40; Mg=24; Ba=137; Br=80. Bài 1 (2,0 đi m) ể
1. Ở trạng thái cơ b n, ả nguyên tử c a ủ nguyên tố X có c u ấ hình electron l p ớ ngoài cùng là 4s1.
Viết cấu hình electron. Tính s e ố lectron đ c ộ thân c a
ủ nguyên tử nguyên tố X t ở r ng t ạ hái c b ơ n. ả 2. T ng ổ số h t ạ proton, n t
ơ ron và electron trong ion X3+ bằng 73, trong đó số h t ạ mang đi n ệ nhiều h n s ơ h ố ạt không mang đi n l ệ à 17. Vi t ế cấu hình electron c a ủ X, X2+, X3+. Bài 2 (2,0 đi m) ể Cho nguyên tố X, ở tr ng ạ thái cơ b n ả có 11 electron thu c ộ các phân l p ớ p. X có hai đ ng ồ v ịh n ơ kém nhau hai n t ơ ron. Trong đ ng v ồ ị s kh ố i ố l n, s ớ h ố ạt mang đi n g ệ ấp 1,7 lần h t ạ không mang đi n. ệ
1. Viết cấu hình electron c a ủ X. 2. Xác đ n ị h thành ph n ầ c u t ấ o ạ c a ủ hai đ n ồ g v ịvà thành ph n ầ % theo kh i ố lư n ợ g c a ủ m i ỗ đ n ồ g vị trong X t ự nhiên bi t ế nguyên t ử kh i ố (NTK) trung bình c a ủ X b n
ằ g 35,48. Coi NTK có giá tr ịb n ằ g s ố kh i ố . Bài 3 (2,0 đi m) ể
Cho các nguyên tử: 7N; 14Si; 15P: 1. Vi t ế c u ấ hình electron, xác đ n
ị h: vị trí (ô, chu kì, nhóm); lo i ạ nguyên t ố (kim lo i ạ , phi kim, khí hi m ế );
2. So sánh tính kim loại ho c
ặ phi kim của các nguyên t t ố rên (n u c ế ó), gi i ả thích ng n g ắ n. ọ Bài 4 (2,0 đi m) ể 1. Cho bi t ế tr ng ạ thái lai hóa c a
ủ các nguyên tử trung tâm và c u ấ trúc hình h c ọ c a ủ các phân t , ử 2−¿
ion sau: CS2, SO2, SO¿ . 4 2−¿ 2−¿
2. Giải thích vì sao SO¿ có khả năng hòa tan S tạo thành S O¿ . 3 2 3 Bài 5 (2,0 đi m) ể
1. Xét các phân tử POX3 a) Các phân t P
ử OF3 và POCl3 có cấu trúc hình h c ọ nh t ư hế nào?
b) So sánh góc liên k t ế XPX gi a ữ hai phân t t ử rên và gi i ả thích. 2. So sánh và gi i ả thích ng n ắ g n ọ độ phân c c ự (momen lư ng ỡ c c ự ) c a ủ các ch t ấ sau: NH3, NF3, BF3. Bài 6 (2,0 đi m) ể
Hoàn thành và cân bằng các phản ng ứ hóa h c ọ sau theo phư ng phá ơ p thăng b ng e ằ lectron: 1. Fe2+ + H+ + NO -3 Fe3+ + NO + ... →
2. FeCO3 + FeS2 + HNO3 Fe2(SO4)3 + …… + NO + H2O. M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có đáp án) Bài 7 (2,0 đi m) ể Ở điều ki n ệ chu n, ẩ 2 mol nhôm tác d ng ụ v a ừ đủ v i ớ khí chlorine t o ạ mu i ố aluminium chloride
và giải phóng một lư ng nhi ợ ệt 1390,81 kJ. 1. Viết và cân b ng ằ phư ng ơ trình hoá h c ọ c a ủ ph n ả ng, ứ Đây có ph i ả ph n ả ng ứ oxi hoá - khử không? Vì sao? 2. Bi n ế thiên enthalpy chu n ẩ c a ủ ph n ả ng ứ b ng ằ bao nhiêu? Ph n ả ng ứ trên thu nhi t ệ hay toả nhi t ệ ? 3. Tính lư ng nhi ợ ệt đư c
ợ giải phóng khi 10 gam A1C13 đư c ợ tạo thành. 4. Nếu mu n t ố ạo ra đư c ợ 1,0 kJ nhi t ệ lư ng c ợ
ần bao nhiêu gam Al phản ng? ứ Bài 8 (2,0 đi m) ể Cho các phản ng s ứ au: 0
(1)2H S(g) SO (g) 2H O(g) 3S(s), H 237kJ 2 2 2 r 298 0
(2)2H S(g) O (g) 2H O(g) 2S(s), H 530, 5kJ 2 2 2 r 298 1. Cùng m t ộ lư ng ợ hydrogen sulfide chuy n t ể hành nư c ớ và sulfur thì t i ạ sao nhi t ệ ph n ả ng (1) ứ và (2) lại khác nhau. 0 H 2. Xác đ nh ị f 298 của SO2 từ 2 phản ng ứ trên. Bài 9 (2,0 đi m) ể Cho s đ ơ t ồ hí nghi m ệ như hình v : ẽ Hãy cho bi t ế hi n ệ tư ng ợ x y ả ra trong thí nghi m
ệ khi khóa K đóng, khóa K m ở và gi i ả thích. Bi t ế
các chất X, Y, Z, T trong m i ỗ thí nghiệm l n l ầ ượt là: Thí nghi m 1: ệ H2SO4 đặc, C, dung d c ị h KMnO4, dung d c ị h Br2. Thí nghi m 2: ệ dung d c ị h HCl, KMnO4, dung d c ị h KBr, dung d c ị h FeCl2. Bài 10 (2,0 đi m) ể Đ t
ố cháy hoàn toàn 12 gam mu i ố sunfua c a ủ kim lo i
ạ R (hóa tr ịII) thu đư c ợ ch t ấ r n ắ A và khí B. Hòa tan h t ế A b ng ằ m t ộ lư ng ợ dung d c ị h H2SO4 24,5% thu đư c ợ dung d c ị h mu i ố có n ng ồ độ 33,33%. Làm lạnh dung d c ị h bão hòa này th y
ấ tách ra 15,625 gam tinh th ể mu i ố ng m ậ nư c ớ X, ph n ầ dung d c ị h bão hòa lúc này có n ng ồ đ 22,54%. X ộ ác đ nh ị kim lo i ạ M và công th c ứ c a ủ mu i ố ng m ậ nư c ớ X.
----------------------- H T
Ế ---------------------
* Thí sinh không được s d ử ng ụ
bảng tuần hoàn các nguyên tố hóa học.
* Giám thi không giải thích gì thêm. M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có đáp án) TRƯỜNG THPT NGUY N Ễ VĂN KỲ THI CH N Ọ H C Ọ SINH GI I Ỏ L P Ớ 10 TRỖI NĂM HỌC 2022-2023 TỔ HÓA HỌC Môn: HÓA HỌC
Thời gian: 150 phút (không kể th i ờ gian giao đ ) ề HƯ N Ớ G D N Ẫ CH M Ấ MÔN HÓA H C Ọ (G m ồ có 05 trang) Bài 1 (2,0 đi m) ể
1. Ở trạng thái cơ b n, ả nguyên tử c a ủ nguyên tố X có c u ấ hình electron l p ớ ngoài cùng là 4s1.
Viết cấu hình electron. Tính s e ố lectron đ c ộ thân c a
ủ nguyên tử nguyên tố X t ở r ng t ạ hái c b ơ n. ả 2. T ng ổ số h t ạ proton, n t
ơ ron và electron trong ion X3+ bằng 73, trong đó số h t ạ mang đi n ệ nhiều h n s ơ h ố ạt không mang đi n l ệ à 17. Vi t ế cấu hình electron c a ủ X, X2+, X3+. STT HƯ N Ớ G D N Ẫ CH M Ấ ĐI M Ể Có ba trư ng ờ h p s ợ au: Trư n ờ g h p
ợ 1: Cấu hình electron c a ủ X là [Ar] 4s1. t
Ở rạng thái cơ bản, X có 1 electron đ c ộ thân. 0,4 1 Trư n ờ g h p
ợ 2: Cấu hình electron c a ủ X là [Ar] 3d54s1. t
Ở rạng thái cơ bản, X có 6 electron đ c ộ thân. 0,4 Trư n ờ g h p
ợ 3: Cấu hình electron c a ủ X là [Ar] 3d104s1. t
Ở rạng thái cơ bản, X có 1 electron đ c ộ thân. 0,4 G i ọ hạt trong nguyên t X ử : p = e =x; n =y
2x y 3 73 0,4 2
Ta có hệ: 2x 3 y 17 x=24; y =28. 0,4 Cấu hình e c a
ủ X: [Ar]3d54s1; X2+: [Ar]3d4; X3+: [Ar]3d3 Bài 2 (2,0 đi m) ể Cho nguyên tố X, ở tr ng ạ thái cơ b n ả có 11 electron thu c ộ các phân l p ớ p. X có hai đ ng ồ v ịh n ơ kém nhau hai n t ơ ron. Trong đ ng v ồ ị s kh ố i ố l n, s ớ h ố ạt mang đi n g ệ ấp 1,7 lần h t ạ không mang đi n. ệ
1. Viết cấu hình electron c a ủ X. 2. Xác đ n ị h thành ph n ầ c u t ấ o ạ c a ủ hai đ n ồ g v ịvà thành ph n ầ % theo kh i ố lư n ợ g c a ủ m i ỗ đ n ồ g vị trong X t ự nhiên bi t ế nguyên t ử kh i ố (NTK) trung bình c a ủ X b n
ằ g 35,48. Coi NTK có giá tr ịb n ằ g s ố kh i ố . STT HƯ N Ớ G D N Ẫ CH M Ấ ĐI M Ể 1
Vì X có 11 electron thuộc phân l p ớ p
cấu hình electron phân l p ớ p c a ủ X là: 2p63p5 0,5
cấu hình electron đầy đ : ủ 1s22s22p63s23p5. 2 Trong đ ng ồ v s ị kh ố ối l n ớ s h ố ạt mang đi n ệ là 17.2 = 34 h t ạ s n ố t
ơ ron (hạt không mang đi n) ệ là 34:1,7 = 20 h t ạ . M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có đáp án) s n ố t ơ ron trong đ ng ồ v s ị kh ố i ố nh l ỏ à 18 h t ạ .
Vậy thành phần cấu tạo các đ ng v ồ ị c a ủ X là: Đ ng v ồ ị s kh ố i ố nh :
ỏ 17 electron, 17 proton, 18 n t ơ ron. Đ ng v ồ ị s kh ố i ố l n:
ớ 17 electron, 17 proton, 20 n t ơ ron. 0,5
Thành phần % theo khối lư ng: ợ G i
ọ thành phần % theo s nguyê ố n t đ ử ng ồ v nh ị l ỏ à x%
thành phần % theo s nguyê ố n tử đ ng v ồ ị l n l ớ à (100 – x)%. Áp d ng c ụ ông th c ứ tính NTKTB ta có:
NTKTB (A) = A1.x% + A2. (100 – x)%
(17+18).x% + (17+20)(100-x)% = 35,48 x = 76%. 0,5
Xét 1 mol X (35,48 gam) có 0,76 mol 35X (0,76.35 = 26,6 gam) thành phần % theo kh i ố lư ng
ợ 35X là: 26,6 : 35,48 = 74,97% thành phần % theo kh i ố lư ng
ợ 37X là: 100% - 74,97% = 25,03%. 0,5 Bài 3 (2,0 đi m) ể
Cho các nguyên tử: 7N; 14Si; 15P: 1. Vi t ế c u ấ hình electron, xác đ n
ị h: vị trí (ô, chu kì, nhóm); lo i ạ nguyên t ố (kim lo i ạ , phi kim, khí hi m ế );
2. So sánh tính kim loại ho c
ặ phi kim của các nguyên t t ố rên (n u c ế ó), gi i ả thích ng n g ắ n. ọ STT HƯ N Ớ G D N Ẫ CH M Ấ ĐIỂ M
7N: [He] 2s22p3, ô 7, chu kì 2, nhóm VA, là phi kim. 0,4 1
14Si: [Ne] 3s23p2, ô 14, chu kì 3, nhóm IVA, là phi kim. 0,4
15P: [Ne] 3s23p3, ô 15, chu kì 3, nhóm VA, là phi kim. 0,4
Tính phi kim P > Si vì trong chu kì, tính phi kim tăng theo chi u Z ề tăng 0,4 2
Tính phi kim N > P vì trong nhóm A, tính phi kim gi m ả theo chi u ề Z tăng. 0,4
→ Tính phi kim: N > P > Si Bài 4 (2,0 đi m) ể 1. Cho bi t ế tr ng ạ thái lai hóa c a
ủ các nguyên tử trung tâm và c u ấ trúc hình h c ọ c a ủ các phân t , ử 2−¿
ion sau: CS2, SO2, SO¿ . 4 2−¿ 2−¿
2. Giải thích vì sao SO¿ có khả năng hòa tan S tạo thành S O¿ . 3 2 3 STT HƯ N Ớ G D N Ẫ CH M Ấ ĐIỂ M Phân t , i ử on
Trạng thái lai hóa c a ủ Cấu trúc hình h c ọ nguyên t tr ử ung tâm 1 CS2 sp Đư ng t ờ hẳng SO 1,5 2 sp2 Góc 2−¿ sp3 T di ứ n ệ đ u ề SO¿4 2 2−¿ S 2− 0,5 2 O3
SO¿ có khả năng k t ế h p
ợ thêm 1 nguyên tử S để t o ạ vì trên nguyên tử S 3 2−¿
trong SO¿ còn có 1 c p ặ electron tự do ch a ư liên k t
ế có khả năng cho vào obitan 3p 3 M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đề HSG Hóa 10 Trường THPT Nguyễn Văn Trỗi năm 2023 có đáp án
826
413 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Tài liệu được cập nhật liên tục trong gói này từ nay đến hết tháng 3/2024. Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu Đề HSG Hóa 10 Trường THPT NGuyễn Văn Trỗi năm 2023 có đáp án.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(826 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 10
Xem thêmTài liệu bộ mới nhất

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có đáp án)ả ử ệ ể ế
TR NG THPT ƯỜ
NGUY N VĂNỄ
TR IỖ
T HÓA H CỔ Ọ
(G m 10 bài, 2 trang)ồ
KỲ THI CH N H C SINH GI I L P 10 Ọ Ọ Ỏ Ớ
NĂM H C 2022-2023Ọ
Môn: HÓA H CỌ
Th i gian:ờ 150 phút (không k th i gian giao đ )ể ờ ề
H và tên thí sinh: ọ ........................................................................S báo danh:ố .........................................
Cho bi t: ế H=1; O=16; C=12; N=14; S=32; Cl=35,5; Na= 23; K=39; Fe=56; Cu=64; Ca= 40;
Mg=24; Ba=137; Br=80.
Bài 1 (2,0 đi m)ể
1. tr ng thái c b n, nguyên t c a nguyên t X có c u hình electron l p ngoài cùng là 4sỞ ạ ơ ả ử ủ ố ấ ớ
1
.
Vi t c u hình electron. Tính s electron đ c thân c a nguyên t nguyên t X tr ng thái c b n.ế ấ ố ộ ủ ử ố ở ạ ơ ả
2. T ng s h t proton, n tron và electron trong ion Xổ ố ạ ơ
3+
b ng 73, trong đó s h t mang đi nằ ố ạ ệ
nhi u h n s h t không mang đi n là 17. Vi t c u hình electron c a X, Xề ơ ố ạ ệ ế ấ ủ
2+
, X
3+
.
Bài 2 (2,0 đi m)ể
Cho nguyên t X, tr ng thái c b n có 11 electron thu c các phân l p p. X có hai đ ng v h nố ở ạ ơ ả ộ ớ ồ ị ơ
kém nhau hai n tron. ơ Trong đ ng v s kh i l n, s h t mang đi n g p 1,7 l n h t không mang đi n.ồ ị ố ố ớ ố ạ ệ ấ ầ ạ ệ
1. Vi t c u hình electron c a X.ế ấ ủ
2. Xác đ nh thành ph n c u t o c a hai đ ng v và thành ph n % theo kh i l ng c a m i đ ng vị ầ ấ ạ ủ ồ ị ầ ố ượ ủ ỗ ồ ị
trong X t nhiên bi t nguyên t kh i (NTK) trung bình c a X b ng 35,48. Coi NTK có giá tr b ng s kh i.ự ế ử ố ủ ằ ị ằ ố ố
Bài 3 (2,0 đi m)ể
Cho các nguyên t : ử
7
N;
14
Si;
15
P:
1. Vi t c u hình electron, xác đ nh: v trí (ô, chu kì, nhóm); lo i nguyên t (kim lo i, phi kim, khíế ấ ị ị ạ ố ạ
hi m);ế
2. So sánh tính kim lo i ho c phi kim c a các nguyên t trên (n u có), gi i thích ng n g n.ạ ặ ủ ố ế ả ắ ọ
Bài 4 (2,0 đi m)ể
1. Cho bi t tr ng thái lai hóa c a các nguyên t trung tâm và c u trúc hình h c c a các phân t ,ế ạ ủ ử ấ ọ ủ ử
ion sau: CS
2
, SO
2
,
2−¿
SO
4
¿
.
2. Gi i thích vì sao ả
2−¿
SO
3
¿
có kh năng hòa tan ả S t o thành ạ
2−¿
S
2
O
3
¿
.
Bài 5 (2,0 đi m)ể
1. Xét các phân t POXử
3
a) Các phân t POFử
3
và POCl
3
có c u trúc hình h c nh th nào?ấ ọ ư ế
b) So sánh góc liên k t XPX gi a hai phân t trên và gi i thích.ế ữ ử ả
2. So sánh và gi i thích ng n g n đ phân c c (momen l ng c c) c a các ch t sau: NHả ắ ọ ộ ự ưỡ ự ủ ấ
3
, NF
3
,
BF
3
.
Bài 6 (2,0 đi m)ể
Hoàn thành và cân b ng các ph n ng hóa h c sau theo ph ng pháp thăng b ng electron:ằ ả ứ ọ ươ ằ
1. Fe
2+
+ H
+
+ NO
3
-
→
Fe
3+
+ NO
+ ...
2. FeCO
3
+ FeS
2
+ HNO
3
Fe
2
(SO
4
)
3
+ …… + NO + H
2
O.
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ
Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có đáp án)ả ử ệ ể ế
Bài 7 (2,0 đi m)ể
đi u ki n chu n, 2 mol nhôm tác d ng v a đ v i khí chlorine t o mu i aluminium chlorideỞ ề ệ ẩ ụ ừ ủ ớ ạ ố
và gi i phóng m t l ng nhi t 1390,81 kJ.ả ộ ượ ệ
1. Vi t và cân b ng ph ng trình hoá h c c a ph n ng, Đây có ph i ph n ng oxi hoá - khế ằ ươ ọ ủ ả ứ ả ả ứ ử
không? Vì sao?
2. Bi n thiên enthalpy chu n c a ph n ng b ng bao nhiêu? Ph n ng trên thu nhi t hay toế ẩ ủ ả ứ ằ ả ứ ệ ả
nhi t?ệ
3. Tính l ng nhi t đ c gi i phóng khi 10 gam A1C1ượ ệ ượ ả
3
đ c t o thành.ượ ạ
4. N u mu n t o ra đ c 1,0 kJ nhi t l ng c n bao nhiêu gam Aế ố ạ ượ ệ ượ ầ l ph n ng?ả ứ
Bài 8 (2,0 đi m)ể
Cho các ph n ng sau:ả ứ
0
2 2 2 298
0
2 2 2 298
(1)2 ( ) ( ) 2 ( ) 3 ( ), 237
(2)2 ( ) ( ) 2 ( ) 2 ( ), 530,5
r
r
H S g SO g H O g S s H kJ
H S g O g H O g S s H kJ
1. Cùng m t l ng hydrogen sulfide chuy n thành n c và sulfur thì t i sao nhi t ph n ng (1) ộ ượ ể ướ ạ ệ ả ứ
và (2) l i khác nhau.ạ
2. Xác đ nh ị
0
298f
H
c a SOủ
2
t 2 ph n ng trên.ừ ả ứ
Bài 9 (2,0 đi m)ể
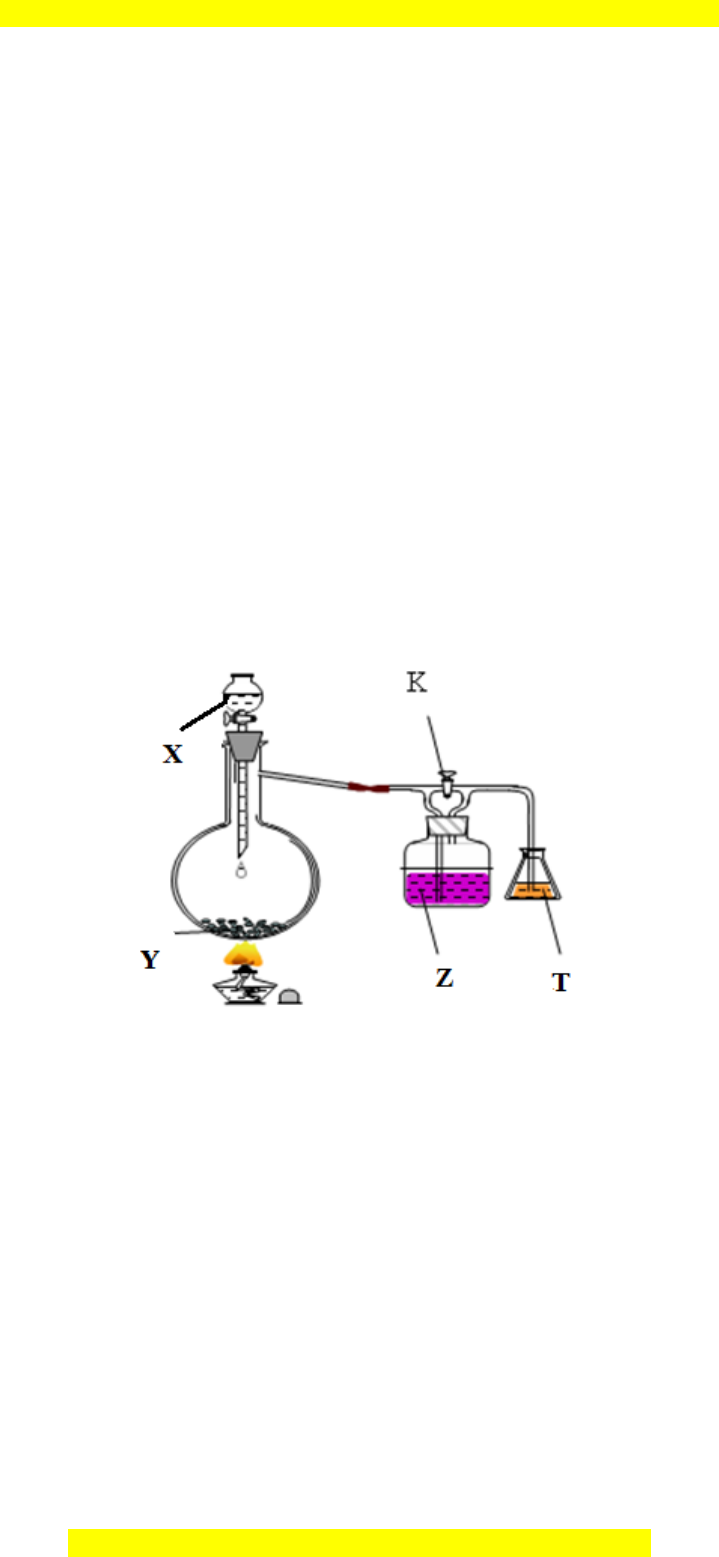
Cho s đ thí nghi m nh hình v :ơ ồ ệ ư ẽ
Hãy cho bi t hi n t ng x y ra trong thí nghi m khi khóa K đóng, khóa K m và gi i thích. Bi tế ệ ượ ả ệ ở ả ế
các ch t X, Y, Z, T trong m i thí nghi m l n l t là:ấ ỗ ệ ầ ượ
Thí nghi m 1:ệ H
2
SO
4
đ c, C, dung d ch KMnOặ ị
4
, dung d ch Brị
2
.
Thí nghi m 2:ệ dung d ch HCl, KMnOị
4
, dung d ch KBr, dung d ch FeClị ị
2
.
Bài 10 (2,0 đi m)ể
Đ t cháy hoàn toàn 12 gam mu i sunfua c a kim lo i R (hóa tr II) thu đ c ch t r n A và khí B.ố ố ủ ạ ị ượ ấ ắ
Hòa tan h t A b ng m t l ng dung d ch Hế ằ ộ ượ ị
2
SO
4
24,5% thu đ c dung d ch mu i có n ng đ 33,33%.ượ ị ố ồ ộ
Làm l nh dung d ch bão hòa này th y tách ra 15,625 gam tinh th mu i ng m n c X, ph n dung d chạ ị ấ ể ố ậ ướ ầ ị
bão hòa lúc này có n ng đ 22,54%. Xác đ nh kim lo i M và công th c c a mu i ng m n c X. ồ ộ ị ạ ứ ủ ố ậ ướ
----------------------- H TẾ ---------------------
* Thí sinh không đ c s d ng ượ ử ụ b ng tu n hoàn các nguyên t hóa hả ầ ố ọc.
* Giám thi không gi i thích gì thêm.ả
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có đáp án)ả ử ệ ể ế
TR NG THPT NGUY N VĂNƯỜ Ễ
TR IỖ
T HÓA H CỔ Ọ
KỲ THI CH N H C SINH GI I L P 10 Ọ Ọ Ỏ Ớ
NĂM H C 2022-2023Ọ
Môn: HÓA H CỌ
Th i gian:ờ 150 phút (không k th i gian giao đ )ể ờ ề
H NG D N CH M MÔN HÓA H CƯỚ Ẫ Ấ Ọ
(G m có 05 trang)ồ
Bài 1 (2,0 đi m)ể
1. tr ng thái c b n, nguyên t c a nguyên t X có c u hình electron l p ngoài cùng là 4sỞ ạ ơ ả ử ủ ố ấ ớ
1
.
Vi t c u hình electron. Tính s electron đ c thân c a nguyên t nguyên t X tr ng thái c b n.ế ấ ố ộ ủ ử ố ở ạ ơ ả
2. T ng s h t proton, n tron và electron trong ion Xổ ố ạ ơ
3+
b ng 73, trong đó s h t mang đi nằ ố ạ ệ
nhi u h n s h t không mang đi n là 17. Vi t c u hình electron c a X, Xề ơ ố ạ ệ ế ấ ủ
2+
, X
3+
.
STT H NG D N CH MƯỚ Ẫ Ấ ĐI MỂ
1
Có ba tr ng h p sau:ườ ợ
Tr ng h p 1: ườ ợ C u hình electron c a X là [Ar] 4sấ ủ
1
.
tr ng thái c b n, X có 1 electron đ c thân.Ở ạ ơ ả ộ
Tr ng h p 2:ườ ợ C u hình electron c a X là [Ar] 3dấ ủ
5
4s
1
.
tr ng thái c b n, X có 6 electron đ c thân.Ở ạ ơ ả ộ
Tr ng h p 3:ườ ợ C u hình electron c a X là [Ar] 3dấ ủ
10
4s
1
.
tr ng thái c b n, X có 1 electron đ c thân.Ở ạ ơ ả ộ
0,4
0,4
0,4
2
G i h t trong nguyên t X: p = e =x; n =yọ ạ ử
Ta có h : ệ
2 3 73
2 3 17
x y
x y
x=24; y =28.
C u hình e c a X: [Ar]3dấ ủ
5
4s
1
; X
2+
: [Ar]3d
4
; X
3+
: [Ar]3d
3
0,4
0,4
Bài 2 (2,0 đi m)ể
Cho nguyên t X, tr ng thái c b n có 11 electron thu c các phân l p p. X có hai đ ng v h nố ở ạ ơ ả ộ ớ ồ ị ơ
kém nhau hai n tron. ơ Trong đ ng v s kh i l n, s h t mang đi n g p 1,7 l n h t không mang đi n.ồ ị ố ố ớ ố ạ ệ ấ ầ ạ ệ
1. Vi t c u hình electron c a X.ế ấ ủ
2. Xác đ nh thành ph n c u t o c a hai đ ng v và thành ph n % theo kh i l ng c a m i đ ng vị ầ ấ ạ ủ ồ ị ầ ố ượ ủ ỗ ồ ị
trong X t nhiên bi t nguyên t kh i (NTK) trung bình c a X b ng 35,48. Coi NTK có giá tr b ng s kh i.ự ế ử ố ủ ằ ị ằ ố ố
STT H NG D N CH MƯỚ Ẫ Ấ ĐI MỂ
1 Vì X có 11 electron thu c phân l p p ộ ớ
c u hình electron phân l p p c a X là: 2pấ ớ ủ
6
3p
5
c u hình electron đ y đ : 1sấ ầ ủ
2
2s
2
2p
6
3s
2
3p
5
.
0,5
2 Trong đ ng v s kh i l n s h t mang đi n là 17.2 = 34 h tồ ị ố ố ớ ố ạ ệ ạ
s n tron (h t không mang đi n) là 34:1,7 = 20 h t.ố ơ ạ ệ ạ
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ
Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có đáp án)ả ử ệ ể ế
s n tron trong đ ng v s kh i nh là 18 h t.ố ơ ồ ị ố ố ỏ ạ
V y thành ph n c u t o các đ ng v c a X là:ậ ầ ấ ạ ồ ị ủ
Đ ng v s kh i nh : 17 electron, 17 proton, 18 n tron.ồ ị ố ố ỏ ơ
Đ ng v s kh i l n: 17 electron, 17 proton, 20 n tron.ồ ị ố ố ớ ơ
Thành ph n % theo kh i l ng:ầ ố ượ
G i thành ph n % theo s nguyên t đ ng v nh là x% ọ ầ ố ử ồ ị ỏ
thành ph n % theo s nguyên t đ ng v l n là (100 – x)%.ầ ố ử ồ ị ớ
Áp d ng công th c tính NTKTB ta có:ụ ứ
NTKTB (A) = A
1
.x% + A
2
. (100 – x)%
(17+18).x% + (17+20)(100-x)% = 35,48 x = 76%.
Xét 1 mol X (35,48 gam) có 0,76 mol
35
X (0,76.35 = 26,6 gam)
thành ph n % theo kh i l ng ầ ố ượ
35
X là: 26,6 : 35,48 = 74,97%
thành ph n % theo kh i l ng ầ ố ượ
37
X là: 100% - 74,97% = 25,03%.
0,5
0,5
0,5
Bài 3 (2,0 đi m)ể
Cho các nguyên t : ử
7
N;
14
Si;
15
P:
1. Vi t c u hình electron, xác đ nh: v trí (ô, chu kì, nhóm); lo i nguyên t (kim lo i, phi kim, khíế ấ ị ị ạ ố ạ
hi m);ế
2. So sánh tính kim lo i ho c phi kim c a các nguyên t trên (n u có), gi i thích ng n g n.ạ ặ ủ ố ế ả ắ ọ
STT H NG D N CH MƯỚ Ẫ Ấ
ĐIỂ
M
1
7
N: [He] 2s
2
2p
3
, ô 7, chu kì 2, nhóm VA, là phi kim.
14
Si: [Ne] 3s
2
3p
2
, ô 14, chu kì 3, nhóm IVA, là phi kim.
15
P: [Ne] 3s
2
3p
3
, ô 15, chu kì 3, nhóm VA, là phi kim.
0,4
0,4
0,4
2
Tính phi kim P > Si vì trong chu kì, tính phi kim tăng theo chi u Z ề
tăng
Tính phi kim N > P vì trong nhóm A, tính phi kim gi m theo chi u Z tăng.ả ề
→ Tính phi kim: N > P > Si
0,4
0,4
Bài 4 (2,0 đi m)ể
1. Cho bi t tr ng thái lai hóa c a các nguyên t trung tâm và c u trúc hình h c c a các phân t ,ế ạ ủ ử ấ ọ ủ ử
ion sau: CS
2
, SO
2
,
2−¿
SO
4
¿
.
2. Gi i thích vì sao ả
2−¿
SO
3
¿
có kh năng hòa tan ả S t o thành ạ
2−¿
S
2
O
3
¿
.
STT H NG D N CH MƯỚ Ẫ Ấ
ĐIỂ
M
1
Phân t , ionử Tr ng thái lai hóa c aạ ủ
nguyên t trung tâmử
C u trúc hình h cấ ọ
CS
2
sp Đ ng th ngườ ẳ
SO
2
sp
2
Góc
2−¿
SO
4
¿
sp
3
T di n đ uứ ệ ề
1,5
2
2−¿
SO
3
¿
có kh năng k t h p thêm 1 nguyên t S đ t o ả ế ợ ử ể ạ
S
2
O
3
2−
vì trên nguyên t Sử
trong
2−¿
SO
3
¿
còn có 1 c p electron t do ch a liên k t có kh năng cho vào obitan 3pặ ự ư ế ả
0,5
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có đáp án)ả ử ệ ể ế
tr ng c a nguyên t S t o liên k t cho nh n.ố ủ ử ạ ế ậ
Bài 5 (2,0 đi m)ể
1. Xét các phân t POXử
3
a) Các phân t POFử
3
và POCl
3
có c u trúc hình h c nh th nào?ấ ọ ư ế
b) So sánh góc liên k t XPX gi a hai phân t trên và gi i thích.ế ữ ử ả
2. So sánh và gi i thích ng n g n đ phân c c (momen l ng c c) c a các ch t sau: NHả ắ ọ ộ ự ưỡ ự ủ ấ
3
, NF
3
,
BF
3
.
STT
H NG D N CH MƯỚ Ẫ Ấ ĐI MỂ
1a Dùng VSEPR đ gi i thích:ể ả
- POX
3
theo VSEPR có d ng AXạ
4
E
0
nên nguyên t trung tâm P tr ng tháiố ở ạ
lai hóa sp
3
.
- Phân t có d ng hình h c là hình t di n. ử ạ ọ ứ ệ
0,2
0,2
1b Góc liên k t FPF < ClPCl. Vì Cl có đ âm đi n nh h n F nên F hút electronế ộ ệ ỏ ơ
m nh h n Cl, do v y l c đ y gi a các đôi electron liên k t ( P-X) trong phân tạ ơ ậ ự ẩ ữ ế ử
POCl
3
l n h n trong phân t POFớ ơ ử
3
nên góc liên k t FPF < ClPCl. ế
0,4
2
Các vect momen ơ
l ng c c c a các liên ưỡ ự ủ
k t và c p electron ế ặ
không liên k t ng c ế ượ
chi u nên momen ề
l ng c c c a phân t ưỡ ự ủ ử
bé h n NHơ
3
.
Phân t d ng tam ử ạ
giác đ u, các vect ề ơ
momen l ng c c ưỡ ự
c a các liên k t tri tủ ế ệ
tiêu l n nhau (t ng ẫ ổ
b ng không). Phân ằ
t không phân c c.ử ự
Các vect momen l ng c c ơ ưỡ ự
c a liên k t và c p electron ủ ế ặ
không liên k t cùng chi u nên ế ề
momen l ng c c c a phân ưỡ ự ủ
t là l n nh t.ử ớ ấ
0,4.3 =
1,2 đ
Bài 6 (2,0 đi m)ể
Hoàn thành và cân b ng các ph n ng hóa h c sau theo ph ng pháp thăng b ng electron:ằ ả ứ ọ ươ ằ
1. Fe
2+
+ H
+
+ NO
3
-
→
Fe
3+
+ NO
+ ...
2. FeCO
3
+ FeS
2
+ HNO
3
Fe
2
(SO
4
)
3
+ …… + NO + H
2
O.
STT H NG D N CH MƯỚ Ẫ Ấ ĐI MỂ
1
+2 +5 +3 +2
Fe
2+
+ H
+
+ NO
3
-
→
Fe
3+
+ NO
+ H
2
O
3x Fe
+2
→
Fe
+3
+ 1e
1x N
+5
+ 3e
→
N
+2
3Fe
2+
+ 4H
+
+ NO
3
-
→
3Fe
3+
+ NO
+ 2H
2
O
1,0
2
FeCO
3
+ FeS
2
+ HNO
3
Fe
2
(SO
4
)
3
+ CO
2
+ NO + H
2
O
2 3 6
2
5 2
Fe 3FeS 43x
46x
N 3e N
Fe 6 S 46e
3FeCO
3
+ 9FeS
2
+ 46HNO
3
6Fe
2
(SO
4
)
3
+ 3CO
2
+ 46NO + 23H
2
O
1,0
Bài 7 (2,0 đi m)ể
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ