Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t (c ế ó đáp án) SỞ GIÁO D C Ụ VÀ ĐÀO T O Ạ HÀ NỘI Đ Ề THI HỌC SINH GI I Ỏ KHỐI 10 TRƯỜNG THPT QU N Ả G OAI NĂM H C Ọ 2022 - 2023 MÔN THI: HÓA H C Ọ Th i
ờ gian làm bài: 150 phút (Đ g ề m
ồ có 02 trang) - Cho nguyên t ử kh i ố c a ủ các nguyên t :
ố H=1; C=12; N=14; O=16; Na=23; Mg =24; Al=27; S=32; Cl =
35,5; K=39; Ca=40; Cr = 52; Fe = 56; Cu=64; Zn=65; Br = 80; Ag = 108; Ba=137. - Cho bi t ế s ố hi u ệ nguyên t ử c a ủ các nguyên t :
ố 1H; 6C; 7N; 8O; 10Ne; 11Na; 12Mg; 13Al; 16S; 17Cl; 18Ar;
19K; 20Ca; 24Cr; 26Fe; 29Cu; 30Zn. Câu I (3 đi m) ể 1) Cho ph n ả n ứ g: A 1 +¿ 1 X ư ợ Z + 3 n 0 +năng l ng 1 (1)
239 Pu 1 →91Y 94 + n 0 39 ¿ 1 H A 0 2 E ư ợ (¿1 )→Z +2( e)+ năngl ng 2 +1 (2) 4 ¿ a. Ch ỉ rõ ph n ả n
ứ g phân hạch và phản n ứ g nhiệt hạch.
b. Tìm các giá trị A1, Z1; A2; Z2. 2) a) Vi t ế công th c ứ Lewis và xác đ n ị h d n ạ g hình h c ọ c a ủ CO2. Xác đ n ị h d n ạ g lai hóa c a ủ nguyên tử trung tâm. b) Xác đ n ị h d n ạ g lai hóa c a ủ nguyên t ử trung tâm trong NH + 2- 4 , CO3 , HNO3, H2SO4. PCl5 . Câu II. (3 đi m ể ) 1) M t ộ h p ợ ch t ấ có công th c
ứ là MAx, trong đó M chi m ế 46,67% v ề kh i ố lư ng. ợ M là kim lo i ạ , A là
phi kim ở chu kì 3. Trong h t ạ nhân c a ủ M có n - p = 4, trong h t ạ nhân c a ủ A có n’ = p’. T ng ổ số proton trong MAx là 58. a. Xác đ nh ị tên nguyên t , s ố kh ố ối c a ủ M, số th t
ứ ự A trong bảng tuần hoàn. b. Hoàn thành các phư ng ơ trình hóa h c ọ : + MXx + O2 ⃗ t 0 M2O3 + XO2 + MXx + HNO3 ⃗ t 0
M(NO3)3 + M2(XO4)3 + H2XO4 + NO2 + H2O
2) X, Y, R, A, B, M theo thứ t ự là 6 nguyên t ố liên ti p ế trong H ệ th ng ố tu n ầ hoàn có t ng ổ s ố đ n ơ vị đi n t
ệ ích hạt nhân là 63 (X có s đ ố n v ơ đi ị n ệ tích h t ạ nhân nh nh ỏ t ấ ). a. Xác đ nh ị s đ ố n v ơ đi ị n ệ tích hạt nhân c a ủ X, Y, R, A, B, M.
b. Viết cấu hình electron c a
ủ X2−, Y−, R, A+, B2+, M3+. So sánh bán kính c a ủ chúng và gi i ả thích? Câu III. (3 đi m ể ) 1) Cân bằng các phư ng ơ trình phản ng s ứ au theo phư ng phá ơ p thăng b ng e ằ lectron.
a) FeSO4 + KMnO4 + KHSO4 Fe2(SO4)3 + K2SO4 + MnSO4 + H2O. b) MnO - - -
2 + NO3 + OH - MnO4 + NO2 + H2O. 0 t c. FeSO 4 + KMnO4 + H2SO4
Fe2(SO4)3 + MnSO4 + K2SO4 + H2O d)
-CH3 + K2Cr2O7 + H2SO4 CH3-CO-(CH2)4-COOH + K2SO4 + Cr2(SO4)3 + H2O e)
-CH2-CH=CH2 + K2Cr2O7 + H2SO4 HOOC-(CH2)3-CH(COOH)-CH2-COOH + CO2 + K2SO4 + Cr2(SO4)3 + H2O M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t (c ế ó đáp án) 2) Kh i ố lư ng ợ mol (g/mol) c a ủ nư c ớ , ammonia và methane l n ầ lư t ợ b ng ằ 18, 17, 16. Nư c ớ sôi ở 100
c, còn ammonia sôi ở – 33,35 oC và methane sôi ở – 161,58 oC. Giải thích vì sao các ch t ấ trên có kh i ố lư ng ợ mol xấp x nha ỉ u nh ng ư nhi t ệ độ sôi c a ủ chúng l i ạ chênh l c ệ h nhau. Câu IV. (3,5 đi m ể ) 1) Tính năng lư ng ợ liên k t ế : C-H và C-C, cho bi t ế : + Nhi t ệ đ t
ố cháy CH4: ∆H1 = -801,7 kJ/mol. C2H6: ∆H2 = -1412,7 kJ/mol. + Nhi t ệ đ t
ố cháy H2: ∆H3 = -241,5 kJ/mol. C(graphite): ∆H4 = -393,4 kJ/mol.
+ Eb H-H: ∆H5 = 413,5 kJ/mol. + Nhi t ệ hóa h i ơ c a
ủ C(graphite): ∆H6 = 715,0 kJ/mol. 2) a. Tính nhi t
ệ tạo thành chuẩn của khí CO từ nh ng d ữ ki ữ n ệ th c ự nghiệm sau: C(graphit) + O2 (g) CO2 (g) rHo1 = - 393,77 kJ/mol 2 CO(g) + O2 (g) 2 CO2 (g) rHo2 = - 566,39 kJ/mol
b. Kết quả này có phù h p v ợ i ớ công th c ứ c u t ấ o c ạ ủa CO n u gi ế t ả hi t ế là C=O không? Vì sao? Cho bi t ế nhi t ệ thăng hoa c a
ủ than chì là 711,756 kJ/mol, năng lư ng ợ liên k t ế trong phân t ử O2 là 194
kJ/mol và năng năng lư ng l ợ iên k t
ế C=O trong CO2 là 703,38 kJ/mol. Câu V. (4 đi m ể ) 1) M t ộ bình gas (khí hóa l ng) ỏ ch a ứ h n ỗ h p
ợ propane (C3H8) và butane (C4H10) v i ớ tỉ lệ mol 1:2. Xác đ nh l ị ư ng nhi ợ ệt t a ỏ ra khi đ t
ố cháy hoàn toàn 12 kg khí gas trên đi ở u ki ề n ệ chu n. ẩ Cho biết các phản ng: ứ o C H 2220 kJ 3H8 (g) + 5O2 (g)
3CO2 (g) + 4H2O (l) r 298 13 o C 2 H 2874 kJ 4H10 (g) + O2 (g)
4CO2 (g) + 5H2O (l) r 298 Trung bình mỗi ngày, m t ộ hộ gia đình c n ầ đ t ố gas để cung c p ấ 10000 kJ nhi t ệ (hi u ệ su t ấ h p ấ thụ nhi t ệ là 80%). a. Sau bao nhiêu ngày h gi ộ a đình trên s s ẽ d ử ng ụ h t ế bình gas 12 kg? b. Giá gas là 440.000 đ ng/ ồ bình 12 kg thì m i
ỗ tháng hộ gia đình trên dùng h t ế bao nhiêu ti n ề ga (giả s 1 t ử háng có 30 ngày) c. Giả thi t ế r ng ằ toàn b ộ lư ng ợ nhi t ệ c a ủ quá trình đ t ố gas t a ỏ ra đ u ề dùng đ ể làm nư c ớ nóng v i ớ hi u ệ suất h p ấ thụ nhi t ệ kho ng
ả 70%, hãy tính thể tích khí gas (ở đi u ề ki n ệ chu n) ẩ c n ầ ph i ả đ t ố để làm nóng 2 lít nư c ớ t ừ o 25 C tới o 100 C. Biết nhi t ệ dung của nư c ớ là 4,2 J/g.K. 2. Tính bi n ế thiên enthanpy c a ủ ph n ả ng ứ t o ạ thành ammonia (sử d ng ụ năng lư ng ợ liên k t ế ). Cho biết phản ng ứ thu nhi t ệ hay t a ỏ nhi t ệ và v ẽ s ơ đ ồ bi u ể di n ễ bi n ế thiên enthalpy c a ủ ph n ả ng. ứ (Cho biết năng lư ng c ợ ủa một s l ố oại liên k t
ế ở điều kiên chuẩn: H2 = 432; N2 = 945; N-H = 391). 3H2(g) + N2(g) 2NH3(g) Câu VI. (3,5 đi m ể ) 1) M t ộ h n ỗ h p ợ A g m ồ FeS2; FeS; CuS đư c ợ hoà tan v a ừ đ ủ trong m t ộ dung d c ị h có ch a ứ 0,33 mol H2SO4 đ c ặ nóng. Thu đư c
ợ 7,28 lít SO2 (đktc) và dung d c ị h B. Nhúng m t ộ thanh s t ắ n ng ặ 50 gam vào dung d c ị h B, ph n ả ng ứ xong nh c ấ thanh s t ắ ra đem cân th y ấ kh i ố lư ng ợ thanh s t ắ lúc này là 49,48 gam và còn l i ạ dung d c ị h C. Xác đ nh ị kh i ố lư ng ợ các ch t ấ có trong A (coi lư ng ợ đ ng ồ đư c ợ đẩy ra bám h t ế lên thanh sắt).
2) a) Hãy nêu các dấu hi u ệ nhằm phát hi n ệ s m ớ đám cháy.
b) Em cần làm gì khi phát hi n ệ đám cháy? M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t (c ế ó đáp án) ĐÁP ÁN Đ Ề THI HSG – KH I Ố 10 – MÔN HÓA Câu Đáp án Biể u điể m
Câu 1 1) a . (1) là ph n ả n ứ g phân h c ạ h; (2) là ph n ả n ứ g nhi t ệ h c ạ h. 0,5 1) b. Áp d n ụ g đ n ị h lu t ậ b o ả toàn đi n ệ tích và s ố kh i ố : 0,5 94 3 9 Z Z 5 5 1 1 239 1 91 A 3 A 1 46 * Xét ph n ả n ứ g (1) 1 1 4 2 Z Z 2 2 2 4 A A 4 * Xét ph n ả n ứ g (2) 2 2 2. a 0,25
- Công thức Lewis CO2: - Dạng hình h c ọ : Đư ng t ờ hẳng 0,25 - Lai hóa sp 0,25 2.b NH + 2- 4 CO3 HNO3 H2SO4 PCl5 M i ỗ sp3 sp2 sp2 sp3 sp3d1 chất 0,25 Câu 2 a. Trong h p c ợ
hất MAx, M chiếm 46,67% v kh ề i ố lư ng nê ợ n: 2.1 →
. Thay n - p = 4 và n’ = p’ ta có: → 0,5 hay: 4(2p + 4) = 7xp’. T ng s ổ prot ố
on trong MAx là 58 nên: p + xp’ = 58. Từ đây tìm đư c ợ : p = 26 và xp’ = 32. Do A là phi kim c
ở hu kì 3 nên 15 → p’ → 17. V y x = ậ 2 và p’ = 16 th a ỏ mãn. Vậy M là Fe và M là S. 0,5 b. Hoàn thành các phư ng t ơ rình ph n ả ng: ứ 0,5
a. 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 0,5
b. 3FeS2 + 48HNO3 → Fe(NO3)3 + Fe2(SO4)3 + 3H2SO4 + 45NO2 + 21H2O. 2.2 a. G i ọ Z là s đi ố n t ệ ích hạt nhân của X => S đi ố n t ệ ích hạt nhân c a ủ Y, R, A, B, M lần lư t ợ
(Z + 1), (Z + 2), (Z + 3), (Z + 4), (Z+5) Theo gi t ả hi t ế
Z + (Z + 1) + (Z + 2) + (Z + 3) + (Z + 4)+ (Z+5) = 63n => Z = 8 0,5 8X; 9Y; 10R; 11A; 12B, 13M (O) (F) (Ne) (Na) (Mg) (Al) M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t (c ế ó đáp án)
b. O2-, F-, Ne, Na+, Mg2+ , Al3+ đều có cấu hình e: 1s2 2s2 2p6 0,5 Số l p ớ e gi ng ố nhau =>bán kính r ph ụ thu c ộ đi n ệ tích h t ạ nhân. Đi n ệ tích h t ạ nhân càng l n t
ớ hì bán kính r càng nh . ỏ
rO2- > r F→ rNe>rNa+ > rMg2+ > rAl3+ Câu III a. 10FeSO 0,5 4 + 2KMnO4 + 16KHSO4
5Fe2(SO4)3 + 9 K2SO4 + 2MnSO4 + 8H2O 1. b. 2MnO - - - 0,5
2 + 3NO3 + 2OH - 2MnO4 + 3 NO2 + H2O 0 t 0,5 c. 10FeSO 4 + 2KMnO4 + 8H2SO4
5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O d) 0,5
-CH3 + K2Cr2O7 + 4H2SO4 CH3-CO-(CH2)4-COOH + K2SO4 + Cr2(SO4)3 + 4H2O e) 0,5
-CH2-CH=CH2 + 3K2Cr2O7 + 12H2SO4
HOOC-(CH2)3-CH(COOH)-CH2-COOH + CO2 + 3K2SO4 + 3Cr2(SO4)3 +13H2O 2. Nhi t ệ độ sôi c a ủ H2O l n ớ h n ơ r t ấ nhi u ề so v i
ớ NH3 và CH4 vì phân tử H2O và NH3 0,25
có liên kết hydrogen liên phân tử (còn CH4 không có); Do đ â ộ m đi n O ệ > N nên liên k t
ế hydrogen trong H2O bền h n ơ trong NH3 0,25
Câu IV a. + C(graphite) + O2 CO2 (g) H4 1. + H2(g) + ½ O2 H2O H3
+ CO2 (g) + 2H2O (g) CH4(g) + 2O2 (g) -H1
+ HCH4 = H4 + 2H3 - H1 = -74,7kJ/mol (Nhi t ệ t o t ạ hành chuẩn)
+ C(s) + 2H2(g) CH4 HCH4 1 C(s) C(g) : H6 H2 (g) 2H (g) H5 CH4(g) C(g) + 4H(g) ?
H CH 4−H 6−2 H 5 + Eb (C-H) = = -404,175kJ/mol. 4
b. C(graphite) + O2 CO2 (g) H4 + H2(g) + ½ O2 H2O H3
+ 2CO2 (g) + 3H2O (g) C2H6(g) + 7/2O2 (g) -H2
HC2H6 = 2H4 + 3H3 - H2 = -98,6 kJ/mol (Nhi t ệ t o t ạ hành chuẩn)
2C(s) + 3H2(g) C2H6(g) : HC2H6 1 + C(s) C(g) : H6 H2 (g) 2H (g) H5 C2H6(g) 2C(g) + 6H(g) ?
Eb(C-C) = HC2H6 - 2H6 - 3H5 -6Eb(C-H) = -344,05kJ/mol. 2.
a. Tính tạo thành chuẩn c a ủ khí CO
Cgraphit) + O2 (g) CO2 (g) H1 = - 393,77 kJ/mol
2 CO(g) + O2 (g) 2 CO2 (g) H2 = - 566,39 kJ/mol (2) 0,5 C(graphit) + ½ O2 (g) CO (g) H3 (3)
Ta có: (1) – ½ (2) (3) nên:
H3 = H1 - ½ H2 = - 110,575 kJ/mol
b. Giả sử CO có công th c ứ c u ấ t o ạ là C=O thì nhi t ệ t o ạ thành chu n ẩ c a ủ CO đư c ợ 1 tính nh s ư au:
C(graphit,s) C(g) H4 = 711,756 ½ O2(g) O(g) H5 = 494
C(g) + O(g) C=O H6 = -703,38 M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đề HSG Hóa 10 Trường THPT Quảng Oai năm 2023 có đáp án
1.4 K
700 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Tài liệu được cập nhật liên tục trong gói này từ nay đến hết tháng 3/2024. Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu Đề HSG Hóa 10 Trường THPT Quảng Oai năm 2023 có đáp án.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(1400 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 10
Xem thêmTài liệu bộ mới nhất

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có đáp án)ả ử ệ ể ế
S GIÁO D C VÀ ĐÀO T OỞ Ụ Ạ
HÀ N IỘ
TR NG THPT QU NG OAIƯỜ Ả
Đ THIỀ H C SINH GI IỌ Ỏ KH I 10Ố
NĂM H CỌ 2022 - 2023
MÔN THI: HÓA H CỌ
Th i gian làm bài: ờ 150 phút
(Đ g m có 02 trang)ề ồ
- Cho nguyên t kh i c a các nguyên t : ử ố ủ ố H=1; C=12; N=14; O=16; Na=23; Mg =24; Al=27; S=32; Cl =
35,5; K=39; Ca=40; Cr = 52; Fe = 56; Cu=64; Zn=65; Br = 80; Ag = 108; Ba=137.
- Cho bi t s hi u nguyên t c a các nguyên t : ế ố ệ ử ủ ố
1
H;
6
C;
7
N;
8
O;
10
Ne;
11
Na;
12
Mg;
13
Al;
16
S;
17
Cl;
18
Ar;
19
K;
20
Ca;
24
Cr;
26
Fe;
29
Cu;
30
Zn.
Câu I (3 đi m)ể
1) Cho ph n ng: ả ứ
+¿
Z
1
A
1
X +3 n
0
1
+năng l ngư ợ
P
94
239
u + n
0
1
→
39
91
Y ¿
(1)
(¿
1
1
H)→
Z
2
A
2
E+2( e
+1
0
)+năngl ngư ợ
4¿
(2)
a. Ch rõ ph n ng phân h ch và ph n ng nhi t h ch. ỉ ả ứ ạ ả ứ ệ ạ
b. Tìm các giá tr Aị
1
, Z
1
; A
2
; Z
2
.
2) a) Vi t công th c Lewis và xác đ nh d ng hình h c c a COế ứ ị ạ ọ ủ
2
. Xác đ nh d ng lai hóa c a nguyên tị ạ ủ ử
trung tâm.
b) Xác đ nh d ng lai hóa c a nguyên t trung tâm trong NHị ạ ủ ử
4
+
, CO
3
2-
, HNO
3
, H
2
SO
4
. PCl
5
.
Câu II. (3 đi m)ể
1) M t h p ch t có công th c là MAộ ợ ấ ứ
x
, trong đó M chi m 46,67% v kh i l ng. ế ề ố ượ M là kim lo i, A làạ
phi kim chu kì 3. Trong h t nhân c a M có n - p = 4, trong h t nhân c a A có n’ = p’. T ng sở ạ ủ ạ ủ ổ ố
proton trong MA
x
là 58.
a. Xác đ nh tên nguyên t , s kh i c a M, s th t A trong b ng tu n hoàn. ị ố ố ố ủ ố ứ ự ả ầ
b. Hoàn thành các ph ng trình hóa h c:ươ ọ
+ MX
x
+ O
2
t
0
M
2
O
3
+ XO
2
+ MX
x
+ HNO
3
t
0
M(NO
3
)
3
+ M
2
(XO
4
)
3
+ H
2
XO
4
+ NO
2
+ H
2
O
2) X, Y, R, A, B, M theo th t là 6 nguyên t liên ti p trong H th ng tu n hoàn có t ng s đ n vứ ự ố ế ệ ố ầ ổ ố ơ ị
đi n tích h t nhân là 63 (X có s đ n v đi n tích h t nhân nh nh t).ệ ạ ố ơ ị ệ ạ ỏ ấ
a. Xác đ nh s đ n v đi n tích h t nhân c a X, Y, R, A, B, M.ị ố ơ ị ệ ạ ủ
b. Vi t c u hình electron c a Xế ấ ủ
2−
, Y
−
, R, A
+
, B
2+
, M
3+
. So sánh bán kính c a chúng và gi iủ ả
thích?
Câu III. (3 đi m)ể
1) Cân b ng các ph ng trình ph n ng sau theo ph ng pháp thăng b ng electron.ằ ươ ả ứ ươ ằ
a) FeSO
4
+ KMnO
4
+ KHSO
4
Fe
2
(SO
4
)
3
+ K
2
SO
4
+ MnSO
4
+ H
2
O.
b) MnO
2
+ NO
3
-
+ OH
-
MnO
4
-
+ NO
2
-
+ H
2
O.
c. FeSO
4
+ KMnO
4
+ H
2
SO
4
0
t
Fe
2
(SO
4
)
3
+ MnSO
4
+ K
2
SO
4
+ H
2
O
d)
-CH
3
+ K
2
Cr
2
O
7
+ H
2
SO
4
CH
3
-CO-(CH
2
)
4
-COOH + K
2
SO
4
+ Cr
2
(SO
4
)
3
+ H
2
O
e)
-CH
2
-CH=CH
2
+ K
2
Cr
2
O
7
+ H
2
SO
4
HOOC-(CH
2
)
3
-CH(COOH)-CH
2
-COOH + CO
2
+
K
2
SO
4
+ Cr
2
(SO
4
)
3
+ H
2
O
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có đáp án)ả ử ệ ể ế
2) Kh i l ng mol (g/mol) c a n c, ammonia và methane l n l t b ng 18, 17, 16. N c sôi 100ố ượ ủ ướ ầ ượ ằ ướ ở
c, còn ammonia sôi – 33,35 ở
o
C và methane sôi – 161,58 ở
o
C. Gi i thích vì sao các ch t trên có kh iả ấ ố
l ng mol x p x nhau nh ng nhi t đ sôi c a chúng l i chênh l ch nhau.ượ ấ ỉ ư ệ ộ ủ ạ ệ
Câu IV. (3,5 đi m)ể
1) Tính năng l ng liên k t: C-H và C-C, cho bi t:ượ ế ế
+ Nhi t đ t cháy CHệ ố
4
: ∆H
1
= -801,7 kJ/mol. C
2
H
6
: ∆H
2
= -1412,7 kJ/mol.
+ Nhi t đ t cháy Hệ ố
2
: ∆H
3
= -241,5 kJ/mol. C(graphite): ∆H
4
= -393,4 kJ/mol.
+ E
b
H-H: ∆H
5
= 413,5 kJ/mol.
+ Nhi t hóa h i c a C(graphite): ∆Hệ ơ ủ
6
= 715,0 kJ/mol.
2) a. Tính nhi t t o thành chu n c a khí CO t nh ng d ki n th c nghi m sau:ệ ạ ẩ ủ ừ ữ ữ ệ ự ệ
C
(graphit)
+ O
2 (g)
CO
2 (g)
rH
o
1 = - 393,77 kJ/mol
2 CO
(g)
+ O
2 (g)
2 CO
2 (g)
rH
o
2 = - 566,39 kJ/mol
b. K t qu này có phù h p v i công th c c u t o c a CO n u gi thi t là C=O không? Vì sao? ế ả ợ ớ ứ ấ ạ ủ ế ả ế
Cho bi t nhi t thăng hoa c a than chì là 711,756 kJ/mol, năng l ng liên k t trong phân t Oế ệ ủ ượ ế ử
2
là 194
kJ/mol và năng năng l ng liên k t C=O trong COượ ế
2
là 703,38 kJ/mol.
Câu V. (4 đi m)ể
1) M t bình gas (khí hóa l ng) ch a h n h p propane (Cộ ỏ ứ ỗ ợ
3
H
8
) và butane (C
4
H
10
) v i t l mol 1:2. Xácớ ỉ ệ
đ nh l ng nhi t t a ra khi đ t cháy hoàn toàn 12 kg khí gas trên đi u ki n chu n.ị ượ ệ ỏ ố ở ề ệ ẩ
Cho bi t các ph n ng:ế ả ứ
C
3
H
8
(g) + 5O
2
(g)
3CO
2
(g) + 4H
2
O (l)
298
2220
o
r
H kJ
C
4
H
10
(g) +
13
2
O
2
(g)
4CO
2
(g) + 5H
2
O (l)
298
2874
o
r
H kJ
Trung bình m i ngày, m t h gia đình c n đ t gas đ cung c p 10000 kJ nhi t (hi u su t h p thỗ ộ ộ ầ ố ể ấ ệ ệ ấ ấ ụ
nhi t là 80%). ệ
a. Sau bao nhiêu ngày h gia đình trên s s d ng h t bình gas 12 kg?ộ ẽ ử ụ ế
b. Giá gas là 440.000 đ ng/bình 12 kg thì m i tháng h gia đình trên dùng h t bao nhiêu ti n gaồ ỗ ộ ế ề
(gi s 1 tháng có 30 ngày)ả ử
c. Gi thi t r ng toàn b l ng nhi t c a quá trình đ t gas t a ra đ u dùng đ làm n c nóng v iả ế ằ ộ ượ ệ ủ ố ỏ ề ể ướ ớ
hi u su t h p th nhi t kho ng 70%, hãy tính th tích khí gas ( đi u ki n chu n) c n ph i đ t đệ ấ ấ ụ ệ ả ể ở ề ệ ẩ ầ ả ố ể
làm nóng 2 lít n c t ướ ừ
o
25 C
t i ớ
o
100 C.
Bi t nhi t dung c a n c là 4,2ế ệ ủ ướ J/g.K.
2. Tính bi n thiên enthanpy c a ph n ng t o thành ammonia (s d ng năng l ng liên k t). Choế ủ ả ứ ạ ử ụ ượ ế
bi t ph n ng thu nhi t hay t a nhi t và v s đ bi u di n bi n thiên enthalpy c a ph n ng.ế ả ứ ệ ỏ ệ ẽ ơ ồ ể ễ ế ủ ả ứ (Cho
bi t năng l ng c a m t s lo i liên k t ế ượ ủ ộ ố ạ ế đi u kiên chu n: Hở ề ẩ
2
= 432; N
2
= 945; N-H = 391).
3H
2
(g) + N
2
(g)
2NH
3
(g)
Câu VI. (3,5 đi m)ể
1) M t h n h p A g m FeS2; FeS; CuS đ c hoà tan v a đ trong m t dung d ch có ch a 0,33 molộ ỗ ợ ồ ượ ừ ủ ộ ị ứ
H2SO4 đ c nóng. Thu đ c 7,28 lít SO2 (đktc) và dung d ch B. Nhúng m t thanh s t n ng 50 gamặ ượ ị ộ ắ ặ
vào dung d ch B, ph n ng xong nh c thanh s t ra đem cân th y kh i l ng thanh s t lúc này làị ả ứ ấ ắ ấ ố ượ ắ
49,48 gam và còn l i dung d ch C. Xác đ nh kh i l ng các ch t có trong A (coi l ng đ ng đ cạ ị ị ố ượ ấ ượ ồ ượ
đ y ra bám h t lên thanh s t).ẩ ế ắ
2) a) Hãy nêu các d u hi u nh m phát hi n s m đám cháy.ấ ệ ằ ệ ớ
b) Em c n làm gì khi phát hi n đám cháy?ầ ệ
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ
Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có đáp án)ả ử ệ ể ế
ĐÁP ÁN Đ THI HSG – KH I 10 – MÔN HÓAỀ Ố
Câu Đáp án Biể
u
điể
m
Câu 1
1)
1) a . (1) là ph n ng phân h ch; (2) là ph n ng nhi t h ch.ả ứ ạ ả ứ ệ ạ
b. Áp d ng đ nh lu t b o toàn đi n tích và s kh i: ụ ị ậ ả ệ ố ố
* Xét ph n ng (1)ả ứ
1 1
1 1
94 39 Z Z 55
239 1 91 A 3 A 146
* Xét ph n ng (2)ả ứ
2 2
2 2
4 2 Z Z 2
4 A A 4
0,5
0,5
2. a
- Công th c Lewis ứ CO
2
:
0,25
- D ng hình h c: Đ ng th ngạ ọ ườ ẳ 0,25
- Lai hóa sp 0,25
2.b
NH
4
+
CO
3
2-
HNO
3
H
2
SO
4
PCl
5
sp
3
sp
2
sp
2
sp
3
sp
3
d
1
M iỗ
ch tấ
0,25
Câu 2
2.1
a. Trong h p ch t MAợ ấ
x
, M chi m 46,67% v kh i l ng nên:ế ề ố ượ
→
. Thay n - p = 4 và n’ = p’ ta có:
→
hay: 4(2p + 4) = 7xp’.
0,5
T ng s proton trong MAổ ố
x
là 58 nên: p + xp’ = 58.
T đây tìm đ c: p = 26 và xp’ = 32.ừ ượ
Do A là phi kim chu kì 3 nên 15 ở
→
p’
→
17. V y x = 2 và p’ = 16 th a mãn.ậ ỏ
V y M là Fe và M là S.ậ
0,5
b. Hoàn thành các ph ng trình ph n ng:ươ ả ứ
a. 4FeS
2
+ 11O
2
→
2Fe
2
O
3
+ 8SO
2
b. 3FeS
2
+ 48HNO
3
→
Fe(NO
3
)
3
+ Fe
2
(SO
4
)
3
+ 3H
2
SO
4
+ 45NO
2
+
21H
2
O.
0,5
0,5
2.2 a. G i Z là s đi n tích h t nhân c a Xọ ố ệ ạ ủ
=> S đi n tích h t nhân c a Y, R, A, B, M l n l tố ệ ạ ủ ầ ượ
(Z + 1), (Z + 2), (Z + 3), (Z + 4), (Z+5) Theo gi thi tả ế
Z + (Z + 1) + (Z + 2) + (Z + 3) + (Z + 4)+ (Z+5) = 63n => Z = 8
8
X;
9
Y;
10
R;
11
A;
12
B,
13
M
(O) (F) (Ne) (Na) (Mg) (Al)
0,5
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có đáp án)ả ử ệ ể ế
b. O
2-
, F
-
, Ne, Na
+
, Mg
2+
, Al
3+
đ u có c u hình e: 1sề ấ
2
2s
2
2p
6
S l p e gi ng nhau =>bán kính r ph thu c đi n tích h t nhân. Đi n tích h t nhânố ớ ố ụ ộ ệ ạ ệ ạ
càng l n thì bán kính r càng nh .ớ ỏ
r
O2-
> r
F→
r
Ne
>r
Na+
> r
Mg2+
> r
Al3+
0,5
Câu III
1.
a. 10FeSO
4
+ 2KMnO
4
+ 16KHSO
4
5Fe
2
(SO
4
)
3
+ 9 K
2
SO
4
+ 2MnSO
4
+ 8H
2
O
b. 2MnO
2
+ 3NO
3
-
+ 2OH
-
2MnO
4
-
+ 3 NO
2
-
+ H
2
O
c. 10FeSO
4
+ 2KMnO
4
+ 8H
2
SO
4
0
t
5Fe
2
(SO
4
)
3
+ 2MnSO
4
+ K
2
SO
4
+ 8H
2
O
d)
-CH
3
+ K
2
Cr
2
O
7
+ 4H
2
SO
4
CH
3
-CO-(CH
2
)
4
-COOH + K
2
SO
4
+ Cr
2
(SO
4
)
3
+ 4H
2
O
e)
-CH
2
-CH=CH
2
+ 3K
2
Cr
2
O
7
+ 12H
2
SO
4
HOOC-(CH
2
)
3
-CH(COOH)-CH
2
-COOH + CO
2
+ 3K
2
SO
4
+ 3Cr
2
(SO
4
)
3
+13H
2
O
0,5
0,5
0,5
0,5
0,5
2. Nhi t đ sôi c a Hệ ộ ủ
2
O l n h n r t nhi u so v i NHớ ơ ấ ề ớ
3
và CH
4
vì phân t Hử
2
O và NH
3
có liên k t hydrogen liên phân t (còn CHế ử
4
không có);
Do đ âm đi n O > N nên liên k t hydrogen trong Hộ ệ ế
2
O b n h n trong NHề ơ
3
0,25
0,25
Câu IV
1.
a. + C(graphite) + O2 CO2 (g) H
4
+ H2(g) + ½ O2 H2O H
3
+
CO2 (g) + 2H2O (g) CH4(g) + 2O2 (g) -H
1
+ H
CH4 =
H
4
+ 2H
3
- H
1
= -74,7kJ/mol (Nhi t t o thành chu n)ệ ạ ẩ
+ C(s) + 2H2(g) CH4 H
CH4
C(s) C(g) : H
6
H2 (g) 2H (g) H
5
CH4(g) C(g) + 4H(g) ?
+ Eb (C-H) =
H CH 4−H 6−2 H 5
4
= -404,175kJ/mol.
1
b. C(graphite) + O2 CO2 (g) H
4
+ H2(g) + ½ O2 H2O H
3
+
2CO2 (g) + 3H2O (g) C2H6(g) + 7/2O2 (g) -H
2
H
C2H6 =
2H
4
+ 3H
3
- H
2
= -98,6 kJ/mol (Nhi t t o thành chu n)ệ ạ ẩ
2C(s) + 3H2(g) C2H6(g) : H
C2H6
+ C(s) C(g) : H
6
H2 (g) 2H (g) H
5
C2H6(g) 2C(g) + 6H(g) ?
Eb(C-C) = H
C2H6
- 2H
6
- 3H
5
-6Eb(C-H) = -344,05kJ/mol.
1
2. a. Tính t o thành chu n c a khí COạ ẩ ủ
C
graphit)
+ O
2 (g)
CO
2 (g)
H
1
= - 393,77 kJ/mol
2 CO
(g)
+ O
2 (g)
2 CO
2 (g)
H
2
= - 566,39 kJ/mol (2)
C
(graphit)
+ ½ O
2 (g)
CO
(g)
H
3
(3)
Ta có: (1) – ½ (2) (3) nên:
H
3
= H
1
- ½ H
2
= - 110,575 kJ/mol
0,5
b. Gi s CO có công th c c u t o là C=O thì nhi t t o thành chu n c a CO đ cả ử ứ ấ ạ ệ ạ ẩ ủ ượ
tính nh sau:ư
C
(graphit,s)
C
(g)
H
4
= 711,756
½ O
2(g)
O
(g)
H
5
= 494
C
(g)
+ O
(g)
C=O H
6
= -703,38
1
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ
Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có đáp án)ả ử ệ ể ế
C
(graphit, s)
+ ½ O
2(g)
C=O H
7
H
7
= H
4
+ H
5
+ H
6
= (711,756+ 494/2 -703,38) kJ/mol = 255,376 kJ/mol
K t qu này không phù h p v i th c t (có s khác nhau quá l n gi a ế ả ợ ớ ự ế ự ớ ữ H
3
và
H
7
).
V y công th c c u t o c a CO là C=O là không đúng. ậ ứ ấ ạ ủ
Câu V
1.
G i s mol Cọ ố
3
H
8
là a và s mol Cố
4
H
10
là 2a, ta có: 44a + 58.2a = 12.1000 a = 75
mol
Nhi t đ t cháy 12 kg gas là Q = 75.2220 + 150.2874 = 597600 (kJệ ố )
S ngày s d ng h t bình gas = ố ử ụ ế
597600
47,808 48
100
10000.
80
(ngày)
0,5
b. S tháng dùng h t 1 bình gas 12kg là: 47,808/30 ố ế
S ti n h gia đình dùng gas trong 1 tháng là 440x(30/47,808) = 276,100 đố ề ộ
1
c. L ng nhi t đ làm nóng 2 lít n c t 25ượ ệ ể ướ ừ
0
C đ n 100ế
0
C là
Q= 2000.4,2.(100 – 25) = 630.000 J = 630 kJ
L ng nhi t c n cung c p Q = 630. 100/70 = 900 kJượ ệ ầ ấ
G i s mol Cọ ố
3
H
8
là x s mol Cố
4
H
10
là 2x x. 2220+ 2x. 2874 = 900
x = 0,1129 V = 8,396 lít.
1
2. ∆
r
H
0
298
= 3×E
b
(H
2
) + E
b
(N
2
) – 2×E
b
(NH
3
)
= 3×E
b (H – H)
+ E
b (N ≡ N)
– 2×3×E
b (N – H)
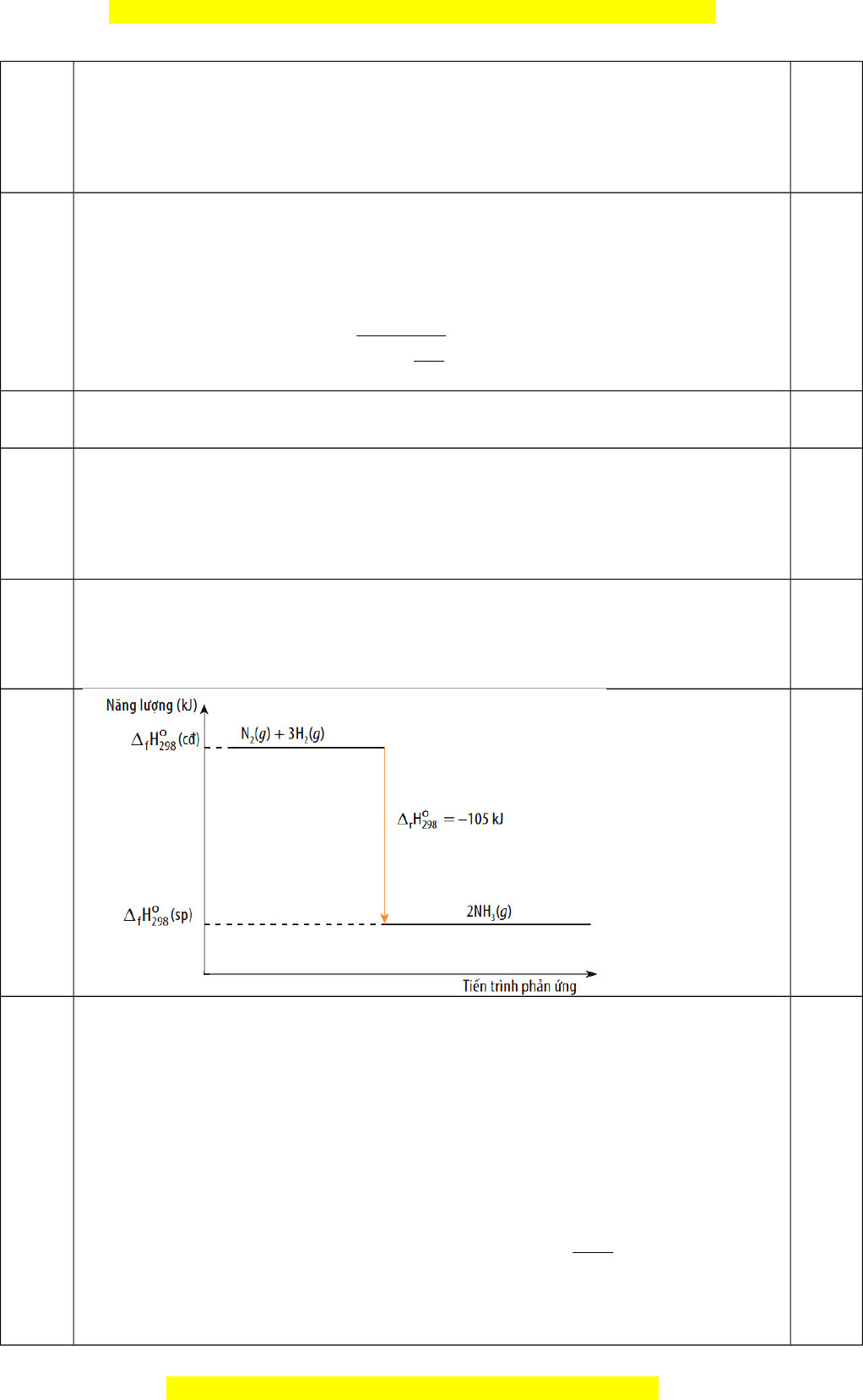
= 3×432 + 945 – 2×3×391 = –105 kJ.
Do ∆
r
H
0
298
< 0 nên ph n ng to nhi t.ả ứ ả ệ
0,5
1
Câu VI
1.
PTHH 2FeS
2
+ 14H
2
SO
4
đ cặ
o
t
Fe
2
(SO
4
)
3
+ 15SO
2
↑ + 14H
2
O
2FeS + 10H
2
SO
4
đ cặ
o
t
Fe
2
(SO
4
)
3
+ 9SO
2
↑ + 10H
2
O
CuS + 4H
2
SO
4
đ cặ
o
t
CuSO
4
+ 4SO
2
↑ + 4H
2
O
Fe + CuSO
4
→ FeSO
4
+ Cu
Fe + Fe
2
(SO
4
)
3
→ 3FeSO
4
- Đ t s mol FeSặ ố
2
, FeS và CuS l n l t là x,y,z mol.ầ ượ
- Theo bài ra và theo các pthh ta có h : ệ
7 5 4 0,33
7,28
7,5 4,5 4 0,325
22, 4
50 56(0,5 0,5 ) 64 49, 48
x y z
x y z
x y z z
- Gi i h PT ta đ c x = 0,01; y = 0,02; z = 0,04ả ệ ượ
2
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ