Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có đáp án) S Ở GD & ĐT B C Ắ GIANG Đ Ê THI CH N Ọ H C Ọ SINH GI I Ỏ VĂN HOÁ C P Ấ C S Ơ Ở C M Ụ THPT HUY N Ệ VI T Ệ YÊN NĂM HỌC 2022 - 2023
MÔN THI: HÓA HỌC - L P Ớ 10 PH Ổ THÔNG Đ C Ê HINH TH C Ư Th i
ờ gian làm bài: 120 phút, không k ể th i ờ gian giao đề (Đề thi g m ồ 04 trang)
*Ghi chú: Thí sinh không đư c ợ dùng b t ấ c t ứ ài li u ệ gì, k c ể b ả n ả g tu n ầ hoàn (Cho kh i
ố lượng mol các nguyên t : Na = 23, K ố
=39, Mg =24, Ca =40, O =16, S =32, C = 12, H = 1, Cl =35,5 25
ở 0C, 1bar thì 1 mol chất khí bất kỳ có thể tích là 24,79 lít)
-------------------------------------------------------------- Mã đề A. PH N Ầ TR C Ắ NGHI M
Ệ KHÁCH QUAN (40 cân – 14 đi m ể )
Câu 1: Cho các kim loại: Mg, Al, Fe, Cu, Zn, Ag. S ki ố m lo i ạ hoà tan đư c ợ trong dung d c ị h HCl là A. 3. B. 5. C. 4. D. 6. Câu 2: Thu c ố th đ ử phâ ể n bi t ệ các dung d c ị h đ ng t ự rong các l hoá ọ chất m t ấ nhãn bao g m ồ : HCl, HNO3, Na3PO4 là A. quỳ tím. B. H2SO4. C. AgNO3. D. phenolphtalein. Câu 3: S orbi ố tal trong m t ộ phân l p p l ớ à A. 2. B. 3. C. 1. D. 5.
Câu 4: Chất nào sau đây ch a ứ liên k t ế c ng hoá ộ tr phâ ị n c c ự ? A. Cl2. B. NaCl. C. NH3. D. O2.
Câu 5: Cho các nguyên t s ử au: 16 19 18 15 17 X; Y; Z; T; Q . T ng s ổ c ố ác nguyên tử thu c ộ cùng m t ộ nguyên tố 8 9 8 7 8 hoá h c ọ là A. 3. B. 4. C. 2. D. 5.
Câu 6: Nguyên t nguyê ử n t X ố có t ng ổ s e
ố lectron trên các phân l p ớ p là 9, s đ ố n ơ v đi ị n t ệ ích h t ạ nhân c a ủ X là A. 15. B. 12. C. 13. D. 10. Câu 7: Nguyên t P ử (Z=15) t ở rạng thái c b ơ ản có s e ố lectron đ c ộ thân là A. 3. B. 2. C. 5. D. 1.
Câu 8: Nhận xét nào sau đây sai?
A. Chu kỳ 4 có 18 nguyên tố hoá h c ọ .
B. Nguyên tố có tính kim loại m nh nh ạ t ấ là Cs.
C. Bảng tuần hoàn các nguyên tố hoá h c ọ g m
ồ có 8 nhóm A, 8 nhóm B và 16 c t ộ .
D. Bảng tuần hoàn các nguyên tố hoá h c ọ có 7 chu kỳ.
Câu 9: Nguyên t nguyê ử n t X ố (Z = 9) là nguyên tố A. p. B. d. C. f. D. s.
Câu 10: Trong công th c ứ Lewis c a ủ phân tử H2O, s c ố ặp electron hoá tr c ị h a ư tham gia liên k t ế c a ủ nguyên t t ử rung tâm là A. 1. B. 2. C. 3. D. 0.
Câu 11: Cho cấu hình electron nguyên tử c a ủ m t ộ s nguyê ố n t hoá ố h c ọ nh s ư au:
(X: 1s22s22p63s1; Y: 1s22s22p63s23p3; Z: 1s22s22p6; T: 1s22s22p63s23p1) nguyên t phi ố kim là A. Y. B. T. C. Z. D. X.
Câu 12: Chất nào sau đây không có liên k t ế hydrogen? A. NH3. B. HF. C. C2H5OH. D. CH4.
Câu 13: Cho các nguyên t :
ố K (Z = 19), N (Z = 7), Si (Z = 14), Mg (Z = 12). Dãy g m ồ các nguyên t ố đư c ợ s p x ắ p t ế heo chi u gi ề
ảm dần bán kính nguyên t t ử ừ trái sang ph i ả là A. N, Si, Mg, K. B. K, Mg, Si, N C. Mg, K, Si, N. D. K, Mg, N, Si.
Câu 14: Nguyên t nguyê ử n t R c ố ó t ng s ổ h ố t ạ cơ b n prot ả
on, neutron, electron là 28. Nh n xé ậ t nào sau đây đúng? A. Công th c
ứ oxide trong đó R có hoá trị cao nhất là R2O7.
B. R có bán kính nguyên tử l n ớ h n s ơ o v i ớ nguyên tố Cl (Z = 17). C. R có 5 electron l p ớ ngoài cùng.
D. R có tính phi kim mạnh h n O ơ . M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có đáp án)
Câu 15: Quy tắc Octet không đúng v i ớ trư ng ờ h p phâ ợ n t c ử hất nào sau đây? A. Cl2. B. H2O. C. CO2. D. NO2.
Câu 16: Chromium (Cr) có c u t ấ rúc m ng l ạ p ph ậ ư ng ơ tâm kh i ố trong đó th t ể ích các nguyên t c ử hi m ế x % thể tích tinh th , ph ể
ần còn lại là khe r ng. Cho kh ỗ i ố lư ng ợ c a ủ nguyên t Cr l ử à 52, kh i ố lư ng ợ riêng c a
ủ Cr là 7,2 g/cm3. Nếu xem nguyên t Cr c ử
ó dạng hình cầu thì bán kính gần đúng c a ủ nó là 0,125 nm. Giá trị c a ủ x là A. 69. B. 68,2. C. 75. D. 74,5
Câu 17: : Cation R2+ có cấu hình electron 1s22s22p63s23p6. V t ị rí c a
ủ nguyên tố R trong b ng t ả u n hoà ầ n các nguyên tố hóa h c ọ là
A. chu kì 4, nhóm IIA. B. chu kì 4, nhóm IA.
C. chu kì 3, nhóm VIIIA.
D. chu kì 3, nhóm VIIA. Câu 18: Trong dung d c ị h, phản ng hoá ứ h c
ọ nào sau đây không đúng?
A. 2Na + CuSO4 Na2SO4 + Cu
B. AgNO3 + NaCl AgCl + NaNO3
C. Cu(OH)2 + 2HCl CuCl2 + 2H2O
D. Fe + 2Fe(NO3)3 3Fe(NO3)2
Câu 19: Cho nguyên tử c a ủ nguyên t X ố có cấu t o nh ạ s ư au: V t ị rí c a
ủ nguyên tố X trong b ng t ả uần hoàn là
A. Ô số 5, chu kì 2, nhóm VA. B. Ô s 5, c ố hu kì 7, nhóm VIIA.
C. Ô số 7, chu kì 2, nhóm VA.
D. Ô số 7, chu kì 2, nhóm VIIA. Câu 20: S c ụ 9,916 lít CO2 ( 25 ở 0C, 1bar) vào 300 ml dung d c ị h Ca(OH)2 1M thu đư c ợ m gam k t ế t a ủ . Giá tr c ị a ủ m là A. 20. B. 25. C. 30. D. 40.
Câu 21: Cho các nguyên tố M (Z = 11), X (Z = 8), Y (Z = 9), R (Z = 12). Bán kính ion M+, X2, Y, R2+ đư c ợ s p x ắ p t ế heo th t
ứ ự tăng dần từ trái sang phải là
A. M+, Y, R2+, X2.
B. R2+, M+, Y, X2.
C. R2+, M+, X2, Y.
D. X2 , Y, M+, R2+.
Câu 22: Krypton là m t ộ trong nh ng khí ữ hi m ế đư c ợ ng ứ d ng t ụ rong chi u ế và nhi p ế nh. Á ả nh sáng c a ủ Krypton có nhi u d ề ải ph , do đó nó đ ổ ư c ợ s d ử ng nhi ụ u l ề àm tia laser có m c ứ năng lư ng ợ cao. Quan sát biểu thị phổ kh i ố c a ủ Krypton. Nguyên tử kh i ố c a ủ Krypton là A. 85,888. B. 83,888. C. 84,888. D. 82,888.
Câu 23: Sulfur (S) là nguyên t t ố hu c ộ nhóm VIA, chu kì 3 c a ủ b ng ả tu n
ầ hoàn. Trong các phát bi u s ể au: (1) Nguyên tử S có 3 l p e ớ lectron và có 10 electron p.
(2) Nguyên tử S có 5 electron hóa trị và 6 lectron s. (3) Công th c ứ oxide cao nhất c a ủ S có d ng S ạ O3 và là acidic oxide.
(4) Nguyên tố S có tính phi kim m nh h ạ n s ơ o v i ớ nguyên t c ố ó s hi ố u ệ nguyên t l ử à 8. (5) Hydroxide cao nhất c a ủ S có d ng H ạ
2SO4 và có tính acid mạnh h n a ơ cid HClO4. S phá ố t biểu đúng là A. 5. B. 2. C. 4. D. 3. Câu 24: Dãy g m
ồ các phân tử đều có liên kết ion là (Cho đ â ộ m đi n c ệ a ủ Na = 0,93; K = 0,82; Al =
1,61; Mg = 1,31 Cl = 3,16; O = 3,44; S =2,58; P = 2,19; H = 2,2)
A. AlCl3, K2S, NaCl, Na2O.
B. MgO, H2SO4, H3PO4, HCl. M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có đáp án) C. Cl2, Br2, I2, HCl.
D. Na2O, KCl, BaCl2, Al2O3.
Câu 25: Cho 6,4 gam h n ỗ h p X ợ g m ồ Mg và Fe tác d ng v ụ i ớ dung d c ị h HCl d t ư hu đư c ợ 4,958 lít khí H2 ( 25 ở 0C, 1bar). % kh i ố lư ng ợ Mg trong h n ỗ h p l ợ à A. 66,67%. B. 33,33%. C. 43,75%. D. 56,25%.
Câu 26: X, Y là hai nguyên t t ố hu c ộ m t ộ nhóm A và ha ở i chu kỳ liên ti p, ế t ng s ổ prot ố on trong hai h t ạ nhân c a ủ X, Y là 22. Công th c ứ hydroxide c a ủ X là A. H3XO4. B. X2O5. C. HXO3. D. H3XO3. Câu 27: X đư c
ợ dùng làm chất bán dẫn trong kĩ thuật vô tuy n đi ế n, c ệ hế tạo pin mặt tr i ờ . Nguyên t ử c a ủ nguyên tố X có 3 l p ớ electron. L p
ớ ngoài cùng có 4 electron. C u hì ấ nh electron c a ủ X là A. 1s22s22p63s23p3. B. 1s22s22p63s23p2. C. 1s22s22p53s23p4. D. 1s22s22p63s23p5. Câu 28: Nguyên t c ử a ủ nguyên tố X có t ng ổ s h ố ạt c b
ơ ản (proton, neutron, electron) là 58, trong đó s h ố ạt mang đi n g ệ ấp 1,9 lần s h ố ạt không mang đi n. ệ Ở trạng thái c b ơ ản, s orbi ố tal c a ủ X có ch a ứ các electron là A. 9. B. 8. C. 11. D. 10. Câu 29: Năng lư ng ợ liên k t ế c a
ủ các hydrogen halide đư c ợ li t ệ kê trong b ng s ả au Chất HF HCl HBr HI Năng lư n ợ g liên k t (k ế J/mol) 565 427 363 295 Thứ t c ự hiều tăng dần đ b ộ ền liên k t ế trong các phân tử là
A. HI < HBr < HCl < HF.
B. HF < HCl < HBr < HI.
C. HI < HBr < HF < HCl.
D. HF < HCl < HI < HBr.
Câu 30: X, R, Y là nh ng nguyê ữ n tố hoá h c ọ có s đ ố n v ơ
ị điện tích hạt nhân tư ng ơ ng l ứ à 9, 19, 8. Công th c ứ và loại liên k t ế hoá h c ọ có th c ể ó gi a ữ các c p X ặ và R, R và Y, X và Y là A. RX, liên k t ế c ng hoá ộ tr . ị B. R2Y , liên k t ế c ng hoá ộ tr . ị C. YX2 , liên k t ế c ng ộ hoá tr .ị D. Y2X , liên k t ế c ng ộ hoá tr .ị
Câu 31: Cho các chất sau: Na2O; CaO; SO2; SO3, CO; N2O5; P2O5; NO; O2. S c ố hất tan đư c ợ trong nư c ớ tạo dung d c
ị h làm cho quỳ tím chuy n s
ể ang màu đỏ hoặc màu h ng l ồ à A. 6. B. 5. C. 7. D. 4.
Câu 32: Cho 20 ml dung d c
ị h AgNO3 1M (D = 1,1 g/ml) vào 150 ml dung d c ị h HCl 0,5M (D= 1,05 g/ml). T ng ổ n ng đ ồ ộ % c a ủ các chất trong dung d c ị h sau ph n ả ng l ứ à A. 3,42%. B. 3,47%. C. 0,71%. D. 1,85%. Câu 33: So sánh nhi t ệ đ s ộ ôi và nhi t ệ độ nóng ch y nà ả o sau đây v 2 c ề h t ấ sau là đúng ? A. Chất (1) có nhi t ệ đ s ộ ôi cao và nhi t ệ đ nóng c ộ h y h ả n ơ ch t ấ (2) B. Chất (1) có nhi t ệ đ s ộ ôi cao h n ơ ch t ấ (2) nh ng ư ch t ấ (2) có nhi t ệ đ nóng c ộ h y t ả h p h ấ n ơ ch t ấ (1). C. Chất (1) có nhi t ệ đ s ộ ôi th p h ấ n c ơ h t ấ (2) và ch t ấ (2) có nhi t ệ đ nóng c ộ h y c ả ao h n c ơ h t ấ (1). D. Chất (1) có nhi t ệ đ s ộ ôi và nhi t ệ đ nóng c ộ h y t ả h p h ấ n c ơ h t ấ (2). Câu 34: H p c ợ hất X có công th c
ứ AxB2 (A là kim loại B là phi kim). Bi t ế trong nguyên t B c ử ó s ố neutron nhiều h n prot ơ on là 10, trong nguyên t ử A s e ố lectron b ng s ằ ố neutron, trong 1 phân t ử AxB2 có t ng ổ s prot ố
on bằng 82, phần trăm kh i ố lư ng ợ c a ủ B trong X b ng 86,957%. S ằ kh ố i ố c a ủ nguyên t B ử trừ đi s kh ố i ố c a ủ nguyên tử A bằng A. 56. B. 24. C. 15. D. 11,5.
Câu 35: Cho 2,13 gam h n ỗ h p
ợ X gồm ba kim loại Mg, Cu và Al ở dạng b t
ộ tác dụng hoàn toàn v i ớ oxi thu được h n ỗ h p ợ Y gồm các oxit có kh i
ố lượng 3,33 gam. Thể tích dung dịch HCl 2M v a ừ đủ để phản ng h ứ ết v i ớ Y là A. 90 ml. B. 57 ml. C. 50 ml. D. 75 ml.
Câu 36: Để tính tu i ổ c a ủ các m u v ẫ t ậ (t), ngư i ờ ta d a ự vào phư ng t ơ rình M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có đáp án) Ví i t lµ tuæ i cña mÉu vËt cÇn tÝnh 1 N0 t ln N lµ sè h¹ t nh©
n ban ®Çu sè h¹t nh©n cña mÉu vËt sèn g øn
g ví i khèi l î ng mÉu vËt xÐt 0 k
Nt N lµ sè h¹t nh©n cña mÉu vËt t¹i thêi ®iÓm ®ang cÇn tÝnh tuæi. t
k là hằng số phóng xạ , biểu th c ứ tính k. ln 2 k (t ờ ể ố ạ ầ ộ ử t
1/2 là chu kỳ bán rã (th i gian đ phân rã s h t nhân ban đ u thành m t n a) 1/2 M t ộ mẫu than gỗ l y ấ từ hang đ ng
ộ ở vùng núi đá vôi t nh
ỉ Hoà Bình có 9,4 phân huỷ 14C. Bi t ế chu kỳ bán huỷ c a
ủ 14C là 5730 năm, trong khí quy n
ể có 15,3 phân huỷ 14C (các số phân huỷ đ u ề đư c ợ tính v i ớ 1 gam C x y
ả ra trong 1 giây). Hãy cho bi t ế ngư i ờ Vi t ệ c ổ đ i ạ đã t o ạ ra m u ẫ than đó cách đây bao nhiêu năm? A. 4270,4 năm. B. 4027,04 năm. C. 4270,9 năm. D. 4027,9 năm.
Câu 37: Cho X, Y, Z, R, T là năm nguyên tố liên ti p ế nhau trong b ng ả tu n ầ hoàn các nguyên t ố hoá h c ọ có t ng s ổ đ ố n ơ v đi ị n t
ệ ích hạt nhân là 90 (X có s đ ố n v ơ ị đi n t ệ ích h t ạ nhân nh nh ỏ t ấ ). Phát bi u nà ể
o sau đây không đúng khi nói về các hạt (nguyên tử và ion)?
A. Các hạt X2 , Y, Z , R+ , T2+ có cùng cấu hình electron 1s22s22p63s23p6. B. Công th c ứ oxide c a
ủ Y hoá trị cao nhất v i ớ oxygen là Y2O7.
C. Bán kính các hạt giảm: X2 > Y > Z > R+ > T2+ .
D. Bán kính nguyên t c ử a ủ T l n ớ h n bá ơ n kính nguyên t c ử a ủ R.
Câu 38: Hai nguyên tố X và Y cùng m t
ộ chu kì trong bảng tuần hoàn các nguyên tố hóa h c ọ , X thu c ộ nhóm IIA, Y thu c
ộ nhóm IIIA (ZX + ZY = 51). Phát bi u nà ể o sau đây đúng ? A. nhi Ở ệt đ t ộ hư ng ờ X không tác d ng ụ đư c ợ H2O.
B. Kim loại X không kh đ ử ư c ợ ion Fe2+ trong dung d c ị h.
C. Cấu hình electron nguyên tử X là [Ar]3d54s2. D. H p c ợ hất v i ớ oxi c a ủ X có dạng X2O7. Câu 39: Nguyên t ử Y có hóa tr c ị ao nhất v i
ớ oxygen gấp 3 lần hóa trị trong h p c ợ hất khí v i ớ hydrogen. G i ọ X là công th c ứ oxide ng ứ v i ớ hóa tr c ị ao nh t ấ , Z là công th c ứ h p c ợ h t ấ khí c a ủ Y v i ớ hydrogen. T ỉ kh i ố h i ơ c a ủ X đ i ố v i ớ Z là 2,353. Nh n xé ậ t nào sau đây đúng
A. X có Vsepr là YO2E.
B. X có mô hình phân tử dạng tam giác, góc liên k t ế OYO là 1200.
C. Trong phân tử X, nguyên t ử Y t ở rạng thái lai hoá sp3. D. Trong công th c ứ Lewis c a ủ Z, nguyên t ử Y còn 1 c p e ặ lectron hoá tr t ị do. ự
Câu 40: Phân rã tự nhiên 232Th tạo ra đ ng ồ v b ị n ề 208Pb , đ ng ồ th i ờ giải phóng m t ộ s h ố t ạ α và β. S ố 90 82 hạt α và β (β là h t
ạ 0e ) cho quá trình phân rã m t
ộ hạt nhân 232Th lần lư t ợ là 1 90 A. 6; 8. B. 6; 4. C. 8; 6. D. 8; 4. B. PH N Ầ T LU Ự N
Ậ (3 cân – 6 điểm)
Câu 41: (2,5 điểm) Phân tử M đư c ợ t o
ạ thành từ 5 nguyên tử c a
ủ hai nguyên tố Y và R t o ạ nên (S ố hi u ệ nguyên t ử Y nhỏ h n c ơ a ủ R). T ng ổ s h ố t ạ mang đi n t ệ rong phân t M ử là 20. 1. Xác đ nh ị công th c ứ phân tử M. 2. Viết công th c ứ electron, công th c ứ Lewis, công th c ứ Vsepr và bi u ể di n ễ quá trình lai hoá các
orbital tạo thành phân tử M. 3. M có thể t o ạ đư c ợ liên k t ế hydrogen hay không, t i ạ sao? So sánh có gi i ả thích nhi t ệ đ ộ sôi c a ủ M so v i ớ H2O.
Câu 42: (2 điểm)
1. Nguyên tố Copper (đ ng) ồ có hai đ ng ồ v ị b n l
ề à 63Cuvà A Cu, nguyên t ử kh i ố trung bình c a ủ Cu là 29 29 63,54. Trong CuSO 63 4.5H2O đ ng
ồ vị Cuchiếm 18,43% về kh i ố lư ng. ợ Xác đ nh ị s kh ố i ố A c a ủ đ ng ồ vị 29 còn lại, vi t
ế cấu hình electron nguyên tử Cu và cho biết v t ị rí c a ủ Cu trong b ng t ả u n hoà ầ n. 2. Nhúng m t ộ thanh s t ắ (iron) có kh i ố lư ng
ợ 100 gam vào 200 gam dung d c ị h CuSO4 1M đ n ế khi dung d c ị h h t ế màu xanh thì nh c ấ thanh s t ắ ra r a ử s c ạ h, cân l i ạ th y ấ kh i ố lư ng ợ thanh s t ắ n ng ặ m gam. Tính m. M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đề HSG Hóa 10 Trường THPT Việt Yên năm 2023 có đáp án
846
423 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Tài liệu được cập nhật liên tục trong gói này từ nay đến hết tháng 3/2024. Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu Đề HSG Hóa 10 Trường THPT Việt Yên năm 2023 có đáp án.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(846 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 10
Xem thêmTài liệu bộ mới nhất
ả ử ệ ể ế
Ở ! "#$%Ắ
" & '( ')* %+# *,%Ụ Ệ Ệ
"'-%' ' "Ê Ư
(Đ thi g m 0ề ồ 4 trang)
'#"' %' "#%'# #+.%'/0" (" Ê Ọ Ọ Ỏ Ấ Ơ Ở
%.&' "121131214Ọ
&5% '#6'7$' "38 (92(' '5%Ọ Ớ Ổ
Th i gian làm bài: 120 phút, không k th i gian giao đờ ể ờ ề
*Ghi chú: Thí sinh không đ c dùng b t c tài li u gì, k c b ng tu n hoànượ ấ ứ ệ ể ả ả ầ
(Cho kh i l ng mol các nguyên t : Na = 23, K=39, Mg =24, Ca =40, O =16, S =32, C = 12, H = 1, Cl =35,5ố ượ ố
25ở
0
C, 1bar thì 1 mol ch t khí b t kỳ có th tích là 24,79 lít)ấ ấ ể
--------------------------------------------------------------
$:(' % ; "%'# &<'0"'=)$%Ầ Ắ Ệ (40 cân – 14 đi m)ể
"96Cho các kim lo i: Mg, Al, Fe, Cu, Zn, Ag. S kim lo i hoà tan đ c trong dung d ch HCl làạ ố ạ ượ ị
$:3. !:5. ":4. :6.
"16Thu c th đ phân bi t các dung d ch đ ng trong các l hoá ch t m t nhãn bao g m: HCl, ố ử ể ệ ị ự ọ ấ ấ ồ
HNO
3
, Na
3
PO
4
là
$:quỳ tím. !:H
2
SO
4
. ":AgNO
3
. :phenolphtalein.
"46S orbital trong m t phân l p p làố ộ ớ
$:2. !:3. ":1. :5.
">6Ch t nào sau đây ch a liên k t c ng hoá tr phân c c?ấ ứ ế ộ ị ự
$:Cl
2
. !:NaCl. ":NH
3
. :O
2
.
"?6Cho các nguyên t sau: ử
16 19 18 15 17
8 9 8 7 8
X; Y; Z; T; Q
. T ng s các nguyên t thu c cùng m t nguyên tổ ố ử ộ ộ ố
hoá h c làọ
$:3. !:4. ":2. :5.
"@6Nguyên t nguyên t X có t ng s electron trên các phân l p p là 9, s đ n v đi n tích h t ử ố ổ ố ớ ố ơ ị ệ ạ
nhân c a X làủ
$:15. !:12. ":13. :10.
"A6Nguyên t P (Z=15) tr ng thái c b n có s electron đ c thân làử ở ạ ơ ả ố ộ
$:3. !:2. ":5. :1.
"B6Nh n xét nào sau đây ậ C?
$:Chu kỳ 4 có 18 nguyên t hoá h c.ố ọ
!:Nguyên t có tính kim lo i m nh nh t là Cs.ố ạ ạ ấ
":B ng tu n hoàn các nguyên t hoá h c g m có 8 nhóm A, 8 nhóm B và 16 c t.ả ầ ố ọ ồ ộ
:B ng tu n hoàn các nguyên t hoá h c có 7 chu kỳ.ả ầ ố ọ
"D6Nguyên t nguyên t X (Z = 9) là nguyên tử ố ố
$:p. !:d. ":f. :s.
"926Trong công th c Lewis c a phân t Hứ ủ ử
2
O, s c p electron hoá tr ch a tham gia liên k t c a ố ặ ị ư ế ủ
nguyên t trung tâm làử
$:1. !:2. ":3. :0.
"996Cho c u hình electron nguyên t c a m t s nguyên t hoá h c nh sau:ấ ử ủ ộ ố ố ọ ư
(X: 1s
2
2s
2
2p
6
3s
1
; Y: 1s
2
2s
2
2p
6
3s
2
3p
3
;
Z: 1s
2
2s
2
2p
6
; T: 1s
2
2s
2
2p
6
3s
2
3p
1
)
nguyên t phi kim làố
$:Y. !:T. ":Z. :X.
"916Ch t nào sau đây không có liên k t hydrogen?ấ ế
$:NH
3
. !:HF. ":C
2
H
5
OH. :CH
4
.
"946Cho các nguyên t : K (Z = 19), N (Z = 7), Si (Z = 14), Mg (Z = 12). Dãy g m các nguyên t ố ồ ố
đ c s p x p theo chi u gi m d n bán kính nguyên t t trái sang ph i làượ ắ ế ề ả ầ ử ừ ả
$:N, Si, Mg, K. !:K, Mg, Si, N ":Mg, K, Si, N. :K, Mg, N, Si.
"9>6Nguyên t nguyên t R có t ng s h t c b n proton, neutron, electron là 28. Nh n xét nào sauử ố ổ ố ạ ơ ả ậ
đây đúng?
$:Công th c oxide trong đó R có hoá tr cao nh t là Rứ ị ấ
2
O
7
.
!:R có bán kính nguyên t l n h n so v i nguyên t Cl (Z = 17).ử ớ ơ ớ ố
":R có 5 electron l p ngoài cùng.ớ
:R có tính phi kim m nh h n O.ạ ơ
& E F62B>1B4>?B?ọ ắ ắ ệ
&G ề
ả ử ệ ể ế
"9?6Quy t c Octet ắ HI đúng v i tr ng h p phân t ch t nào sau đây?ớ ườ ợ ử ấ
$:Cl
2
. !:H
2
O. ":CO
2
. :NO
2
.
"9@6Chromium (Cr) có c u trúc m ng l p ph ng tâm kh i trong đó th tích các nguyên t chi m ấ ạ ậ ươ ố ể ử ế
x % th tích tinh th , ph n còn l i là khe r ng. Cho kh i l ng c a nguyên t Cr là 52, kh i l ng ể ể ầ ạ ỗ ố ượ ủ ử ố ượ
riêng c a Cr là 7,2 g/cmủ
3
. N u xem nguyên t Cr có d ng hình c u thì bán kính g n đúng c a nó là ế ử ạ ầ ầ ủ
0,125 nm. Giá tr c a x làị ủ
$:69. !:68,2. ":75. :74,5
"9A66 Cation R
2+
có c u hình electron 1sấ
2
2s
2
2p
6
3s
2
3p
6
. V trí c a nguyên t R trong b ng tu n hoàn ị ủ ố ả ầ
các nguyên t hóa h c làố ọ
$:chu kì 4, nhóm IIA. !:chu kì 4, nhóm IA.
":chu kì 3, nhóm VIIIA. :chu kì 3, nhóm VIIA.
"9B6Trong dung d ch, ph n ng hoá h c nào sau đây ị ả ứ ọ HIđúng?
$:2Na + CuSO
4
Na
2
SO
4
+ Cu !:AgNO
3
+ NaCl
AgCl + NaNO
3
":Cu(OH)
2
+ 2HCl
CuCl
2
+ 2H
2
O :Fe + 2Fe(NO
3
)
3
3Fe(NO
3
)
2
"9D6Cho nguyên t c a nguyên t X có c u t o nh sau:ử ủ ố ấ ạ ư
V trí c a nguyên t X trong b ng tu n hoàn làị ủ ố ả ầ
$:Ô s 5, chu kì 2, nhóm VA.ố !:Ô s 5, chu kì 7, nhóm VIIA.ố
":Ô s 7, chu kì 2, nhóm VA.ố :Ô s 7, chu kì 2, nhóm VIIA.ố
"126S c 9,916 lít COụ
2
( 25ở
0
C, 1bar) vào 300 ml dung d ch Ca(OH)ị
2
1M thu đ c m gam k t t a. ượ ế ủ
Giá tr c a m làị ủ
$:20. !:25. ":30. :40.
"196Cho các nguyên t M (Z = 11), X (Z = 8), Y (Z = 9), R (Z = 12). Bán kính ion Mố
+
, X
2
, Y
, R
2+
đ c s p x p theo th t tăng d n t trái sang ph i làượ ắ ế ứ ự ầ ừ ả
$:M
+
, Y
, R
2+
, X
2
. !:R
2+
, M
+
, Y
, X
2
. ":R
2+
, M
+
, X
2
, Y
. :X
2
, Y
, M
+
, R
2+
.
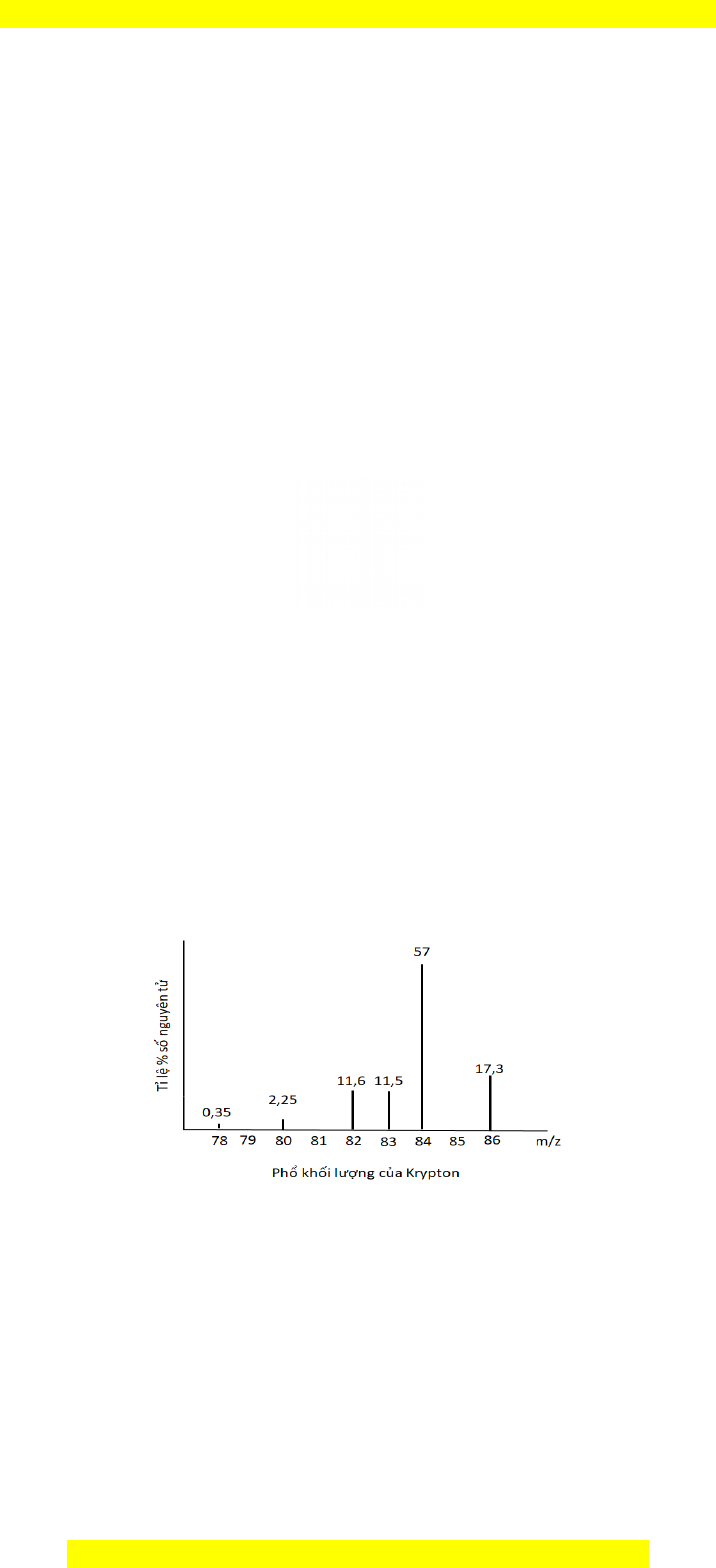
"116Krypton là m t trong nh ng khí hi m đ c ng d ng trong chi u và nhi p nh. Ánh sáng c aộ ữ ế ượ ứ ụ ế ế ả ủ
Krypton có nhi u d i ph , do đó nó đ c s d ng nhi u làm tia laser có m c năng l ng cao. Quan sátề ả ổ ượ ử ụ ề ứ ượ
bi u th ph kh i c a Krypton.ể ị ổ ố ủ
Nguyên t kh i c a Krypton làử ố ủ
$:85,888. !:83,888. ":84,888. :82,888.
"146
Sulfur (S) là nguyên t thu c nhóm VIA, chu kì 3 c a b ng tu n hoàn. Trong các phát bi u sau:ố ộ ủ ả ầ ể
(1) Nguyên t S có 3 l p electron và có 10 electron p.ử ớ
(2) Nguyên t S có 5 electron hóa tr và 6 lectron s.ử ị
(3) Công th c oxide cao nh t c a S có d ng SOứ ấ ủ ạ
3
và là acidic oxide.
(4) Nguyên t S có tính phi kim m nh h n so v i nguyên t có s hi u nguyên t là 8.ố ạ ơ ớ ố ố ệ ử
(5) Hydroxide cao nh t c a S có d ng Hấ ủ ạ
2
SO
4
và có tính acid m nh h n acid HClOạ ơ
4
.
S phát bi u đúng làố ể
$:5. !:2. ":4. :3.
"1>6Dãy g m các phân t đ u có liên k t ion là (Cho đ âm đi n c a Na = 0,93; K = 0,82; Al = ồ ử ề ế ộ ệ ủ
1,61; Mg = 1,31 Cl = 3,16; O = 3,44; S =2,58; P = 2,19; H = 2,2)
$:AlCl
3
, K
2
S, NaCl, Na
2
O. !:MgO, H
2
SO
4
, H
3
PO
4
, HCl.
& E F62B>1B4>?B?ọ ắ ắ ệ

ả ử ệ ể ế
":Cl
2
, Br
2
, I
2
, HCl. :Na
2
O, KCl, BaCl
2
, Al
2
O
3
.
"1?6Cho 6,4 gam h n h p X g m Mg và Fe tác d ng v i dung d ch HCl d thu đ c 4,958 lít khí ỗ ợ ồ ụ ớ ị ư ượ
H
2
( 25ở
0
C, 1bar). % kh i l ng Mg trong h n h p làố ượ ỗ ợ
$:66,67%. !:33,33%. ":43,75%. :56,25%.
"1@6X, Y là hai nguyên t thu c m t nhóm A và hai chu kỳ liên ti p, t ng s proton trong hai h t ố ộ ộ ở ế ổ ố ạ
nhân c a X, Y là 22. Công th c hydroxide c a X làủ ứ ủ
$:H
3
XO
4
. !:X
2
O
5
. ":HXO
3
. :H
3
XO
3
.
"1A6X đ c dùng làm ch t bán d n trong kĩ thu t vô tuy n đi n, ch t o pin m t tr i. Nguyên t ượ ấ ẫ ậ ế ệ ế ạ ặ ờ ử
c a nguyên t X có 3 l p electron. L p ngoài cùng có 4 electron. C u hình electron c a X làủ ố ớ ớ ấ ủ
$:1s
2
2s
2
2p
6
3s
2
3p
3
. !:1s
2
2s
2
2p
6
3s
2
3p
2
. ":1s
2
2s
2
2p
5
3s
2
3p
4
. :1s
2
2s
2
2p
6
3s
2
3p
5
.
"1B6Nguyên t c a nguyên t X có t ng s h t c b n (proton, neutron, electron) là 58, trong đó ử ủ ố ổ ố ạ ơ ả
s h t mang đi n g p 1,9 l n s h t không mang đi n. tr ng thái c b n, s orbital c a X có ch a ố ạ ệ ấ ầ ố ạ ệ Ở ạ ơ ả ố ủ ứ
các electron là
$:9. !:8. ":11. :10.
"1D6Năng l ng liên k t c a các hydrogen halide đ c li t kê trong b ng sauượ ế ủ ượ ệ ả
" ấ HF HCl HBr HI
%J EH HKLFượ ế 565 427 363 295
Th t chi u tăng d n đ b n liên k t trong các phân t làứ ự ề ầ ộ ề ế ử
$:HI < HBr < HCl < HF. !:HF < HCl < HBr < HI.
":HI < HBr < HF < HCl. :HF < HCl < HI < HBr.
"426X, R, Y là nh ng nguyên t hoá h c có s đ n v đi n tích h t nhân t ng ng là 9, 19, 8. ữ ố ọ ố ơ ị ệ ạ ươ ứ
Công th c và lo i liên k t hoá h c có th có gi a các c p X và R, R và Y, X và Y làứ ạ ế ọ ể ữ ặ
$:RX, liên k t c ng hoá tr .ế ộ ị !:R
2
Y , liên k t c ng hoá tr .ế ộ ị
":YX
2
, liên k t c ng hoá tr .ế ộ ị :Y
2
X , liên k t c ng hoá tr .ế ộ ị
"496Cho các ch t sau: Naấ
2
O; CaO; SO
2
; SO
3
, CO; N
2
O
5
; P
2
O
5
; NO; O
2
. S ch t tan đ c trong ố ấ ượ
n c t o dung d ch làm cho quỳ tím chuy n sang màu đ ho c màu h ng làướ ạ ị ể ỏ ặ ồ
$:6. !:5. ":7. :4.
"416Cho 20 ml dung d ch AgNOị
3
1M (D = 1,1 g/ml) vào 150 ml dung d ch HCl 0,5M (D= 1,05 ị
g/ml). T ng n ng đ % c a các ch t trong dung d ch sau ph n ng làổ ồ ộ ủ ấ ị ả ứ
$:3,42%. !:3,47%. ":0,71%. :1,85%.
"446So sánh nhi t đ sôi và nhi t đ nóng ch y nào sau đây v 2 ch t sau là đúng ?ệ ộ ệ ộ ả ề ấ
$:Ch t (1) có nhi t đ sôi cao và nhi t đ nóng ch y h n ch t (2)ấ ệ ộ ệ ộ ả ơ ấ
!:
Ch t (1) có nhi t đ sôi cao h n ch t (2) nh ng ch t (2) có nhi t đ nóng ch y th p h n ch t (1).ấ ệ ộ ơ ấ ư ấ ệ ộ ả ấ ơ ấ
":Ch t (1) có nhi t đ sôi th p h n ch t (2) và ch t (2) có nhi t đ nóng ch y cao h n ch t (1).ấ ệ ộ ấ ơ ấ ấ ệ ộ ả ơ ấ
:Ch t (1) có nhi t đ sôi và nhi t đ nóng ch y th p h n ch t (2).ấ ệ ộ ệ ộ ả ấ ơ ấ
"4>6H p ch t X có công th c Aợ ấ ứ
x
B
2
(A là kim lo i B là phi kim). Bi t trong nguyên t B có s ạ ế ử ố
neutron nhi u h n proton là 10, trong nguyên t A s electron b ng s ề ơ ử ố ằ ố neutron, trong 1 phân t Aử
x
B
2
có
t ng s proton b ng 82, ph n trăm kh i l ng c a B trong X b ng 86,957%. S kh i c a nguyên t Bổ ố ằ ầ ố ượ ủ ằ ố ố ủ ử
tr đi s kh i c a nguyên t A b ngừ ố ố ủ ử ằ
$:56. !:24. ":15. :11,5.
"4?6Cho 2,13 gam h nỗ h pợ X gồm ba kim lo iạ Mg, Cu và Al ở d ngạ b tộ tác dụng hoàn toàn v i ớ
oxi thu được h nỗ h pợ Y gồm các oxit có kh iố lượng 3,33 gam. Thể tích dung dịch HCl 2M v aừ đủ để
ph n ng h t v i Y làả ứ ế ớ
$:90 ml. !:57 ml. ":50 ml. :75 ml.
"4@6Đ tính tu i c a các m u v t (t), ng i ta d a vào ph ng trìnhể ổ ủ ẫ ậ ườ ự ươ
& E F62B>1B4>?B?ọ ắ ắ ệ

ả ử ệ ể ế
0
t
0
t
N
1
t ln
k N
Ví i t lµ tuæi cña mÉu vËt cÇn tÝnh
N lµ sè h¹t nh©n ban ®Çu sè h¹t nh©n cña mÉu vËt sèng øng ví i khèi l î ng mÉu vËt xÐt
N lµ sè h¹t nh©n cña mÉu vËt t¹i thêi ®iÓm ®ang cÇn tÝnh tuæi.
k là h ng s phóng x , bi u th c tính k.ằ ố ạ ể ứ
1/2
ln 2
k
t
(t
1/2
là chu kỳ bán rã (th i gian đ phân rã s h t nhân ban đ u thành m t n a)ờ ể ố ạ ầ ộ ử
M t m u than g l y t hang đ ng vùng núi đá vôi t nh Hoà Bình có 9,4 phân hu ộ ẫ ỗ ấ ừ ộ ở ỉ ỷ
14
C. Bi tế
chu kỳ bán hu c a ỷ ủ
14
C là 5730 năm, trong khí quy n có 15,3 phân hu ể ỷ
14
C (các s phân hu đ u đ cố ỷ ề ượ
tính v i 1 gam C x y ra trong 1 giây). Hãy cho bi t ng i Vi t c đ i đã t o ra m u than đó cách đâyớ ả ế ườ ệ ổ ạ ạ ẫ
bao nhiêu năm?
$:4270,4 năm. !:4027,04 năm. ":4270,9 năm. :4027,9 năm.
"4A6Cho X, Y, Z, R, T là năm nguyên t liên ti p nhau trong b ng tu n hoàn các nguyên t hoá h cố ế ả ầ ố ọ
có t ng s đ n v đi n tích h t nhân là 90 (X có s đ n v đi n tích h t nhân nh nh t). ổ ố ơ ị ệ ạ ố ơ ị ệ ạ ỏ ấ
Phát bi u nào sau đây ể HIđúng khi nói v các h t (nguyên t và ion)?ề ạ ử
$:Các h t Xạ
2
, Y
, Z , R
+
, T
2+
có cùng c u hình electron ấ
1s
2
2s
2
2p
6
3s
2
3p
6
.
!:Công th c oxide c a Y hoá tr cao nh t v i oxygen là Yứ ủ ị ấ ớ
2
O
7.
":Bán kính các h t gi m: Xạ ả
2
> Y
> Z > R
+
> T
2+
.
:Bán kính nguyên t c a T l n h n bán kính nguyên t c a R.ử ủ ớ ơ ử ủ
"4B6Hai nguyên t X và Y cùng m t chu kì trong b ng tu n hoàn các nguyên t hóa h c, X thu c ố ộ ả ầ ố ọ ộ
nhóm IIA, Y thu c nhóm IIIA (Zộ
X
+ Z
Y
= 51). Phát bi u nào sau đây đúng ?ể
$: nhi t đ th ng X không tác d ng đ c HỞ ệ ộ ườ ụ ượ
2
O.
!:Kim lo i X không kh đ c ion Feạ ử ượ
2+
trong dung d ch.ị
":C u hình electron nguyên t X là [Ar]3dấ ử
5
4s
2
.
:H p ch t v i oxi c a X có d ng Xợ ấ ớ ủ ạ
2
O
7
.
"4D6Nguyên t Y có hóa tr cao nh t v i oxygen g p 3 l n hóa tr trong h p ch t khí v i hydrogen.ử ị ấ ớ ấ ầ ị ợ ấ ớ
G i X là công th c oxide ng v i hóa tr cao nh t, Z là công th c h p ch t khí c a Y v i hydrogen. T ọ ứ ứ ớ ị ấ ứ ợ ấ ủ ớ ỉ
kh i h i c a X đ i v i Z là 2,353. Nh n xét nào sau đây đúngố ơ ủ ố ớ ậ
$:X có Vsepr là YO
2
E.
!:X có mô hình phân t d ng tam giác, góc liên k t OYO là 120ử ạ ế
0
.
":Trong phân t X, nguyên t Y tr ng thái lai hoá spử ử ở ạ
3
.
:Trong công th c Lewis c a Z, nguyên t Y còn 1 c p electron hoá tr t do.ứ ủ ử ặ ị ự
">26Phân rã t nhiên ự
232
90
Th
t o ra đ ng v b n ạ ồ ị ề
208
82
Pb
, đ ng th i gi i phóng m t s h t α và β. S ồ ờ ả ộ ố ạ ố
h t α và β (β là h t ạ ạ
0
1
e
) cho quá trình phân rã m t h t nhân ộ ạ
232
90
Th
l n l t làầ ượ
$:6; 8. !:6; 4. ":8; 6. :8; 4.
!:(' % 8) %Ầ Ự Ậ (3 cân – 6 đi m)ể
">96(2,5 đi m)ể
Phân t M đ c t o thành t 5 nguyên t c a hai nguyên t Y và R t o nên (S hi u nguyên t Yử ượ ạ ừ ử ủ ố ạ ố ệ ử
nh h n c a R). T ng s h t mang đi n trong phân t M là 20.ỏ ơ ủ ổ ố ạ ệ ử
9:Xác đ nh công th c phân t M.ị ứ ử
1: Vi t công th c electron, công th c Lewis, công th c Vsepr và bi u di n quá trình lai hoá cácế ứ ứ ứ ể ễ
orbital t o thành phân t M.ạ ử
4: M có th t o đ c liên k t hydrogen hay không, t i sao? So sánh có gi i thích nhi t đ sôi c a Mể ạ ượ ế ạ ả ệ ộ ủ
so v i Hớ
2
O.
">16(2 đi m)ể
9:Nguyên t Copper (đ ng) có hai đ ng v b n là ố ồ ồ ị ề
63
29
Cu
và
A
29
Cu
, nguyên t kh i trung bình c a Cu làử ố ủ
63,54. Trong CuSO
4
.5H
2
O đ ng v ồ ị
63
29
Cu
chi m 18,43% v kh i l ng. Xác đ nh s kh i A c a đ ng vế ề ố ượ ị ố ố ủ ồ ị
còn l i, vi t c u hình electron nguyên t Cu và cho bi t v trí c a Cu trong b ng tu n hoàn.ạ ế ấ ử ế ị ủ ả ầ
1:Nhúng m t thanh s t (iron) có kh i l ng 100 gam vào 200 gam dung d ch CuSOộ ắ ố ượ ị
4
1M đ n khiế
dung d ch h t màu xanh thì nh c thanh s t ra r a s ch, cân l i th y kh i l ng thanh s t n ng m gam.ị ế ấ ắ ử ạ ạ ấ ố ượ ắ ặ
Tính m.
& E F62B>1B4>?B?ọ ắ ắ ệ

ả ử ệ ể ế
">46(1,5 đi m)ể
Cho 15,64 gam h n h p X g m Ca và hai kim lo i ki m A, B (Mỗ ợ ồ ạ ề
A
<M
B
) hai chu kỳ liên ti p tác ở ế
d ng v i n c d thu đ c 7,437 lít khí Hụ ớ ướ ư ượ
2
25ở
0
C, 1bar và dung d ch Y.ị
- Khi cho 200 ml dung d ch Naị
2
CO
3
0,5M vào Y thì ch a k t t a h t l ng Caư ế ủ ế ượ
2+
trong dung d ch.ị
- Khi cho 300 ml dung d ch Naị
2
CO
3
0,5M vào Y thì sau ph n ng v n còn d Naả ứ ẫ ư
2
CO
3
.
Vi t ph ng trình ph n ng x y ra và xác đ nh A, B.ế ươ ả ứ ả ị
----------- H T ----------Ế
Cán b coi thi không gi i thích gì thêm!ộ ả
Ở ! "#$%Ắ
" & '( ')* %Ụ Ệ 8 "%$&Ụ
"'-%' ' "Ê Ư
(Đ thi g m 0ề ồ 4 trang)
'" '#"' %' "#%'# #+.%'/0" (Ê Ọ Ọ Ỏ Ấ
" Ơ Ở
%.&' "121131214Ọ
&5% '#6'7$' "38 (92(' '5%Ọ Ớ Ổ
Th i gian làm bài: 120 phút, không k th i gian giao đờ ể ờ ề
$:(' % ; "%'# &<'0"'=)$%Ầ Ắ Ệ (40 cân – 14 đi m)ể
----
&Gề " &Gề "
101
1 C
102
1 A
101
2 C
102
2 A
101
3 B
102
3 C
101
4 C
102
4 B
101
5 A
102
5 B
101
6 A
102
6 D
101
7 A
102
7 A
101
8 C
102
8 A
101
9 A
102
9 A
101
10 B
102
10 B
101
11 A
102
11 B
101
12 D
102
12 A
101
13 B
102
13 C
101
14 D
102
14 C
101
15 D
102
15 B
101
16 B
102
16 D
101
17 A
102
17 C
101
18 A
102
18 C
101
19 C
102
19 A
101
20 A
102
20 D
101
21 B
102
21 C
101
22 B
102
22 A
101
23 B
102
23 D
101
24 D
102
24 A
101
25 D
102
25 C
101
26 C
102
26 D
101
27 B
102
27 D
101
28 D
102
28 B
101
29 A
102
29 A
101
30 C
102
30 C
101
31 D
102
31 C
& E F62B>1B4>?B?ọ ắ ắ ệ