Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có l i ờ gi i ả ) S Ở GD&ĐT QU NG Ả BÌNH KỲ THI CH N Ọ HSG T NH Ỉ NĂM H C Ọ 2022-2023
Khóa ngày 13 tháng 12 năm 2022 Đ Ề CHÍNH TH C Ứ Môn thi: HÓA H C Ọ Bài thi tự lu n ậ L P Ớ 12 THPT SỐ BÁO DANH:…………… Th i
ờ gian: 90 phút (không k ể th i ờ gian giao đ ) ề Đ
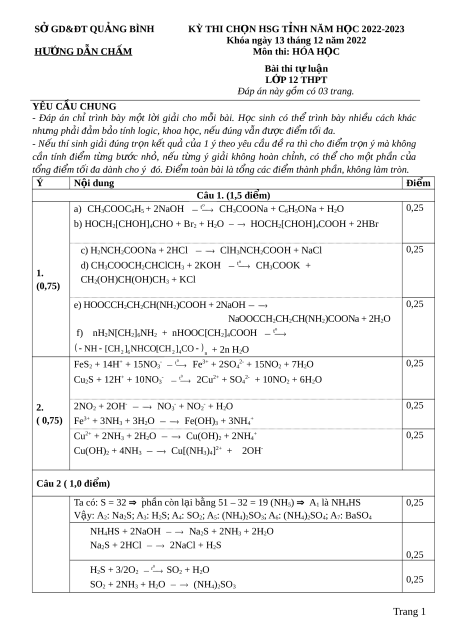
ề gồm có 02 trang và 05 câu. Câu 1. (1,5 đi m ể ) 1. Vi t ế phư ng ơ trình hóa h c ọ c a ủ các ph n ả ng ứ x y ả ra (dư i ớ dạng công th c ứ c u ấ t o ạ thu g n) ọ trong các trư ng ờ h p ợ sau:
a) Phenyl axetat + dung dịch NaOH dư o t b) Glucozơ + nư c ớ brom
c) H2NCH2COONa + dung dịch HCl dư d) CH o t
3COOCH2CHClCH3 + dung dịch KOH dư
e) Axit glutamic + dung dịch NaOH dư f) Trùng ng ng ư hexametylenđiamin v i ớ axit ađipic. 2. Cho h n ỗ h p ợ FeS2, Cu2S tác d ng ụ h t ế v i ớ dung d c
ị h HNO3 đặc, nóng thu đư c ợ dung dịch A (ch ỉ ch a ứ mu i
ố trung hòa) và khí B màu nâu đ . ỏ H p ấ th ụ khí B b ng ằ dung d c ị h NaOH dư thu đư c ợ dung d c ị h C. Cho dung d c ị h A tác d ng ụ v i ớ dung d c ị h NH3 dư thu đư c ợ dung dịch E và k t ế t a ủ F. Vi t ế phư ng ơ trình hóa h c ọ dư i ớ d ng ạ ion thu g n ọ c a ủ các ph n ả ng ứ xảy ra. Câu 2. (1,0 đi m ể ) Xác đ nh ị các ch t ấ A1, A2,…A7 và vi t ế phư ng ơ trình hóa h c ọ c a ủ các phản ng ứ th c ự hi n ệ theo s ơ đồ sau: A dd NaOH d +O ,t dd NH d +dd Br +dd BaCl 1 A2 +dd HCl A3 0 2 A4 3 A5 2 A6 2 A7 Bi t ế A1 là h p ợ ch t ấ c a ủ l u ư huỳnh v i ớ 2 nguyên t ố khác và có phân t ử kh i ố b n ằ g 51u; A7 là ch t ấ k t ế t a ủ . Câu 3. (1,5 đi m ể )
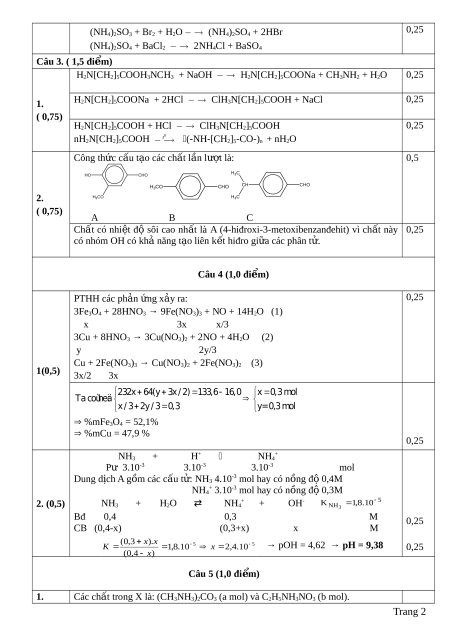
1. Hoàn thành các phư ng ơ trình hóa h c ọ sau d ng ạ công th c ứ c u ấ t o. ạ (1) X + NaOH 0 t X1 + X2 + H2O
(2) X1 + 2HCl X3 + NaCl (3) X4 + HCl X3 (4) nX 0 t 4 NH[ C H ] C O + nH2O 2 5 n Bi t ế X có công th c ứ phân t ử là C7H18O2N2. 2. Cho các ch t ấ sau:
Chất A (4-hiđroxi-3-metoxibenzanđehit) có mùi th m ơ vani; ch t ấ B (4-metoxibenzanđehit) và ch t
ấ C (p-isopropylbenzanđehit) đư c ợ chi t ế xu t ấ t ừ qu ả cây h i, ồ đ u ề đư c ợ s ử d ng ụ trong ch ế bi n ế th c ự ph m ẩ và dư c ợ ph m. ẩ a. Vi t ế công th c ứ c u ấ tạo c a ủ A, B, C.
b. Trong 3 chất trên, ch t ấ nào có nhi t ệ đ ộ sôi cao nh t? ấ Vì sao? M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có l i ờ gi i ả )
Câu 4. ( 1,0 đi m ể ) 1. Cho 133,6 gam h n ỗ h p ợ X g m ồ Fe3O4 và Cu vào dung d c
ị h HNO3 đun nóng, thu đư c ợ 0,3 mol NO (s n ả ph m ẩ khử duy nh t ấ c a ủ N+5, đktc), dung d c ị h Y và 16,0 gam Cu. Vi t ế phư ng ơ trình hóa h c ọ c a ủ các ph n ả ng ứ x y ả ra và tính ph n ầ trăm kh i ố lư ng ợ các ch t ấ trong hỗn h p ợ X. 2. Tr n ộ lẫn 7 ml dung d c ị h NH3 1M v i ớ 3 ml dung d c ị h HCl 1M thu đư c ợ dung d c ị h A. Tính pH c a ủ dung d c ị h A. Bi t ế 5 K 1 ,8.10 b( NH . 3 ) Câu 5. (1,0 đi m ể ) 1. Hỗn h p ợ X g m ồ 2 ch t ấ có công th c ứ phân t
ử là C3H12N2O3 và C2H8N2O3. Cho 3,40 gam X phản ng ứ v a ừ đủ v i ớ dung d c
ị h NaOH (đun nóng), thu đư c ợ dung d c ị h Y chỉ g m ồ các chất vô c ơ và 0,04 mol h n ỗ h p ợ khí Z g m ồ 2 ch t ấ h u ữ c ơ đ n ơ ch c ứ , b c ậ m t ộ (đ u ề làm xanh giấy quỳ tím m) ẩ . Cô c n ạ c n ẩ th n ậ Y thu đư c ợ m gam mu i ố khan. Vi t ế phư ng ơ trình hóa h c ọ các ph n ả ng ứ x y ả ra và tính giá tr ịm.
2. Thuỷ phân hoàn toàn 0,1 mol este E (chỉ ch a ứ m t ộ lo i ạ nhóm ch c ứ ) c n ầ dùng v a ừ đủ 100 gam dung d c ị h NaOH 12%, thu đư c ợ 20,4 gam mu i ố c a ủ m t ộ axit h u ữ c ơ và 9,2 gam m t ộ ancol. Xác đ nh ị công th c ứ c u ấ t o ạ c a ủ E bi t ế r ng ằ m t ộ trong hai ch t ấ (ancol ho c ặ axit) tạo thành este là đ n ơ ch c ứ .
Cho nguyên tử khối các nguyên tố: H = 1; Li = 7; C = 12; N = 14; O = 16;
Na = 23;Mg = 24; Al = 27; S = 32; Cl = 35,5; Ca = 40; K = 39; Fe = 56; Cu = 64; Ag = 108; Ba = 137. ----------------H T Ế -------------- M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85 S Ở GD&ĐT QU NG Ả BÌNH KỲ THI CH N Ọ HSG T NH Ỉ NĂM H C Ọ 2022-2023
Khóa ngày 13 tháng 12 năm 2022 HƯ NG Ớ D N Ẫ CH M Ấ Môn thi: HÓA H C Ọ Bài thi tự lu n ậ L P Ớ 12 THPT Đap an này g m ồ có 03 trang. YÊU C U Ầ CHUNG
- Đap an chỉ trình bày m t ộ l i ờ gi i ả cho m i ỗ bài. H c
ọ sinh có thể trình bày nhi u ề cach khac
nhưng phải đảm bảo tính logic, khoa h c ọ , n u ế đúng v n ẫ đư c ợ đi m ể t i ố đa. - N u ế thí sinh gi i ả đúng tr n ọ k t ế qu ả c a ủ 1 ý theo yêu c u ầ đ ề ra thì cho đi m ể tr n ọ ý mà không cần tính đi m ể t ng ừ bư c ớ nh , ỏ n u ế t ng ừ ý gi i ả không hoàn ch nh ỉ , có thể cho m t ộ ph n ầ c a ủ tổng đi m
ể tối đa dành cho ý đó. Đi m
ể toàn bài là t ng ổ cac đi m ể thành ph n, ầ không làm tròn. Ý Nôi dung Đi m ể Câu 1. (1,5 đi m ể ) a) CH 0,25 3COOC6H5 + 2NaOH o t
CH3COONa + C6H5ONa + H2O
b) HOCH2[CHOH]4CHO + Br2 + H2O HOCH2[CHOH]4COOH + 2HBr c) H 0,25 2NCH2COONa + 2HCl ClH3NCH2COOH + NaCl d) CH3COOCH2CHClCH3 + 2KOH o t CH3COOK + 1. CH (0,75) 2(OH)CH(OH)CH3 + KCl e) HOOCCH 0,25
2CH2CH(NH2)COOH + 2NaOH
NaOOCCH2CH2CH(NH2)COONa + 2H2O
f) nH2N[CH2]6NH2 + nHOOC[CH2]4COOH o t
NH [CH ] NHCO[CH ] CO 2 6 2 4 + 2n H n 2O FeS - 2- 0,25 2 + 14H+ + 15NO3 0 t
Fe3+ + 2SO4 + 15NO2 + 7H2O Cu - 2- 2S + 12H+ + 10NO3 0 t
2Cu2+ + SO4 + 10NO2 + 6H2O 2. 2NO - - 0,25 2 + 2OH- NO3 + NO2 + H2O ( 0,75) Fe3+ + 3NH + 3 + 3H2O Fe(OH)3 + 3NH4 Cu2+ + 2NH + 0,25 3 + 2H2O Cu(OH)2 + 2NH4
Cu(OH)2 + 4NH3 Cu[(NH3)4]2+ + 2OH- Câu 2 ( 1,0 đi m ể )
Ta có: S = 32 phần còn l i ạ b ng ằ
51 – 32 = 19 (NH5) A1 là NH4HS 0,25
Vậy: A2: Na2S; A3: H2S; A4: SO2; A5: (NH4)2SO3; A6: (NH4)2SO4; A7: BaSO4
NH4HS + 2NaOH Na2S + 2NH3 + 2H2O
Na2S + 2HCl 2NaCl + H2S 0,25 H2S + 3/2O2 0 t SO2 + H2O SO 0,25 2 + 2NH3 + H2O (NH4)2SO3 Trang 1 (NH 0,25 4)2SO3 + Br2 + H2O (NH4)2SO4 + 2HBr
(NH4)2SO4 + BaCl2 2NH4Cl + BaSO4 Câu 3. ( 1,5 đi m ể )
H2N[CH2]5COOH3NCH3 + NaOH H2N[CH2]5COONa + CH3NH2 + H2O 0,25 1.
H2N[CH2]5COONa + 2HCl ClH3N[CH2]5COOH + NaCl 0,25 ( 0,75)
H2N[CH2]5COOH + HCl ClH3N[CH2]5COOH. 0,25 nH2N[CH2]5COOH 0 t
(-NH-[CH2]5-CO-)n + nH2O Công th c ứ c u ấ t o ạ các ch t ấ l n ầ lư t ợ là: 0,5 HO CHO H3C H CH CHO 3CO CHO 2. H3CO H3C ( 0,75) A B C Chất có nhi t ệ độ sôi cao nh t
ấ là A (4-hiđroxi-3-metoxibenzanđehit) vì ch t ấ này 0,25 có nhóm OH có kh ả năng t o ạ liên k t ế hiđro gi a ữ các phân t . ử Câu 4 (1,0 đi m ể ) PTHH các ph n ả ng ứ x y ả ra: 0,25
3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO + 14H2O (1) x 3x x/3
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O (2) y 2y/3
Cu + 2Fe(NO3)3 → Cu(NO3)2 + 2Fe(NO3)2 (3) 1(0,5) 3x/2 3x
232x 64(y 3x / 2) 133,6 16,0 x 0,3 mol Ta coù heä: x/ 3 2y/ 3 0,3 y= 0,3 mol %mFe3O4 = 52,1% %mCu = 47,9 % 0,25 NH + 3 + H+ NH4 P ư 3.10-3 3.10-3 3.10-3 mol Dung dịch A g m ồ các c u ấ t :
ử NH3 4.10-3 mol hay có nồng độ 0,4M NH +
4 3.10-3 mol hay có nồng độ 0,3M 2. (0,5) NH + 3 + H2O ⇄ NH4 + OH- 5 K NH 8 , 1 .10 3 Bđ 0,4 0,3 M 0,25 CB (0,4-x) (0,3+x) x M ( 3 , 0 x).x 5 5 K . 8 , 1 10 x , 2 1 . 4 0
→ pOH = 4,62 → pH = 9,38 0,25 ( , 0 4 x) Câu 5 (1,0 đi m ể ) 1. Các ch t
ấ trong X là: (CH3NH3)2CO3 (a mol) và C2H5NH3NO3 (b mol). Trang 2
Đề HSG Hóa 12 Quảng Bình năm 2023 có đáp án
2.2 K
1.1 K lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Tài liệu được cập nhật liên tục trong gói này từ nay đến hết tháng 3/2024. Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu Đề HSG Hóa 12 Quảng Bình năm 2023 có đáp án.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(2186 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 12
Xem thêmTài liệu bộ mới nhất
Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
S GD&ĐT QU NG BÌNHỞ Ả
Đ CHÍNH TH CỀ Ứ
KỲ THI CH N HSG T NH NĂM H C Ọ Ỉ Ọ 2022-2023
Khóa ngày 13 tháng 12 năm 2022
Môn thi: HÓA H CỌ
Bài thi t lu nự ậ
S BÁO DANH:……………Ố
L P 12 THPTỚ
Th i gian: ờ 90 phút ể ờ ề
ề ồ
Câu 1. (1,5 đi m)ể
1. Vi t ph ng trình hóa h c c a các ph n ng x y ra ế ươ ọ ủ ả ứ ả (d i d ng công th c c u t o thuướ ạ ứ ấ ạ
g n) ọ trong các tr ng h p sau: ườ ợ
a) Phenyl axetat + dung d ch ị NaOH dư
o
t
b) Glucoz + n c brom ơ ướ
c) H
2
NCH
2
COONa + dung d ch ị HCl dư
d) CH
3
COOCH
2
CHClCH
3
+ dung d ch Kị OH d ư
o
t
e) Axit glutamic + dung d ch ị NaOH d ư
f) Trùng ng ng hexametylenđiamin v i axit ađipic.ư ớ
2. Cho h n h p FeSỗ ợ
2
, Cu
2
S tác d ng h t v i dung d ch HNOụ ế ớ ị
3
đ c, nóng thu đ c dungặ ượ
d ch A (ch ch a mu i trung hòa) và khí B màu nâu đ . H p th khí B b ng dung d ch NaOHị ỉ ứ ố ỏ ấ ụ ằ ị
d thu đ c dung d ch C. Cho dung d ch A tác d ng v i dung d ch NHư ượ ị ị ụ ớ ị
3
d thu đ c dungư ượ
d ch E và k t t a F. Vi t ph ng trình hóa h c d i d ng ion thu g n c a các ph n ngị ế ủ ế ươ ọ ướ ạ ọ ủ ả ứ
x y ra.ả
Câu 2. (1,0 đi m)ể
Xác đ nh các ch t Aị ấ
1
, A
2
,…A
7
và vi t ph ng trình ế ươ hóa h c c a các ọ ủ ph n ng th c hi nả ứ ự ệ
theo s đ sau:ơ ồ
A
1
dd NaOH d
A
2
+dd HCl
A
3
0
2
+O ,t
A
4
3
dd NH d
A
5
2
+dd Br
A
6
2
+dd BaCl
A
7
Bi t Aế
1
là h p ch t c a l u huỳnh v i 2 nguyên t khác và có phân t kh i b ng 51u; Aợ ấ ủ ư ớ ố ử ố ằ
7
là ch tấ
k t t a.ế ủ
Câu 3. (1,5 đi m)ể
1. Hoàn thành các ph ng trình hóa h c sau d ng công th c c u t o.ươ ọ ạ ứ ấ ạ
(1) X + NaOH
0
X
1
+ X
2
+ H
2
O
(2) X
1
+ 2HCl
X
3
+ NaCl
(3) X
4
+ HCl
X
3
(4) nX
4
0
+ nH
2
O
Bi t X có công th c phân t là Cế ứ ử
7
H
18
O
2
N
2
.
2. Cho các ch t sau:ấ
Ch t A (4-hiđroxi-3-metoxibenzanđehit) ấ có mùi th m vani; ch t B (ơ ấ 4-metoxibenzanđehit)
và ch t C (p-isopropylbenzanđehit) đ c chi t xu t t qu cây h i, đ u đ c s d ng trongấ ượ ế ấ ừ ả ồ ề ượ ử ụ
ch bi n th c ph m và d c ph m. ế ế ự ẩ ượ ẩ
a. Vi t công th c c u t o c a A, B, C. ế ứ ấ ạ ủ
b. Trong 3 ch t trên, ch t nào có nhi t đ sôi cao nh t? Vì sao?ấ ấ ệ ộ ấ
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ
n
NH[CH
2
]
5
CO

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
Câu 4. ( 1,0 đi m)ể
1. Cho 133,6 gam h n h p X g m Feỗ ợ ồ
3
O
4
và Cu vào dung d ch HNOị
3
đun nóng, thu đ cượ
0,3 mol NO (s n ph m kh duy nh t c a Nả ẩ ử ấ ủ
+5
, đktc), dung d ch Yị
và 16,0 gam Cu. Vi tế
ph ng trình hóa h c c a các ph n ng x y ra và tính ph n trăm kh i l ng các ch t trongươ ọ ủ ả ứ ả ầ ố ượ ấ
h n h p X.ỗ ợ
2. Tr n l n 7 ml dung d ch NHộ ẫ ị
3
1M v i 3 ml dung d ch HCl 1M thu đ c dung d ch A.ớ ị ượ ị
Tính pH c a dung d ch A. Bi t ủ ị ế
3
5
( )
1,8.10
.
Câu 5. (1,0 đi m)ể
1. H n h p X g m 2 ch t có công th c phân t là Cỗ ợ ồ ấ ứ ử
3
H
12
N
2
O
3
và C
2
H
8
N
2
O
3
. Cho 3,40 gam
X ph n ng v a đ v i dung d ch NaOH (đun nóng), thu đ c dung d ch Y ch g m cácả ứ ừ ủ ớ ị ượ ị ỉ ồ
ch t vô c và 0,04 mol h n h p khí Z g m 2 ch t h u c đ n ch c, b c m t (đ u làm xanhấ ơ ỗ ợ ồ ấ ữ ơ ơ ứ ậ ộ ề
gi y quỳ tím m). Cô c n c n th n Y thu đ c m gam mu i khan. Vi t ph ng trình hóaấ ẩ ạ ẩ ậ ượ ố ế ươ
h c các ph n ng x y ra và tính giá tr m.ọ ả ứ ả ị
2. Thu phân hoàn toàn 0,1 mol este E (ch ch a m t lo i nhóm ch c) c n dùng v a đỷ ỉ ứ ộ ạ ứ ầ ừ ủ
100 gam dung d ch NaOH 12%, thu đ c 20,4 gam mu i c a m t axit h u c và 9,2 gamị ượ ố ủ ộ ữ ơ
m t ancol. Xác đ nh công th c c u t o c a E bi t r ng m t trong hai ch t (ancol ho c axit)ộ ị ứ ấ ạ ủ ế ằ ộ ấ ặ
t o thành este là đ n ch c. ạ ơ ứ
Cho nguyên tử khối các nguyên tố: H = 1; Li = 7; C = 12; N = 14; O = 16;
Na = 23;Mg = 24; Al = 27; S = 32; Cl = 35,5; Ca = 40; K = 39; Fe = 56; Cu
= 64; Ag = 108; Ba = 137.
----------------H T--------------Ế
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ
S GD&ĐT QU NG BÌNHỞ Ả
H NG D N CH MƯỚ Ẫ Ấ
KỲ THI CH N HSG T NH NĂM H C 20Ọ Ỉ Ọ 22-2023
Khóa ngày 13 tháng 12 năm 2022
Môn thi: HÓA H CỌ
Bài thi t lu nự ậ
L P 12 THPTỚ
! ồ "
YÊU C U CHUNGẦ
# $! % & $! ỉ ộ ờ ả ỗ ọ ể ề
'%( ( ) ư ả ả ả ọ ế ẫ ượ ể ố
# '& ) * +,-!. $ ,ế ả ọ ế ả ủ ầ ề ể ọ
' ( , ( ầ ể ừ ướ ỏ ế ừ ả ỉ ể ộ ầ ủ
/, % (%0ổ ể ố ể ổ ể ầ
Ý N i dungô Đi mể
Câu 1. (1,5 đi m)ể
1.
(0,75)
a) CH
3
COOC
6
H
5
+ 2NaOH
o
t
CH
3
COONa + C
6
H
5
ONa + H
2
O
b) HOCH
2
[CHOH]
4
CHO + Br
2
+ H
2
O
HOCH
2
[CHOH]
4
COOH + 2HBr
0,25
c) H
2
NCH
2
COONa + 2HCl
ClH
3
NCH
2
COOH + NaCl
d) CH
3
COOCH
2
CHClCH
3
+ 2KOH
o
t
CH
3
COOK +
CH
2
(OH)CH(OH)CH
3
+ KCl
0,25
e) HOOCCH
2
CH
2
CH(NH
2
)COOH + 2NaOH
NaOOCCH
2
CH
2
CH(NH
2
)COONa + 2H
2
O
f) nH
2
N[CH
2
]
6
NH
2
+ nHOOC[CH
2
]
4
COOH
o
t
2 6 2 4
n
NH [CH ] NHCO[CH ] CO
+ 2n H
2
O
0,25
2.
( 0,75)
FeS
2
+ 14H
+
+ 15NO
3
-
0
t
Fe
3+
+ 2SO
4
2-
+ 15NO
2
+ 7H
2
O
Cu
2
S + 12H
+
+ 10NO
3
-
0
t
2Cu
2+
+ SO
4
2-
+ 10NO
2
+ 6H
2
O
0,25
2NO
2
+ 2OH
-
NO
3
-
+ NO
2
-
+ H
2
O
Fe
3+
+ 3NH
3
+ 3H
2
O
Fe(OH)
3
+ 3NH
4
+
0,25
Cu
2+
+ 2NH
3
+ 2H
2
O
Cu(OH)
2
+ 2NH
4
+
Cu(OH)
2
+ 4NH
3
Cu[(NH
3
)
4
]
2+
+ 2OH
-
0,25
Câu 2 ( 1,0 đi m)ể
Ta có: S = 32 ph n còn l i b ng 51 – 32 = 19 (NHầ ạ ằ
5
) A
1
là NH
4
HS
V y: ậ A
2
: Na
2
S; A
3
: H
2
S; A
4
: SO
2
; A
5
: (NH
4
)
2
SO
3
; A
6
: (NH
4
)
2
SO
4
; A
7
: BaSO
4
0,25
NH
4
HS + 2NaOH
Na
2
S + 2NH
3
+ 2H
2
O
Na
2
S + 2HCl
2NaCl + H
2
S
0,25
H
2
S + 3/2O
2
0
SO
2
+ H
2
O
SO
2
+ 2NH
3
+ H
2
O
(NH
4
)
2
SO
3
0,25
Trang 1
(NH
4
)
2
SO
3
+ Br
2
+ H
2
O
(NH
4
)
2
SO
4
+ 2HBr
(NH
4
)
2
SO
4
+ BaCl
2
2NH
4
Cl + BaSO
4
0,25
Câu 3. ( 1,5 đi m)ể
1.
( 0,75)
H
2
N[CH
2
]
5
COOH
3
NCH
3
+ NaOH
H
2
N[CH
2
]
5
COONa + CH
3
NH
2
+ H
2
O
0,25
H
2
N[CH
2
]
5
COONa + 2HCl
ClH
3
N[CH
2
]
5
COOH + NaCl
0,25
H
2
N[CH
2
]
5
COOH + HCl
ClH
3
N[CH
2
]
5
COOH.
nH
2
N[CH
2
]
5
COOH
0
(-NH-[CH
2
]
5
-CO-)
n
+ nH
2
O
0,25
2.
( 0,75)
Công th c c u t o các ch t l n l t là:ứ ấ ạ ấ ầ ượ
CHOHO
H
3
CO
CHOH
3
CO
CHOCH
H
3
C
H
3
C
A B C
0,5
Ch t có nhi t đ sôi cao nh t là ấ ệ ộ ấ A (4-hiđroxi-3-metoxibenzanđehit) vì ch t nàyấ
có nhóm OH có kh năng t o liên k t hiđro gi a các phân t .ả ạ ế ữ ử
0,25
Câu 4 (1,0 đi m)ể
1(0,5)
PTHH các ph n ng x y ra:ả ứ ả
3Fe
3
O
4
+ 28HNO
3
→ 9Fe(NO
3
)
3
+ NO + 14H
2
O (1)
x 3x x/3
3Cu + 8HNO
3
→ 3Cu(NO
3
)
2
+ 2NO + 4H
2
O (2)
y 2y/3
Cu + 2Fe(NO
3
)
3
→ Cu(NO
3
)
2
+ 2Fe(NO
3
)
2
(3)
3x/2 3x
0,25
232x 64(y 3x/ 2) 133,6 16,0 x 0,3 mol
Ta coù heä:
x/ 3 2y/ 3 0,3 y= 0,3 mol
%mFe
3
O
4
= 52,1%
%mCu = 47,9 %
0,25
2. (0,5)
NH
3
+ H
+
NH
4
+
P 3.10ư
-3
3.10
-3
3.10
-3
mol
Dung d ch A g m các c u t : NHị ồ ấ ử
3
4.10
-3
mol hay có n ng đồ ộ 0,4M
NH
4
+
3.10
-3
mol hay có n ng đồ ộ 0,3M
NH
3
+ H
2
O ⇄ NH
4
+
+ OH
-
5
NH
10.8,1K
3
Bđ
0,4 0,3 M
CB (0,4-x) (0,3+x) x M
55
10.4,210.8,1
)4,0(
).3,0(
1
1
11
→ pOH = 4,62 → pH = 9,38
0,25
0,25
Câu 5 (1,0 đi m)ể
1. Các ch t trong X là: (CHấ
3
NH
3
)
2
CO
3
(a mol) và C
2
H
5
NH
3
NO
3
(b mol).
Trang 2

(0,5)
(CH
3
NH
3
)
2
CO
3
+ 2NaOH
0
t
2CH
3
NH
2
+ Na
2
CO
3
+ 2H
2
O
a 2a a
C
2
H
5
NH
3
NO
3
+ NaOH
0
t
C
2
H
5
NH
2
+ NaNO
3
+ H
2
O
b b b
0,25
124a + 108b = 3,4
2a + b = 0,04
a = 0,01; b = 0,02.
m = 0,01.106 + 0,02.85 = 2,76.
0,25
2. (0,5)
NaOH
E
n
3
n
nên có 2 TH x y ra:ả
TH1: E là este đ c t o thành t axit đ n ch c RCOOH và ancol 3 ch cượ ạ ừ ơ ứ ứ
R’(OH)
3
(RCOO)
3
R’ + 3 NaOH
0
3RCOONa + R’(OH)
3
0,1 0,3 0,1
M
RCOONa
= 20,4 : 0,3 = 68
R = 1
R là H
3
R '(OH)
M
= 9,2 : 0,1 = 92
R’ = 41
R’ là C
3
H
5
CTCT este E: (HCOO)
3
C
3
H
5
0,25
TH2: E là este đ c t o thành t axit 3 ch c R(COOH)ượ ạ ừ ứ
3
và ancol đ n ch cơ ứ
R’OH
R(COOR’)
3
+ 3 NaOH
0
R(COONa)
3
+ 3R’OH
0,1 0,1 0,3
M
R(COONa)3
= 20,4 : 0,1 = 204
R = 3
Lo iạ
0,25
----------------H T--------------Ế
S GD&ĐT QU NG BÌNHỞ Ả
Đ CHÍNH TH CỀ Ứ
KỲ THI CH N HSG T NH NĂM H C 2022-2023Ọ Ỉ Ọ
Khóa ngày 13 tháng 12 năm 2022
Môn thi: HÓA H CỌ
Bài thi tr c nghi mắ ệ
Trang 3