ĐỀ ĐỀ XUẤT
HỘITHI HỌC SINH GIỎI DHBB THPT CHUYÊN BẮC NINH NĂM HỌC 2023-2024
(Đề thi gồm 04 trang)
Môn thi: HÓA HỌC, Lớp 10 Hóa
Thời gian làm bài : 180 phút
--------------------------o0o-------------------------------- Lưu ý:
* Học sinh được sử dụng bảng hệ thống tuần hoàn các nguyên tố hoá học.
* Học sinh không được sử dụng tài liệu.
* Các phần vô cơ và hữu cơ được làm trên các tờ giấy khác nhau và kẹp riêng phần bài làm khi thu bài.
Cho: Hằng số Avogadro NA = 6,022.1023 mol–1; Hằng số khí lí tưởng R = 8,314 J.mol–1.K–1; Hằng số Planck
h = 6,626.10–34 J.s; Tốc độ ánh sáng trong chân không c = 3,0.108 m.s–1; Điện tích nguyên tố e = 1,6022.10–19 C; 1
eV = 1,6022.10–19 J; Khối lượng electron me = 9,1.10–31 kg.
Câu 1 (2,5 điểm) Cấu tạo nguyên tử. Phản ứng hạt nhân.
Định luật tuần hoàn
1.1. Trên phổ phát xạ của hidro, vạch thứ nhất của dãy
Lyman có bước sóng =1215 Å, các vạch thuộc
dãy Balmer lần lượt có bước sóng 2 =6563 Å, 3 =4861 Å,
4 =4340 Å. Hãy tính bước sóng của vạch tiếp theo trên dãy
Lyman và vạch đầu của dãy Paschen (dãy tiếp theo dãy Balmer) 1.2.
a) Sự phân rã của hạt nhân nhẹ kém bền phụ thuộc vào tỉ số giữa số nơtron và proton của
hạt nhân đó. Đối với hạt nhân kém bền của một nguyên tố, nếu tỉ số này lớn hơn so với
đồng vị bền, nó sẽ phân rã kiểu β–, ngược lại, nếu nhỏ hơn sẽ phân rã kiểu β+. Cho biết, các
đồng vị 12С, 19F được coi là bền của C và F, hãy xác định kiểu phân rã của các hạt nhân 11С, 20F, 17F, 14C.
b) Một chuỗi phân rã tự nhiên bắt đầu với 90Th232 và kết thúc ở 82Pb208. Một mẫu quặng
Thorium được phát hiện chứa 8,00.10-5 mL khí He (đktc) và 5,00.10-7 gam Th232. Viết phương
trình phân rã tổng cộng và xác định độ tuổi của mẫu vật biết rằng thời gian bán rã của Th232 là
1,39.1010 năm, cho rằng trong chuỗi phóng xạ chỉ có He và các hạt cơ bản khác được hình
thành, toàn bộ lượng He trong mẫu đều xuất phát tự sự phân rã Th232 và đều được giữ lại trong quặng.
1.3. Các giá trị năng lượng ion hoá nối tiếp của Na và Mg (tính theo eV) là 5,1; 7,6; 15,0; 47,3;
71,6; 80,1; 98,9; 109,3. Hãy điền các giá trị trên vào bảng sau và giải thích sự lựa chọn đó? Nguyên tố I1 I2 I3 I4 Na Mg
Câu 2 (2,5 điểm) Cấu tạo phân tử. Tinh thể
2.1. Sử dụng mô hình VSEPR, hãy dự đoán dạng hình học của các ion và phân tử sau: XeF4, BCl 2- 2- +¿¿ −¿¿
3, NF3, S2O3 , SiF6 , NO2 , I 3 , IF5.
2.2. Tinh thể SrCoO3 thuộc hệ lập phương, có cấu trúc kiểu
perovskit, được tạo thành khi nung hỗn hợp SrO2 và Co2O3 theo tỉ lệ
hợp thức trong khí quyển oxygen ở áp suất cao. Tại một tỉ lệ mol O2- SrO Con+
2 : Co2O3 xác định, có thể điều chế được tinh thể chất A, có cấu c
trúc kiểu Ruddlesden–Popper (là dẫn xuất của perovskit), thuộc hệ tứ Sr2+
phương với ô mạng cơ sở hình hộp chữ nhật có hai cạnh bằng nhau
(kí hiệu cạnh a) và một cạnh dài hơn (kí hiệu cạnh c). Trong tinh thể
A (hình vẽ bên), ion Con+ chiếm vị trí các đỉnh và tâm khối của ô a
mạng cơ sở. Mỗi ion Con+ được bao quanh bởi 6 ion O2– tạo nên những đơn vị bát diện đều,
giống hệt nhau, định hướng song song với nhau. Ion Sr2+chiếm vị trí hốc trống tạo bởi các ion O2–.
a) Xác định công thức hóa học của chất A và số phối trí của ion Sr2+.
b) Trong ô mạng cơ sở chất A, có bao nhiêu loại ion O2– ? Tính số lượng và xác định vị trí của mỗi loại O2– đó.
c) Tính độ dài cạnh c của ô mạng cơ sở tinh thể A. Cho rằng: các liên kết SrO trong A như
nhau; ô mạng cơ sở của A có cạnh a = 0,372 nm.
d) Giá trị c thu được từ thực nghiệm nhỏ hơn đáng kể so với giá trị tính toán ở trên. Hãy giải thích.
Câu 3 (2,5 điểm) Nhiệt hóa học.
Phản ứng giữa hidro và oxi được dùng để đẩy con tàu vũ trụ.
3.1. Tính nhiệt độ cực đại của ngọn lửa H2 cháy trong O2 nguyên chất xuất phát từ tỷ lệ đúng
bằng hệ số tỷ lượng trong phương trình phản ứng ở nhiệt độ 298K và tạo ra H2O (k) (coi như
không có sự thất thoát về nhiệt).
3.2. Thực tế người ta dùng tỷ lệ phản ứng 2H2 + O2 (giàu hidro) tạo thành H2O và H2.Trong
trường hợp này nhiệt độ cực đại của ngọn lửa là bao nhiêu?
3.3. Ở nhiệt độ nào đó thì hỗn hợp cuối chứa những lượng đáng kể H và OH. Phương trình
phản ứng đó là? 2 H2(k) + O2(k) 0,990 H2(k) + 0,985 H2O(k) + x H(k) + y OH(k)
a) Xác định x và y
b) Tính biến thiên enthalpy chuẩn của phản ứng ở 298K.
c) Xác định nhiệt độ cuối của hỗn hợp phản ứng.
(Coi như hỗn hợp sau phản ứng trong các trường hợp trên chỉ có sản phẩm phản ứng)
Cho các số liệu sau ở nhiệt độ 298K: Chất ∆ 0 (J.K-1.mol-1) f H 0 (kJ.mol-1) C p H2O (k) -241,83 30,54 + 10,29.10-3.T H (k) 218 20,785 OH (k) - 28,66 + 2,26.10-3.T O (k) 249,17 - H2 (k) 0 27,28 + 3,260.10-3.T O2 (k) 0 29,96 + 4,18.10-3.T Quá trình: OH(k) O(k) + H (k) có = 428, 00 kJ
Câu 4 (3,0 điểm) Động hóa học (không có cơ chế). Cân bằng hóa học trong pha khí
4.1. Nghiên cứu phản ứng phân hủy chlorine dioxide trong môi trường kiềm: −¿ +H O ¿ −¿+ClO 2 ¿ 2 ClO 2 ¿
2+ 2OH−¿ →ClO3
Các số liệu thực nghiêm thu được ở bảng sau: Thí [ClO2]o, [OH-]o, Tốc độ đầu, nghiệm mol/L mol/L mol/(L.s) 1 0,005 0,010 5,75 x 10-5 2 0,010 0,010 2,30 x 10-4 3 0,010 0,005 1,15 x 10-4
a) Xác định bậc riêng phần của ClO2, OH-. Viết biểu thức tốc độ phản ứng.
b) Xác định hằng số tốc độ của phản ứng (1) và cho biết đơn vị của hằng số tốc độ phản ứng.
c) Độ tan của ClO2 trong nước là 0,8 g/L. Pha loãng 10 lần dung dịch chứa ClO2 bão hòa trong
nước và NaOH 1M, hãy tính thời gian để nồng độ ClO2 trong dung dịch trên giảm đi một nửa.
4.2. Phân bón ammonium chloride (NH4Cl) là loại phân vi sinh chua, rất thích hợp khi bón thúc
cùng phân lân ở đất nhiễm phèn. Chất này bị phân hủy ở nhiệt độ cao theo phương trình: NH4Cl (s) ⇌ NH3 (g) + HCl (g) (1)
Khi nung NH4Cl ở 427°C trong chân không trong thời gian đủ đạt cân bằng, áp suất đo được
bằng 4650 mmHg. Ở 459°C áp suất cân bằng của hệ là 8360 mmHg. Giả sử hơi tuân theo định
luật của khí lí tưởng.
a) Bằng lập luận và đánh giá hợp lí, hãy cho biết chiều thuận của phản ứng (1) là tỏa nhiệt hay thu nhiệt?
b) Tính hằng số cân bằng KP của phản ứng (1) ở 427°C và 459°C.
c) Giả thiết ∆rH° và ∆rS° của phản ứng (1) không phụ thuộc vào nhiệt độ. Hãy tính ∆rH° và ∆rS° của phản ứng (1).
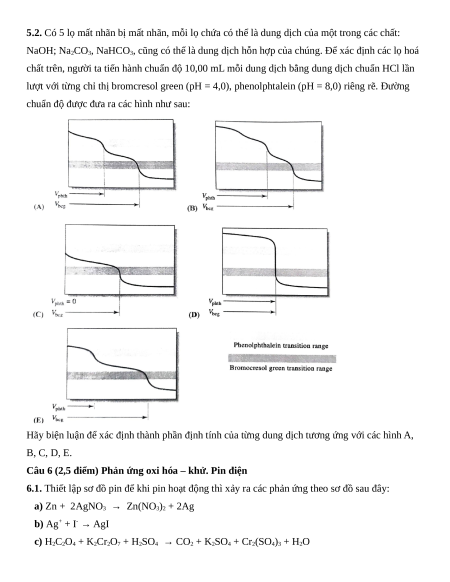
Câu 5 (3,0 điểm) Cân bằng acid – base và cân bằng các hợp chất ít tan. Phương án thực hành
5.1. Hệ đệm thường được dùng để duy trì pH của các hệ phản ứng, cũng có thể dùng trong việc
nhận biết, tách các chất ra khỏi hỗn hợp. Một dung dịch đệm X (có pH = 5,01) được pha chế từ
các dung dịch gốc CH3COOH 1,0 M và CH3COONa 1,0 M, trong đó tổng nồng độ
C(CH3COOH) + C(CH3COONa) trong dung dịch X là 0,2 M.
a) Tính thể tích các dung dịch gốc cần lấy để pha chế được 1,0 lít dung dịch đệm X.
b) Thêm 10,00 mL dung dịch X vào 10,00 mL dung dịch Y gồm FeCl2 0,010 M và FeCl3
0,010 M. Bằng tính toán, hãy cho biết có thể tách được hoàn toàn ion Fe3+ ra khỏi dung
dịch dưới dạng Fe(OH)3 hay không? Biết rằng, một ion được coi như tách hoàn toàn ra
khỏi dung dịch nếu tổng nồng độ các dạng tồn tại của ion đó trong dung dịch ≤ 10-6 M.
Cho biết: pKa (CH3COOH) = 4,76; pKs (Fe(OH)2) = 15,1; pKs (Fe(OH)3) = 37,0; *ß (FeOH2+) =
10-2,17; *ß (FeOH+) = 10-5,92.
Đề thi HSG Hóa học 10 Trường THPT Chuyên Bắc Ninh
640
320 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu Tổng hợp đề thi chọn học sinh giỏi Hóa học 10 của các trường THPT Chuyên khu vực Duyên hải và Đồng bằng Bắc Bộ gồm 29 đề đề xuất và 1 đề chính thức có lời giải giúp giáo viên, học sinh có thêm tài liệu tham khảo.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(640 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)