SỞ GD&ĐT TỈNH HÒA BÌNH
KỲ THI HỌC SINH GIỎI CÁC TRƯỜNG KHU TRƯỜNG THPT CHUYÊN
VỰC DUYÊN HẢI VÀ ĐỒNG BẰNG BẮC BỘ HOÀNG VĂN THỤ NĂM HỌC 2023-2024
ĐỀ THI MÔN HÓA HỌC LỚP 10
(Đề thi đề xuất)
Thời gian làm bài: 180 phút
(Đề thi gồm có 06 trang, 08 câu)
CÂU 1. (2,5 đđiểm). Cấu tạo nguyên tử. Phản ứng hạt nhân. Định luật tuần hoàn
1.1. Potassium-40 là đồng vị potassium phóng xạ với số khối 40. Độ phổ biến (tỉ lệ) của
đồng vị 40K trong tự nhiên là 0,01167% (phần trăm mol). Toàn bộ 40K trên Trái đất được tạo
thành ngay trước khi xuất hiện Hệ Mặt trời và chính hành tình này (khoảng 4,6 tỉ năm trước)
và từ đó dần dần bị phân rã. Đến nay, hạt nhân này vẫn còn là do chu kì bán rã lớn của nó
(t1/2 = 1,25.109 năm). Các đồng vị potassium khác bền trong tự nhiên và số lượng của chúng
không thay đổi. Sự phân rã 40K diễn ra theo hai hướng:
- Phân rã β- (hằng số phân rã λβ = 4,962.10–10 năm-1 ).
- Bắt một electron (phản ứng hạt nhân trong đó một trong số các proton của hạt nhân hấp
thụ một electron của lớp vỏ bên trong của một nguyên tử, để tạo thành một neutron) (hằng
số phân rã λе = 0,581.10-10 năm-1 ).
Trong số một trong các phản ứng này, đồng vị 40Ar được tạo thành. Do trong các loại đá có
lượng potassium đủ lớn nên theo thời gian, chúng bắt đầu tích tụ đồng vị 40Ar. Do đồng vị
40Ar được tạo thành chỉ từ đồng vị 40K nên tỉ lệ nồng độ 40K/40Ar được sử dụng để xác định
tuổi tuyệt đối của các loại đá bởi phương pháp gọi là đánh dấu potassium-argon.
1) Viết các phương trình phản ứng hạt nhân diễn ra khi 40K phân rã.
2) Dẫn ra biểu thức liên hệ giữa tuổi đá với tỉ lệ các đồng vị 40Ar và 40K. Đá bazan (basalt,
hay đá núi lửa), được tìm thấy trong dãy núi Karpat có chứa 1,205% potassium, 9,366.10-4
mm3 (đktc) đồng vị 40Ar trên mỗi gam đá.
3) Xác định tuổi mẫu đá. Nếu bạn không chắc chắn về lời giải ở ý trước, hãy sử dụng biểu thức này: 40 10 Ar 18 t 10 .ln(1 ) 40K 19
Cơ sở của phương pháp đánh dấu potassium-argon là giả định rằng toàn bộ argon trong mẫu
phân tích được tạo thành từ 40K. Nếu một số phần argon trong mẫu là từ khí quyển (nghĩa là
không được tạo thành từ 40K) thì phương pháp này cho kết quả không đáng tin cậy.
1.2. Bằng thiết bị và ở điều kiện thích hợp, một bức xạ có độ dài sóng là 58,43 nm được
chiếu vào một dòng khí nitơ. Người ta xác định được tốc độ của dòng electron đầu tiên là
1,4072.106 m.s–1, tốc độ của dòng electron tiếp theo là 1,266.106 m.s–1.
1) Tính năng lượng ion hóa thứ nhất (I1) và năng lượng ion hóa thứ hai (I2) theo kJ.mol–1.
2) Cho biết electron thứ nhất e1, electron thứ hai e2 được bứt ra từ obitan phân tử nào của
nitơ? Vì sao? Vẽ giản đồ năng lượng của các obitan phân tử và dùng cấu hình electron của N2 để giải thích.
Cho: Hằng số Planck h = 6,6261.10–34 J.s; Tốc độ ánh sáng c = 2,9979.108 m.s–1;
Số Avogađro NA = 6,0221.1023 mol–1; Khối lượng electron me = 9,1094.10–31 kg. Trang 1/5
CÂU 2. (2,5 điểm) Cấu tạo phân tử. Tinh thể
2.1. Cho các tiêu chí sau: moment lưỡng cực của phân tử, số liên kết σ, số liên kết π, số cặp
electron chưa liên kết và tính cân đối – phụ thuộc vào khối lượng phân tử. Moment lưỡng
cực được tính là 4 điểm – nếu không có, và 0 điểm – nếu xuất hiện. Mỗi liên kết σ được tính
1 điểm, mỗi liên kết π được tính 2 điểm và mỗi cặp electron chưa liên kết của nguyên tử
trung tâm trong phân tử được tính 3 điểm. Sự mảnh mai được xác định như sau: nếu khối
lượng phân tử là 60 g/mol hoặc lớn hơn – 0 điểm, từ 20 – 60 g/mol – 5 điểm, nhỏ hơn 20
g/mol – 10 điểm. Có 8 ứng viên trong số những người tham gia, 4 trong số đó được kí hiệu
bởi các chữ cái A, B, C, D. Bảng dưới đây cung cấp tổng điểm và điểm số cụ thể theo từng
tiêu chí của mỗi phân tử Phân Moment Số liên Số liên Cặp electron Độ phức Tổng tử lưỡng cực kết δ kết � chưa liên kết tạp điểm SF2 0 ? 0 6 0 8 CS2 ? ? ? 0 0 ? BF3 4 ? ? ? ? ? ClF3 0 3 ? ? ? ? A 4 ? ? 0 10 ? B ? ? ? 3 10 ? C ? 4 0 ? ? 7 D ? ? 0 0 0 9
1) Xác định các phân tử A, B, C, D biết hai trong số các phân tử này chứa fluorine. Chú ý
rằng tất cả các nguyên tử trong các phân tử này đều thuộc ba chu kì đầu tiên, và không có
phân tử nào là cao phân tử (polymer).
2) Xác định các giá trị còn thiếu (“?”) trong bảng và xác định các phân tử nào chiếm ba vị trí dẫn đầu?
3) Xác định dạng hình học của cả 8 phân tử. Chỉ ra sự lai hóa của nguyên tử trung tâm.
2.2. Kết quả nhiễu xạ tia X cho thấy MgCl2 khan là một hệ tinh thể tam tà (ba nghiêng) với
cấu trúc xếp lớp, các chloride ion sắp xếp theo mạng lập phương đặc khít (ccp) còn các
nguyên tử magnesium chiếm các hốc bát diện. Ảnh chiếu dọc theo trục thẳng đứng của các
chloride ion được cho dưới đây. Các thông số của ô mạng lập phương là: a = 363.63 pm; c =
1766.63 pm; khối lượng riêng ρ = 2.35 gam·cm-3.
1) Sử dụng các kí tự A, B, C để kí hiệu các lớp Cl- và a, b, c để kí hiệu các lớp Mg2+ để biểu
diễn cấu trúc ba lớp bằng phương pháp xếp chồng.
2) Tính số đơn vị MgCl2 trong một ô lục phương.
CÂU 3. (2,5 điểm) Nhiệt hóa học.
3.1. Nước và ammonia là những đại diện cho các dung môi protic phân cực. Ở trạng thái
lỏng, cả nước và ammonia đều ít phân li. Trang 2/5
1) Xác định enthalpy phân li của ammonia lỏng thành các ion, sử dụng các dữ kiện cho trong bảng sau: ΔfHo239KNH3(g) ΔfHo239KNH2-(sol) ΔfHo239KNH4+(sol) ΔvHo239KNH3(lỏng) (kJ/mol) (kJ/mol) (kJ/mol) (kJ/mol) (enthalpy hóa hơi) - 46,19 42,3 - 67,40 23,27
Ở nhiệt độ -33,4 oC (điểm sôi của ammonia ở áp suất chuẩn), hằng số tự phân li Ks (hoặc
tích số ion) của ammonia là 1.10-22. Tuy nhiên, bằng cách đun nóng ammoni lỏng, về mặt lí
thuyết có thể đạt được giá trị tích số ion như nước dưới các điều kiện chuẩn.
2) Ước lượng nhiệt độ đun nóng để đạt được giá trị nói trên. Cần đưa ra các giả định nào.
3) Xác định áp suất cực tiểu mà tại đó có thể đo được nồng độ các ion NH4+ và NH2- của
ammonia tại nhiệt độ đã xác định được ở ý 2. Xem ammonia là khí lí tưởng.
3.2. Cho các dữ kiện sau: Liên kết C-H C-C C=C O=O H-H E( kJ/mol) 414,8 346,9 614,5 498,3 436
Nhiệt sinh của C6H12 là -156,4 kJ/Mol
Nhiệt thăng hoa của cacbon là 716,7 kJ/mol
Nhiệt hóa hơi của benzene lỏng là 33,9 kJ/mol
Nhiệt cháy của benzene lỏng là -3268 kJ/mol H2 H2 H2 -112.1kJmol-1 -119.7kJ mol-1
Tính toán năng lượng cộng hưởng của của 2 chất đầu trong dãy, riêng với benzene tính bằng 2 cách.
CÂU 4. (3,0 điểm) Động hóa học (không có cơ chế). Cân bằng hóa học trong pha khí
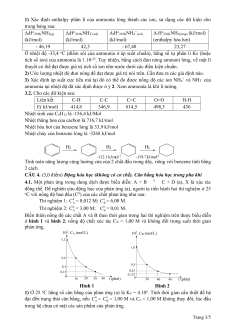
4.1. Một phản ứng trong dung dịch được biểu diễn: A + B X C + D (a), X là xúc tác
đồng thể. Để nghiên cứu động học của phản ứng (a), người ta tiến hành hai thí nghiệm ở 25
oC với nồng độ ban đầu (C0) của các chất phản ứng như sau: Thí nghiệm 1: 0 C = 0,012 M; 0 C = 6,00 M. A B Thí nghiệm 2: 0 C = 3,00 M; 0 C = 0,01 M. A B
Biến thiên nồng độ các chất A và B theo thời gian trong hai thí nghiệm trên được biểu diễn
ở hình 1 và hình 2; nồng độ chất xúc tác CX = 1,00 M và không đổi trong suốt thời gian phản ứng. 102. CA (mol/L) 102. CB (mol/L) 1,2 1,0 0,6 0,5 0,3 0,15 0,25 0 0,125 10 20 30 40 t (phút) 0 20 40 60 t (phút) Hình 1 Hình 2
1) Ở 25 oC hằng số cân bằng của phản ứng (a) là KC = 4.106. Tính thời gian cần thiết để hệ
đạt đến trạng thái cân bằng, nếu 0 C = 0 C = 1,00 M và C A B
x = 1,00 M không thay đổi; lúc đầu
trong hệ chưa có mặt các sản phẩm của phản ứng. Trang 3/5
2) Ở 80 oC hằng số cân bằng của phản ứng (a) là KC = 1.105. Tính H và S của phản ứng
(a) và cho biết thời gian cần thiết để đạt đến cân bằng sẽ tăng hay giảm (coi sự phụ thuộc
của H và S vào nhiệt độ là không đáng kể)?
4.2. Trong một hệ có cân bằng 3H2(g) + N2(g)
2NH3(g) (*) được thiết lập ở 400 K
người ta xác định được các áp suất phần sau đây:
PH2 = 0,376.105 Pa , PN2 = 0,125.105 Pa , PNH3 = 0,499.105 Pa
1) Tính hằng số cân bằng Kp và ΔG0 của phản ứng (*) ở 400 K.
2) Tính lượng N2 và NH3, biết hệ có 500 mol H2.
3) Thêm 10 mol H2 vào hệ này đồng thời giữ cho nhiệt độ và áp suất tổng cộng không đổi.
Bằng cách tính, hãy cho biết cân bằng (*) chuyển dịch theo chiều nào?
4) Trong một hệ cân bằng H2/N2/NH3 ở 410 K và áp suất tổng cộng 1.105 Pa, người ta tìm
được: Kp = 3,679.10-9 Pa-2, nH2 = 100 mol , nN2 = 500 mol và nNH3 = 175 mol. Nếu thêm
10 mol N2 vào hệ này đồng thời giữ cho nhiệt độ và áp suất không đổi thì cân bằng chuyển dịch theo chiều nào?
Cho: Áp suất tiêu chuẩn P0 = 1,013.105 Pa; R = 8,314 JK-1mol-1; 1 atm = 1,013.105 Pa.
CÂU 5. (3,0 điểm) Cân bằng acid-base và cân bằng các hợp chất ít tan. Phương án thực hành 5.1.
1) Bạc tác dụng với dung dịch nước của NaCN khi có mặt không khí theo phản ứng: 4Ag + O2 + 2H2O + 16CN− 4[Ag(CN)4]3− + 4OH−
Để ngăn cản sự hình thành của axit HCN (một chất dễ bay hơi và rất độc) thì pH của dung dịch phải trên 10.
Nếu dung dịch chỉ có NaCN, pH = 10,7 thì nồng độ NaCN bằng bao nhiêu?
2) Một dung dịch chứa các ion Ag+ và 0,020 mol/L NaCN. So với ion bạc thì natri xianua rất dư.
pH của dung dịch này bằng 10,8. Trong dung dịch có cân bằng sau: Ag+ + 4CN−
[Ag(CN)4]3− ; hằng số cân bằng β1 = 5,00.1020 3- c([Ag(CN) ] ) Xác định tỉ số của 4 trong dung dịch. + c(Ag )
5.2. Dung dịch A gồm Na2S và CH3COONa có pHA = 12,50.
1) Thêm một lượng Na3PO4 vào dung dịch A sao cho độ điện li của ion S2- giảm 20% (coi
thể tích dung dịch không đổi). Tính nồng độ của Na3PO4 trong dung dịch A.
2) Chuẩn độ 20,00 ml dung dịch A bằng dung dịch HCl 0,10 M:
a) Khi chỉ thị metyl da cam đổi màu (pH = 4,00) thì dùng hết 19,40 ml dung dịch HCl. Tính
nồng độ CH3COONa trong dung dịch A.
b) Nếu chỉ dùng hết 17,68 ml HCl thì hệ thu được có pH là bao nhiêu?
3) Để lâu dung dịch A trong không khí, một phần Na2S bị oxi hóa thành S. Tính hằng số cân
bằng của phản ứng xảy ra.
4) Hãy tìm một thuốc thử để nhận biết được 3 dung dịch riêng biệt: H3PO4, Na3PO4,
NaH2PO4. Giải thích các hiện tượng xảy ra. Cho: pK a1(H 7,02; pK 12,9; pK 2,15; pK 7,21; pK 12,32; 2S) a2(H2S) a1(H3PO4 ) a2(H3PO4 ) a3(H3PO4 ) pK 0 E 0 E a(CH 4,76; = 0,14 V;
=1,23 V; ở 25 oC: 2,303 RT ln = 0,0592lg. 3COOH ) S/H2S O2/H2O F
CÂU 6. (2,5 điểm) Phản ứn oxi hóa – khử. Pin điện (không liên quan phức chất)
6.1. Cho giản đồ quá trình khử - thế khử: quá trình khử diễn ra theo chiều mũi tên, thế khử
chuẩn được ghi trên các mũi tên và đo ở pH = 0. Trang 4/5
Đề thi HSG Hóa học 10 Trường THPT Chuyên Hoàng Văn Thụ - Hòa Bình
574
287 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu Tổng hợp đề thi chọn học sinh giỏi Hóa học 10 của các trường THPT Chuyên khu vực Duyên hải và Đồng bằng Bắc Bộ gồm 29 đề đề xuất và 1 đề chính thức có lời giải giúp giáo viên, học sinh có thêm tài liệu tham khảo.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(574 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)