SỞ GIÁO DỤC VÀ ĐÀO TẠO
KỲ THI TUYỂN SINH 10 THPT HÀ NỘI CHUYÊN SƯ PHẠM NĂM HỌC 2023
Môn: HÓA HỌC (CHUYÊN 10)
Thời gian làm bài 150 phút không kể thời gian giao đề
Câu I. Các hợp chất vô cơ (2,0 điểm)
1. Cho các chuyển hóa sau: BaCO3 X + M
2NaOH + M → Y + H2O NH3 + HCl → Z NH3 + HNO3 → T
a) Xác định các chất X, Y, Z, T và M.
b) Cho đồng thời các chất X, Y, Z, T có cùng số mol vào trong một lượng nước dư, rồi
đun nhẹ thu được khí A, dung dịch B và kết tủa C. Xác định các chất có trong A, B và
C. Viết các phương trình hóa học xảy ra.
2. Chia 76,8 gam hỗn hợp F gồm Mg và Fe thành hai phần bằng nhau:
- Cho phần 1 vào dung dịch HCl dư, thu được 17,92 lít H2 (đktc).
- Cho phần 2 vào 0,6 lít dung dịch Cu(NO3)2 aM, thu được dung dịch G và b gam chất
rắn H. Cho dung dịch G vào dung dịch NaOH dư, lọc lấy kết tủa rồi nung đến khối
lượng không đổi, thu được 40 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. Tính các giá trị a và b.
Câu II. Nhôm và hợp chất của nhôm (2,0 điểm)
Nhôm là kim loại màu trắng bạc, mềm, dễ kéo sợi, dát mỏng, dẫn điện và dẫn nhiệt tốt.
Nhôm có thể được dát thành giấy nhôm dùng để gói thực phẩm. Nhôm và hợp kim của
nhôm có đặc tính nhẹ, bền với không khí và nước, được dùng làm vật liệu chế tạo máy
bay, ô tô, tên lửa, tàu vũ trụ, các vật dụng với cuộc sống, ….
1. Mùa hè năm ngoái, bạn Tuấn được bố mẹ cho về quê ngoại thăm ông, bà. Bà ngoại
Tuấn hay ăn trầu nên đã bảo Tuấn đi xin ít vôi tôi của hàng xóm, Tuấn đã lấy một cái ca 1
bằng nhôm để đựng vôi tôi. Mấy hôm sau, khi bà ngoại Tuấn mang vôi ra ăn trầu thì
thấy ca bị thủng và vôi bị chảy hết ra ngoài. Em hãy giúp Tuấn giải thích tại sao ca bằng
nhôm đựng vôi tôi lại bị thủng?
2. Mặc dù nhôm là một kim loại khá hoạt động (chỉ sau kim loại kiềm và kiềm thổ)
nhưng nhôm vẫn được dùng để chế tạo các dụng cụ nhà bếp như xoong, nồi, … Hãy giải thích ngắn gọn.
3. Dưới đây là sơ đồ chuyển hóa có sự tham gia của nhôm và hợp chất của nhôm. Al + HCl → A + H2
A + G → D + E + H
A + B + C → D + E
A + NaOH dư → B + C + E
B + H + C → D + G
Xác định các chất A, B, C, D, E, G và H. Viết phương trình hóa học xảy ra.
4. Trong tự nhiên, nhôm có trong quặng boxit. Quặng boxit có chứa Al2O3.2H2O, tạp
chất là Fe2O3, SiO2, … Để sản xuất nhôm, người ta sẽ loại bỏ tạp chất để thu được Al2O3,
sau đó tiến hành điện phân nóng chảy (đpnc) với điện cực dương (anot bằng than chì)
hỗn hợp Al2O3 và criolit theo phản ứng sau: 2Al2O3 4Al + 3O2
Biết hiệu suất quá trình điện phân là 90% và quặng boxit chứa 25% (về khối lượng) tạp chất không chứa nhôm.
a) Cho biết vai trò của criolit trong quá trình điện phân.
b) Sau một thời gian điện phân, người ta thấy cực dương bị ăn mòn và phải thay thế.
Giải thích và viết phương trình hóa học minh họa.
c) Để điều chế được 54 tấn nhôm thì cần dùng bao nhiêu tấn quặng boxit?
Câu III. Kali và vai trò của kali (2,0 điểm)
Kali là một trong số các nguyên tố hóa học quan trọng đối với cơ thể con người. Thiếu
kali, cơ thể đối mặt với nguy cơ yếu cơ, liệt cơ và rối loạn nhịp tim, … Kali đặc biệt cần
thiết cho hệ thần kinh. Sự sụt giảm nồng độ kali trong máu có thể ảnh hưởng đến khả 2
năng tạo ra xung thần kinh của cơ thể. Kali cũng là nguyên tố rất cần thiết cho cây trồng,
đặc biệt là cho những cây ăn quả.
1. Đồng vị là những nguyên tử của cùng một nguyên tố có cùng số proton, khác số
nơtron. Trong tự nhiên, kali có ba loại đồng vị là 39K (93,258%), 40K (0,012%) và 41K (6,730%).
a) Tính nguyên tử khối trung bình của kali.
b) Chuối là một trong những loại hoa quả giàu kali. Khi thi đấu, nhiều vận động viên
tennis thường ăn chuối để bổ sung kịp thời lượng kali cho cơ thể. Một quả chuối nặng
150 g chứa 420 mg kali. Tính khối lượng mỗi loại đồng vị của kali trong quả chuối này.
c) Kali luôn có mặt trong máu người với một nồng độ ổn định. Một người trưởng thành
nặng 70 kg có lượng máu trong cơ thể là 5 lít, có chứa lượng kali trong máu từ 0,690 –
0,986 g. Tính nồng độ kali (mmol/l) có trong máu người trưởng thành trên.
2. Cây thanh long có nguồn gốc nhiệt đới. Chúng dễ trồng trên nhiều loại đất khác nhau
như đất bạc màu (Bình Thuận), đất phèn (đồng bằng sông Cửu Long), đất đỏ (Đồng
Nai), … Chất lượng thanh long phụ thuộc nhiều vào phân bón. Chế độ bón giàu đạm, ít
kali thường cho trái có độ ngọt kém, mau hư thối, khó bảo quản và vận chuyển. Ngược
lại chế độ bón phân cân đối đạm và kali hoặc giàu kali sẽ cho trái có độ ngọt cao hơn,
trái cứng chắc và lâu hư thối, dễ bảo quản, vận chuyển.
Độ dinh dưỡng của một số loại phân được quy định như sau:
- Độ dinh dưỡng của phân đạm được tính bằng %m(N) có trong phân.
- Độ dinh dưỡng của phân lân được tính bằng %m(P2O5) tương ứng với lượng P có trong phân.
- Độ dinh dưỡng của phân đạm được tính bằng %m(K2O) tương ứng với lượng K có trong phân.
a) Tính độ dinh dưỡng của phân KNO3, biết loại phân này chứa 20% (về khối lượng) tạp
chất không chứa kali và nitơ.
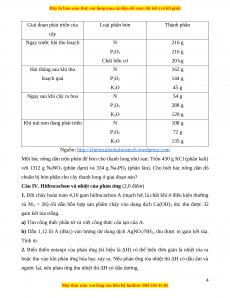
b) Bảng dưới đây hướng dẫn liều lượng trộn tỉ lệ các loại phân bón để bón cho cây thanh long. 3
Giai đoạn phát triển của Loại phân bón Thành phần cây Ngay trước khi thu hoạch N 216 g P2O5 216 g Chất hữu cơ 20 kg Hai tháng sau khi thu N 162 g hoạch quả P2O5 144 g K2O 45 g Ngay sau khi cây ra hoa N 54 g P2O5 288 g K2O 120 g
Khi trái non đang phát triển N 108 g P2O5 72 g K2O 135 g
Nguồn: http://chemicalsolutionstech.wordpress.com
Một bác nông dân trộn phân để bón cho thanh long như sau: Trộn 430 g KCl (phân kali)
với 1312 g NaNO3 (phân đạm) và 334 g Na3PO4 (phân lân). Cho biết bác nông dân đó
chuẩn bị bón phân cho cây thanh long ở giai đoạn nào?
Câu IV. Hiđrocacbon và nhiệt của phản ứng (2,0 điểm)
1. Đốt cháy hoàn toàn 4,16 gam hiđrocacbon A (mạch hở, là chất khí ở điều kiện thường
và MA > 26) rồi dẫn hỗn hợp sản phẩm cháy vào dung dịch Ca(OH)2 dư, thu được 32 gam kết tủa trắng.
a) Tìm công thức phân tử và viết công thức cấu tạo của A.
b) Dẫn 1,12 lít A (đktc) vào lượng dư dung dịch AgNO3/NH3, thu được m gam kết tủa. Tính m.
2. Biến thiên entanpi của phản ứng (kí hiệu là ∆H) có thể hiểu đơn giản là nhiệt tỏa ra
hoặc thu vào khi phản ứng hóa học xảy ra. Nếu phản ứng tỏa nhiệt thì ∆H có dấu âm và
ngược lại, nếu phản ứng thu nhiệt thì ∆H có dấu dương. 4
Đề thi vào 10 môn Hóa học năm 2023 Sở GD và ĐT Hà Nội
884
442 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Đề thi được cập nhật liên tục trong gói này từ nay đến hết tháng 6/2023. Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu bộ 29 đề thi vào 10 chuyên Hóa học có lời giải chi tiết, mới nhất năm 2022 - 2023 nhằm giúp Giáo viên có thêm tài liệu tham khảo ra đề thi môn Hóa học ôn vào 10.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(884 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Ôn vào 10
Xem thêmTài liệu bộ mới nhất

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
SỞ GIÁO DỤC VÀ ĐÀO TẠO
HÀ NỘI
KỲ THI TUYỂN SINH 10 THPT
CHUYÊN SƯ PHẠM
NĂM HỌC 2023
Môn: HÓA HỌC (CHUYÊN 10)
Thời gian làm bài 150 phút không kể thời gian giao đề
Câu I. Các hợp chất vô cơ (2,0 điểm)
1. Cho các chuyển hóa sau:
BaCO
3
X + M
2NaOH + M → Y + H
2
O
NH
3
+ HCl → Z
NH
3
+ HNO
3
→ T
a) Xác định các chất X, Y, Z, T và M.
b) Cho đồng thời các chất X, Y, Z, T có cùng số mol vào trong một lượng nước dư, rồi
đun nhẹ thu được khí A, dung dịch B và kết tủa C. Xác định các chất có trong A, B và
C. Viết các phương trình hóa học xảy ra.
2. Chia 76,8 gam hỗn hợp F gồm Mg và Fe thành hai phần bằng nhau:
- Cho phần 1 vào dung dịch HCl dư, thu được 17,92 lít H
2
(đktc).
- Cho phần 2 vào 0,6 lít dung dịch Cu(NO
3
)
2
aM, thu được dung dịch G và b gam chất
rắn H. Cho dung dịch G vào dung dịch NaOH dư, lọc lấy kết tủa rồi nung đến khối
lượng không đổi, thu được 40 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. Tính
các giá trị a và b.
Câu II. Nhôm và hợp chất của nhôm (2,0 điểm)
Nhôm là kim loại màu trắng bạc, mềm, dễ kéo sợi, dát mỏng, dẫn điện và dẫn nhiệt tốt.
Nhôm có thể được dát thành giấy nhôm dùng để gói thực phẩm. Nhôm và hợp kim của
nhôm có đặc tính nhẹ, bền với không khí và nước, được dùng làm vật liệu chế tạo máy
bay, ô tô, tên lửa, tàu vũ trụ, các vật dụng với cuộc sống, ….
1. Mùa hè năm ngoái, bạn Tuấn được bố mẹ cho về quê ngoại thăm ông, bà. Bà ngoại
Tuấn hay ăn trầu nên đã bảo Tuấn đi xin ít vôi tôi của hàng xóm, Tuấn đã lấy một cái ca
1
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
bằng nhôm để đựng vôi tôi. Mấy hôm sau, khi bà ngoại Tuấn mang vôi ra ăn trầu thì
thấy ca bị thủng và vôi bị chảy hết ra ngoài. Em hãy giúp Tuấn giải thích tại sao ca bằng
nhôm đựng vôi tôi lại bị thủng?
2. Mặc dù nhôm là một kim loại khá hoạt động (chỉ sau kim loại kiềm và kiềm thổ)
nhưng nhôm vẫn được dùng để chế tạo các dụng cụ nhà bếp như xoong, nồi, … Hãy giải
thích ngắn gọn.
3. Dưới đây là sơ đồ chuyển hóa có sự tham gia của nhôm và hợp chất của nhôm.
Al + HCl → A + H
2
A + G → D + E + H
A + B + C → D + E
A + NaOH dư → B + C + E
B + H + C → D + G
Xác định các chất A, B, C, D, E, G và H. Viết phương trình hóa học xảy ra.
4. Trong tự nhiên, nhôm có trong quặng boxit. Quặng boxit có chứa Al
2
O
3
.2H
2
O, tạp
chất là Fe
2
O
3
, SiO
2
, … Để sản xuất nhôm, người ta sẽ loại bỏ tạp chất để thu được Al
2
O
3
,
sau đó tiến hành điện phân nóng chảy (đpnc) với điện cực dương (anot bằng than chì)
hỗn hợp Al
2
O
3
và criolit theo phản ứng sau:
2Al
2
O
3
4Al + 3O
2
Biết hiệu suất quá trình điện phân là 90% và quặng boxit chứa 25% (về khối lượng) tạp
chất không chứa nhôm.
a) Cho biết vai trò của criolit trong quá trình điện phân.
b) Sau một thời gian điện phân, người ta thấy cực dương bị ăn mòn và phải thay thế.
Giải thích và viết phương trình hóa học minh họa.
c) Để điều chế được 54 tấn nhôm thì cần dùng bao nhiêu tấn quặng boxit?
Câu III. Kali và vai trò của kali (2,0 điểm)
Kali là một trong số các nguyên tố hóa học quan trọng đối với cơ thể con người. Thiếu
kali, cơ thể đối mặt với nguy cơ yếu cơ, liệt cơ và rối loạn nhịp tim, … Kali đặc biệt cần
thiết cho hệ thần kinh. Sự sụt giảm nồng độ kali trong máu có thể ảnh hưởng đến khả
2
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
năng tạo ra xung thần kinh của cơ thể. Kali cũng là nguyên tố rất cần thiết cho cây trồng,
đặc biệt là cho những cây ăn quả.
1. Đồng vị là những nguyên tử của cùng một nguyên tố có cùng số proton, khác số
nơtron. Trong tự nhiên, kali có ba loại đồng vị là
39
K (93,258%),
40
K (0,012%) và
41
K
(6,730%).
a) Tính nguyên tử khối trung bình của kali.
b) Chuối là một trong những loại hoa quả giàu kali. Khi thi đấu, nhiều vận động viên
tennis thường ăn chuối để bổ sung kịp thời lượng kali cho cơ thể. Một quả chuối nặng
150 g chứa 420 mg kali. Tính khối lượng mỗi loại đồng vị của kali trong quả chuối này.
c) Kali luôn có mặt trong máu người với một nồng độ ổn định. Một người trưởng thành
nặng 70 kg có lượng máu trong cơ thể là 5 lít, có chứa lượng kali trong máu từ 0,690 –
0,986 g. Tính nồng độ kali (mmol/l) có trong máu người trưởng thành trên.
2. Cây thanh long có nguồn gốc nhiệt đới. Chúng dễ trồng trên nhiều loại đất khác nhau
như đất bạc màu (Bình Thuận), đất phèn (đồng bằng sông Cửu Long), đất đỏ (Đồng
Nai), … Chất lượng thanh long phụ thuộc nhiều vào phân bón. Chế độ bón giàu đạm, ít
kali thường cho trái có độ ngọt kém, mau hư thối, khó bảo quản và vận chuyển. Ngược
lại chế độ bón phân cân đối đạm và kali hoặc giàu kali sẽ cho trái có độ ngọt cao hơn,
trái cứng chắc và lâu hư thối, dễ bảo quản, vận chuyển.
Độ dinh dưỡng của một số loại phân được quy định như sau:
- Độ dinh dưỡng của phân đạm được tính bằng %m(N) có trong phân.
- Độ dinh dưỡng của phân lân được tính bằng %m(P
2
O
5
) tương ứng với lượng P có trong
phân.
- Độ dinh dưỡng của phân đạm được tính bằng %m(K
2
O) tương ứng với lượng K có
trong phân.
a) Tính độ dinh dưỡng của phân KNO
3
, biết loại phân này chứa 20% (về khối lượng) tạp
chất không chứa kali và nitơ.
b) Bảng dưới đây hướng dẫn liều lượng trộn tỉ lệ các loại phân bón để bón cho cây thanh
long.
3
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Giai đoạn phát triển của
cây
Loại phân bón Thành phần
Ngay trước khi thu hoạch N
P
2
O
5
Chất hữu cơ
216 g
216 g
20 kg
Hai tháng sau khi thu
hoạch quả
N
P
2
O
5
K
2
O
162 g
144 g
45 g
Ngay sau khi cây ra hoa N
P
2
O
5
K
2
O
54 g
288 g
120 g
Khi trái non đang phát triển N
P
2
O
5
K
2
O
108 g
72 g
135 g
Nguồn: http://chemicalsolutionstech.wordpress.com
Một bác nông dân trộn phân để bón cho thanh long như sau: Trộn 430 g KCl (phân kali)
với 1312 g NaNO
3
(phân đạm) và 334 g Na
3
PO
4
(phân lân). Cho biết bác nông dân đó
chuẩn bị bón phân cho cây thanh long ở giai đoạn nào?
Câu IV. Hiđrocacbon và nhiệt của phản ứng (2,0 điểm)
1. Đốt cháy hoàn toàn 4,16 gam hiđrocacbon A (mạch hở, là chất khí ở điều kiện thường
và M
A
> 26) rồi dẫn hỗn hợp sản phẩm cháy vào dung dịch Ca(OH)
2
dư, thu được 32
gam kết tủa trắng.
a) Tìm công thức phân tử và viết công thức cấu tạo của A.
b) Dẫn 1,12 lít A (đktc) vào lượng dư dung dịch AgNO
3
/NH
3
, thu được m gam kết tủa.
Tính m.
2. Biến thiên entanpi của phản ứng (kí hiệu là ∆H) có thể hiểu đơn giản là nhiệt tỏa ra
hoặc thu vào khi phản ứng hóa học xảy ra. Nếu phản ứng tỏa nhiệt thì ∆H có dấu âm và
ngược lại, nếu phản ứng thu nhiệt thì ∆H có dấu dương.
4
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Khi một phản ứng hóa học xảy ra, các liên kết trong chất phản ứng bị cắt đứt và liên kết
mới được hình thành, tạo nên chất sản phẩm. Để tính ∆H của phản ứng, người ta dựa
vào năng lượng các liên kết (E
lk
). E
lk
là năng lượng cần cung cấp để cắt đứt một liên kết
thành các nguyên tử ở thể khí. Năng lượng tỏa ra khi hình thành liên kết đó từ các
nguyên tử ở thể khí cũng có giá trị bằng giá trị của E
lk
nhưng có dấu ngược lại. E
lk
của
một số liên kết được cho trong bảng sau:
Liên kết C≡C C-C C-H H-H
Elk (kJ/mol) 839,0 343,3 418,4 432,0
Xét phản ứng:
C
2
H
2
+ 2H
2
→ C
2
H
6
(1)
Dựa vào bảng số liệu trên hãy:
a) Tính năng lượng cần cung cấp để phá vỡ liên kết của các chất tham gia trong phản
ứng (1) (lưu ý hệ số của các chất trong phương trình phản ứng).
b) Tính năng lượng tỏa ra khi hình thành các liên kết trong chất sản phẩm của phản ứng
(1).
c) Từ các kết quả trên, xác định ∆H của phản ứng (1) và cho biết phản ứng (1) tỏa nhiệt
hay thu nhiệt?
Câu V. Axit hữu cơ, este và tác nhân phản ứng (2,0 điểm)
1. Axit X (chỉ chứa C, H, O trong phân tử) là một hợp chất hữu cơ sinh học. Khi vận
động mạnh trong một thời gian dài và cơ thể không được cung cấp đủ oxi, glucozơ trong
cơ thể sẽ bị chuyển hóa thành axit X. Axit X sinh ra trong quá trình vận động là nguyên
nhân chính tạo ra cảm giác mỏi ở cơ bắp. Axit X cũng có mặt trong sữa chua và dưa
muối.
a) Bằng phương pháp phổ khối lượng MS, người ta xác định được phân tử khối của X là
90. Bằng các phương pháp phổ hiện đại khác như phổ hồng ngoại IR và phổ cộng hưởng
từ hạt nhân NMR, người ta xác định được phân tử của X chứa các nhóm chức –OH và –
COOH cùng liên kết với một nguyên tử cacbon. Xác định công thức phân tử và công
thức cấu tạo của X.
5
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85