Trường THPT………
BÀI 14. TÍNH BIẾN THIÊN ENTHALPY
CỦA PHẢN ỨNG HOÁ HỌC
GV: …………………………………………………….. TRÒ CHƠI Ô CHỮ 1 T O Ả N H I Ệ T
2 E N T H A L P Y T Ạ O T H À N H 3 T H Ấ P H Ơ N Câu 1: 2: 3: Sul N f hi ur ệt ic a kè Cho phư cid m ơn đặ the g tr c thê o ph m ình nhi v ản ứ ào nư ng t ệt hoá ớc làm c ạo thà họ nh t c sau:ừ ho n 1 m ư olớc c hất từ 0 nóng cáH lên là quá c đơn chấ1
(g) O (g) H O(l) H 285,24kJ 2 2 t2rình toả t bền là nhiệ 2 t hay thu nhi r 298 ệt. So sánh giá trị 0
H (sp) so với 0 H ( d c ) f 298 f 298
1. XÁC ĐỊNH BIẾN THIÊN ENTHALPY
CỦA PHẢN ỨNG DỰA VÀO NĂNG LƯỢNG LIÊN KẾT
PHIẾU HỌC TẬP SỐ 1
Quan sát Hình 14.1 cho biết liên kết hóa học nào bị phá vỡ, liên
kết hóa học nào được hình thành khi H phản ứng với O tạo 2 2 thành H O (ở thể khí)? 2
Giáo án powerpoint Tính biến thiên enthalpy của phản ứng hóa học Hóa học 10 Chân trời sáng tạo
702
351 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Bộ bài giảng điện tử Hóa học 10 Chân trời sáng tạo được cập nhật liên tục trong gói này từ nay đến hết tháng 3/2024.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Bộ bài giảng powerpoint Hóa học 10 Chân trời sáng tạo bao gồm đầy đủ các bài giảng cả năm. Bộ bài giảng được thiết kế theo phong cách hiện đại, đẹp mắt, trình bày chi tiết cho từng phần học và bám sát chương trình Sách giáo khoa Hóa học 10 Chân trời sáng tạo.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(702 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 10
Xem thêmTài liệu bộ mới nhất

Trường THPT………
GV: ……………………………………………………..
BÀI 14. TÍNH BIẾN THIÊN ENTHALPY
CỦA PHẢN ỨNG HOÁ HỌC

TRÒ CHƠI Ô CHỮ
T O Ả N H I Ệ T
E N T H A L P Y T Ạ OT H À N H
T H Ấ P H ƠN
1
2
3
Câu 1: Sulfuric acid đặc thêm vào nước làm cho nước
nóng lên là quá trình toả nhiệt hay thu nhiệt.
Câu 2: Nhiệt kèm theo phản ứng tạo thành từ 1 mol chất từ
các đơn chất bền là
Câu 3: Cho phương trình nhiệt hoá học sau:
So sánh giá trị so với
1
2 2 2
2
( ) ( ) ( )H g O g H O l
0
298
285, 24
r
H kJ
0
298
( )
f
H sp
0
298
( d)
f
H c

1. XÁC ĐỊNH BIẾN THIÊN ENTHALPY
CỦA PHẢN ỨNG DỰA VÀO NĂNG LƯỢNG
LIÊN KẾT
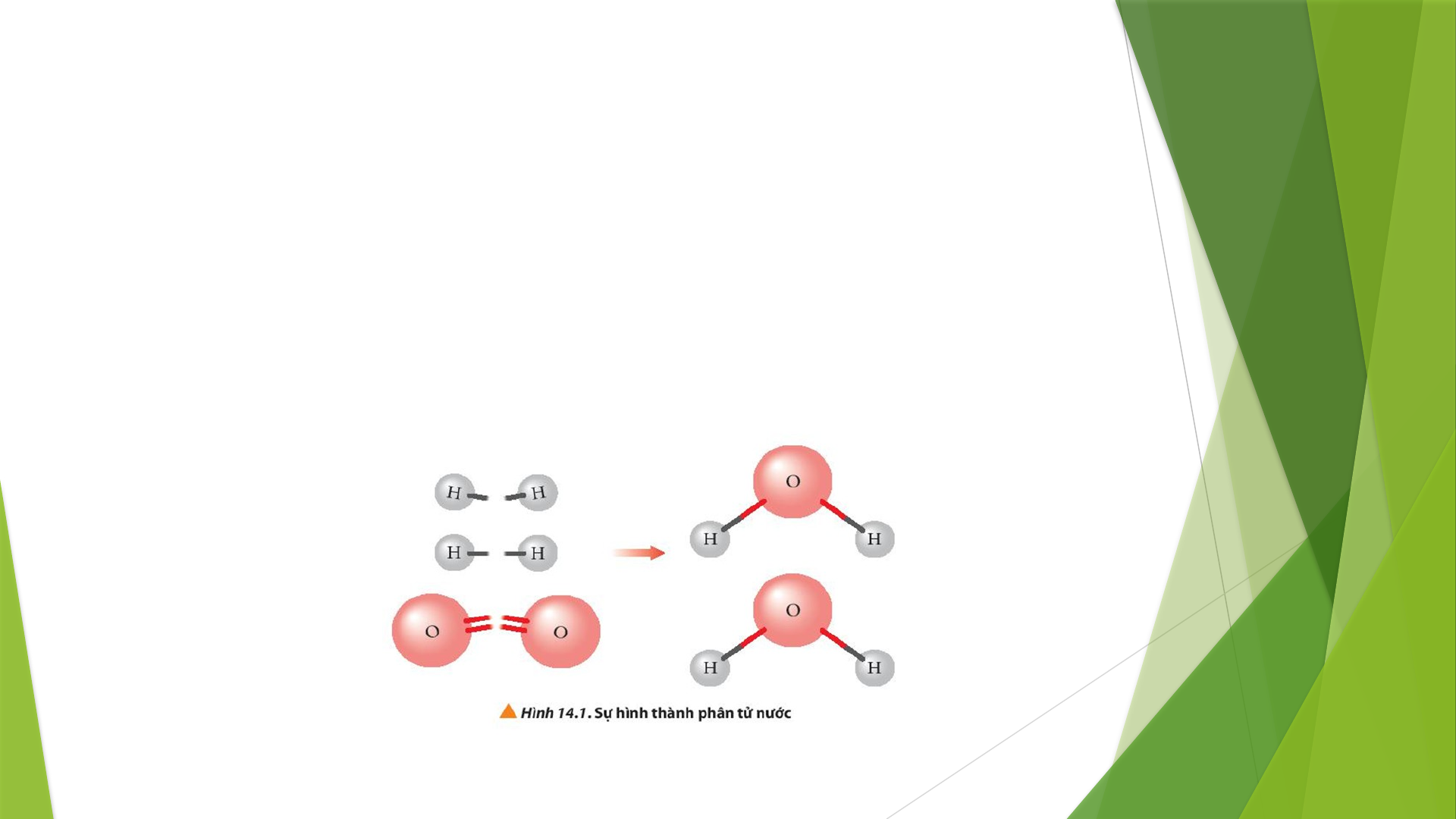
PHIẾU HỌC TẬP SỐ 1
Quan sát Hình 14.1 cho biết liên kết hóa học nào bị phá vỡ, liên
kết hóa học nào được hình thành khi H
2
Dphản ứng với O
2
Dtạo
thành H
2
O (ở thể khí)?

PHIẾU HỌC TẬP SỐ 2
Để tính biến thiên enthalpy của phản ứng dựa vào năng
lượng liên kết phải viết được công thức cấu tạo của tất
cả các chất trong phản ứng để xác định số lượng và
loại liên kết. Xác định số lượng mỗi loại liên kết trong
các phân tử sau: CH
4
, CH
3
Cl, NH
3
, CO
2
.