CHƯƠNG 5
BÀI 10: ĐIỀU CHẾ KIM LOẠI Mục tiêu Kiến thức
+ Trình bày được nguyên tắc chung để điều chế kim loại.
+ Nêu được nguyên tắc điều chế kim loại bằng phương pháp điện phân.
+ Nêu được nguyên tắc điều chế kim loại bằng phương pháp nhiệt luyện.
+ Nêu được nguyên tắc điều chế kim loại bằng phương pháp thủy luyện. Kĩ năng
+ Biết cách lựa chọn được phương pháp điều chế kim loại cụ thể cho phù hợp.
+ Viết được các phương trình hóa học điều chế kim loại cụ thể.
+ Giải được các bài tập về tính khối lượng nguyên liệu sản xuất được một lượng kim loại xác
định theo hiệu suất hoặc ngược lại…
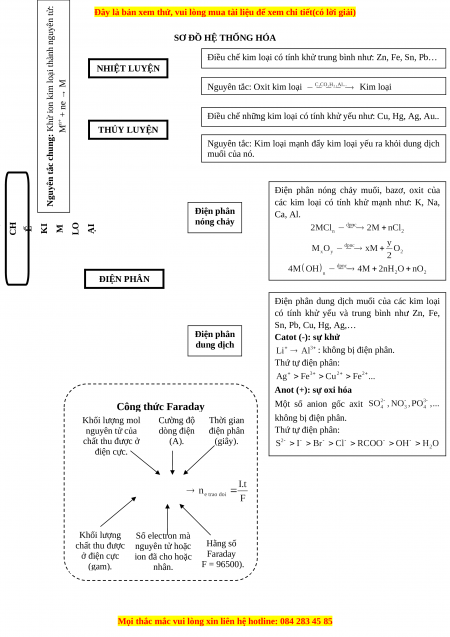
I. LÍ THUYẾT TRỌNG TÂM A. Nguyên tắc chung
Khử ion kim loại thành nguyên tử: B. Phương pháp
1. Phương pháp nhiệt luyện
Điều chế kim loại có tính khử trung bình như: Zn, Fe, Sn, Pb…
Ví dụ: Fe2O3 + 3CO 2Fe + 3CO2
Nguyên tắc: Oxit kim loại Kim loại
2. Phương pháp thủy luyện
Điều chế những kim loại có tính khử yếu như: Cu, Hg, Ag, Au… Ví dụ: Fe + → + Cu
Nguyên tắc: Kim loại mạnh đẩy kim loại yếu ra khỏi dung dịch muối của nó.
3. Phương pháp điện phân
a. Điện phân nóng chảy
Điều chế kim loại hoạt động hóa học mạnh như: K, Na,
Ví dụ: 2Al2O3 4Al + 3O2 ↑ Ca, Mg, Al. Ở catot:
Nguyên tắc: Khử ion kim loại bằng dòng điện (Điện phân Ở anot:
nóng chảy muối, bazơ, oxit của các kim loại có tính khử mạnh).
b. Điện phân dung dịch Ví dụ: CuCl2 Cu + Cl2
Điều chế kim loại hoạt động trung bình hoặc yếu. Ở catot:
Nguyên tắc: Điện phân dung dịch muối của chúng. Ở anot: Công thức Faraday: Trong đó:
m: Khối lượng chất thu được ở cực âm (gam).
A: Khối lượng mol nguyên tử chất thu được ở điện cực.
n: Số electron mà nguyên tử hoặc ion đã cho hoặc nhận.
I: Cường độ dòng điện (ampe).
t: Thời gian điện phân (giây).
F: Hằng số Faraday (F = 96500).
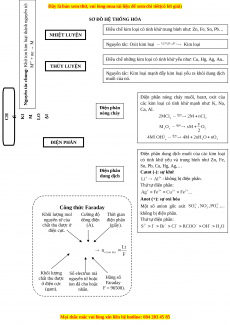
SƠ ĐỒ HỆ THỐNG HÓA
Điều chế kim loại có tính khử trung bình như: Zn, Fe, Sn, Pb… NHIỆT LUYỆN loại thành nguyên tử: M
Nguyên tắc: Oxit kim loại Kim loại ne → +
Điều chế những kim loại có tính khử yếu như: Cu, Hg, Ag, Au.. hử ion kim n+ M THỦY LUYỆN ng: K
Nguyên tắc: Kim loại mạnh đẩy kim loại yếu ra khỏi dung dịch u muối của nó. tắc ch yên
Điện phân nóng chảy muối, bazơ, oxit của gu N
các kim loại có tính khử mạnh như: K, Na, Điện phân Ca, Al. nóng chảy I I I Đ U H O Ề C Ế K M L Ạ ĐIỆN PHÂN
Điện phân dung dịch muối của các kim loại
có tính khử yếu và trung bình như Zn, Fe, Sn, Pb, Cu, Hg, Ag,… Điện phân Catot (-): sự khử dung dịch : không bị điện phân. Thứ tự điện phân: Anot (+): sự oxi hóa
Một số anion gốc axit Công thức Faraday không bị điện phân. Khối lượng mol Cường độ Thời gian nguyên tử của dòng điện điện phân Thứ tự điện phân: chất thu được ở (A). (giây). điện cực. Khối lượng Số electron mà Hằng số chất thu được nguyên tử hoặc Faraday ở điện cực
ion đã cho hoặc (F = 96500). (gam). nhận.
II. CÁC DẠNG BÀI TẬP
Dạng 1: Lí thuyết trọng tâm Ví dụ mẫu
Ví dụ 1: Nguyên tắc chung để điều chế kim loại là
A. oxi hóa ion kim loại trong hợp chất thành nguyên tử kim loại.
B. khử ion kim loại trong hợp chất thành nguyên tử kim loại.
C. cho hợp chất chứa ion kim loại tác dụng với chất oxi hóa.
D. cho hợp chất chứa ion kim loại tác dụng với chất khử.
Hướng dẫn giải
Nguyên tắc điều chế kim loại là khử ion kim loại thành nguyên tử. → Chọn B.
Ví dụ 2: Dãy các kim loại có thể điều chế bằng phương pháp nhiệt luyện là: A. Na, Fe, Cu B. Fe, Cu, Zn C. Mg, K, Cu D. Na, Ca, Ba
Hướng dẫn giải
Phương pháp nhiệt luyện dùng để điều chế các kim loại trung bình và yếu.
→ Các kim loại đứng sau Al trong dãy điện hóa đều có thể được điều chế bằng
phương pháp nhiệt luyện.
Vì Na, Mg, K, Ca, Ba đều đứng trước Al trong dãy điện hóa → Loại A, C, D. → Chọn B.
Ví dụ 3: Cho một luồng khí H2 dư đi qua ống sứ chứa CuO, PbO, CaO, Al2O3,
Fe2O3 nung nóng ở nhiệt độ cao. Sau khi phản ứng xảy ra hoàn toàn, chất rắn
còn lại trong ống sứ là:
A. Cu, Pb, Ca, Al2O3, Fe B. CuO, PbO, Ca, Al, Fe
C. Cu, Pb, CaO, Al2O3, Fe D. Cu, PbO, CaO, Al, Fe
Hướng dẫn giải
H2 khử được oxit của các kim loại đứng sau Al trong dãy điện hóa thành kim loại.
→ H2 khử được CuO, PbO, Fe2O3 thành Cu, Pb và Fe.
→ Chất rắn còn lại trong ống sử là Cu, Pb, CaO, Al2O3, Fe. → Chọn C.
Ví dụ 4: Trong quá trình điện phân dung dịch Pb(NO3)2 với các điện cực trơ, ion di chuyển về
A. anot và bị khử. B. catot và bị oxi hóa.
C. catot và bị khử.
D. anot và bị oxi hóa.
Hướng dẫn giải
Chuyên đề luyện thi Hóa học 12 năm 2023 cực hay - Phần 5: Điều chế kim loại
614
307 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Tài liệu được cập nhật liên tục trong gói này từ nay đến hết tháng 6/2023. Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu bộ chuyên đề luyện thi môn Hóa học 12 bao gồm: "Phần 5: Đại Cương Về Kim Loại" mới nhất năm 2022 - 2023 nhằm giúp Giáo viên có thêm tài liệu tham khảo chuyên đề luyện thi Hóa học 12.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(614 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 12
Xem thêmTài liệu bộ mới nhất

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết(có lời giải)
CHƯƠNG 5
BÀI 10: ĐIỀU CHẾ KIM LOẠI
Mục tiêu
Kiến thức
+ Trình bày được nguyên tắc chung để điều chế kim loại.
+ Nêu được nguyên tắc điều chế kim loại bằng phương pháp điện phân.
+ Nêu được nguyên tắc điều chế kim loại bằng phương pháp nhiệt luyện.
+ Nêu được nguyên tắc điều chế kim loại bằng phương pháp thủy luyện.
Kĩ năng
+ Biết cách lựa chọn được phương pháp điều chế kim loại cụ thể cho phù hợp.
+ Viết được các phương trình hóa học điều chế kim loại cụ thể.
+ Giải được các bài tập về tính khối lượng nguyên liệu sản xuất được một lượng kim loại xác
định theo hiệu suất hoặc ngược lại…
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết(có lời giải)
I. LÍ THUYẾT TRỌNG TÂM
A. Nguyên tắc chung
Khử ion kim loại thành nguyên tử:
B. Phương pháp
1. Phương pháp nhiệt luyện
Điều chế kim loại có tính khử trung bình như: Zn, Fe, Sn,
Pb…
Nguyên tắc: Oxit kim loại Kim loại
2. Phương pháp thủy luyện
Điều chế những kim loại có tính khử yếu như: Cu, Hg, Ag,
Au…
Nguyên tắc: Kim loại mạnh đẩy kim loại yếu ra khỏi dung
dịch muối của nó.
3. Phương pháp điện phân
a. Điện phân nóng chảy
Điều chế kim loại hoạt động hóa học mạnh như: K, Na,
Ca, Mg, Al.
Nguyên tắc: Khử ion kim loại bằng dòng điện (Điện phân
nóng chảy muối, bazơ, oxit của các kim loại có tính khử
mạnh).
b. Điện phân dung dịch
Điều chế kim loại hoạt động trung bình hoặc yếu.
Nguyên tắc: Điện phân dung dịch muối của chúng.
Công thức Faraday:
Trong đó:
m: Khối lượng chất thu được ở cực âm (gam).
A: Khối lượng mol nguyên tử chất thu được ở điện cực.
n: Số electron mà nguyên tử hoặc ion đã cho hoặc nhận.
I: Cường độ dòng điện (ampe).
t: Thời gian điện phân (giây).
F: Hằng số Faraday (F = 96500).
Ví dụ: Fe
2
O
3
+ 3CO 2Fe + 3CO
2
Ví dụ: Fe + → + Cu
Ví dụ: 2Al
2
O
3
4Al + 3O
2
↑
Ở catot:
Ở anot:
Ví dụ: CuCl
2
Cu + Cl
2
Ở catot:
Ở anot:
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết(có lời giải)
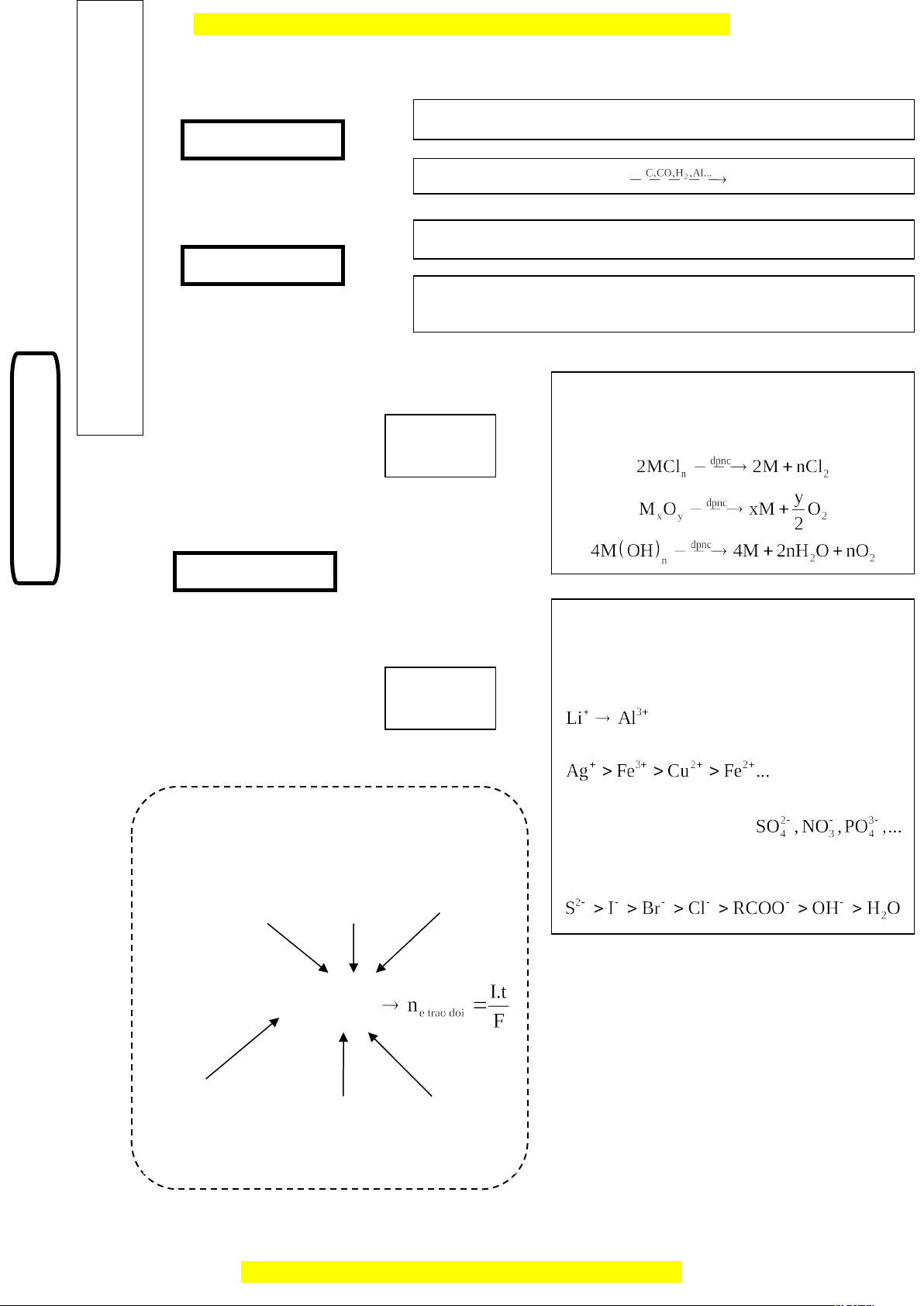
SƠ ĐỒ HỆ THỐNG HÓA
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
NHIỆT LUYỆN
Điều chế kim loại có tính khử trung bình như: Zn, Fe, Sn, Pb…
Nguyên tắc: Oxit kim loại Kim loại
Điều chế những kim loại có tính khử yếu như: Cu, Hg, Ag, Au..
Nguyên tắc: Kim loại mạnh đẩy kim loại yếu ra khỏi dung dịch
muối của nó.
THỦY LUYỆN
ĐIỆN PHÂN
Điện phân
nóng chảy
Điện phân
dung dịch
Điện phân nóng chảy muối, bazơ, oxit của
các kim loại có tính khử mạnh như: K, Na,
Ca, Al.
Điện phân dung dịch muối của các kim loại
có tính khử yếu và trung bình như Zn, Fe,
Sn, Pb, Cu, Hg, Ag,…
Catot (-): sự khử
: không bị điện phân.
Thứ tự điện phân:
Anot (+): sự oxi hóa
Một số anion gốc axit
không bị điện phân.
Thứ tự điện phân:
Công thức Faraday
Cường độ
dòng điện
(A).
Thời gian
điện phân
(giây).
Khối lượng mol
nguyên tử của
chất thu được ở
điện cực.
Hằng số
Faraday
(F = 96500).
Số electron mà
nguyên tử hoặc
ion đã cho hoặc
nhận.
Khối lượng
chất thu được
ở điện cực
(gam).
ĐI
ỀU
CH
Ế
KI
M
LO
ẠI
Nguyên tắc chung: Khử ion kim loại thành nguyên tử:
M
n+
+ ne → M

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết(có lời giải)
II. CÁC DẠNG BÀI TẬP
Dạng 1: Lí thuyết trọng tâm
Ví dụ mẫu
Ví dụ 1: Nguyên tắc chung để điều chế kim loại là
A. oxi hóa ion kim loại trong hợp chất thành nguyên tử kim loại.
B. khử ion kim loại trong hợp chất thành nguyên tử kim loại.
C. cho hợp chất chứa ion kim loại tác dụng với chất oxi hóa.
D. cho hợp chất chứa ion kim loại tác dụng với chất khử.
Hướng dẫn giải
Nguyên tắc điều chế kim loại là khử ion kim loại thành nguyên tử.
→ Chọn B.
Ví dụ 2: Dãy các kim loại có thể điều chế bằng phương pháp nhiệt luyện là:
A. Na, Fe, Cu B. Fe, Cu, Zn C. Mg, K, Cu D. Na, Ca, Ba
Hướng dẫn giải
Phương pháp nhiệt luyện dùng để điều chế các kim loại trung bình và yếu.
→ Các kim loại đứng sau Al trong dãy điện hóa đều có thể được điều chế bằng
phương pháp nhiệt luyện.
Vì Na, Mg, K, Ca, Ba đều đứng trước Al trong dãy điện hóa → Loại A, C, D.
→ Chọn B.
Ví dụ 3: Cho một luồng khí H
2
dư đi qua ống sứ chứa CuO, PbO, CaO, Al
2
O
3
,
Fe
2
O
3
nung nóng ở nhiệt độ cao. Sau khi phản ứng xảy ra hoàn toàn, chất rắn
còn lại trong ống sứ là:
A. Cu, Pb, Ca, Al
2
O
3
, Fe B. CuO, PbO, Ca, Al, Fe
C. Cu, Pb, CaO, Al
2
O
3
, Fe D. Cu, PbO, CaO, Al, Fe
Hướng dẫn giải
H
2
khử được oxit của các kim loại đứng sau Al trong dãy điện hóa thành kim
loại.
→ H
2
khử được CuO, PbO, Fe
2
O
3
thành Cu, Pb và Fe.
→ Chất rắn còn lại trong ống sử là Cu, Pb, CaO, Al
2
O
3
, Fe.
→ Chọn C.
Ví dụ 4: Trong quá trình điện phân dung dịch Pb(NO
3
)
2
với các điện cực trơ,
ion di chuyển về
A. anot và bị khử. B. catot và bị oxi hóa.
C. catot và bị khử. D. anot và bị oxi hóa.
Hướng dẫn giải
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết(có lời giải)
Trong quá trình điện phân dung dịch Pb(NO
3
)
2
với các điện cực trơ, ion di
chuyển về phía catot và xảy ra quá trình khử ion thành kim loại.
Bên anot xảy ra quá trình điện phân nước.
2H
2
O → O
2
+ + 4e
→ Chọn C.
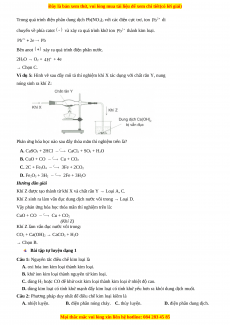
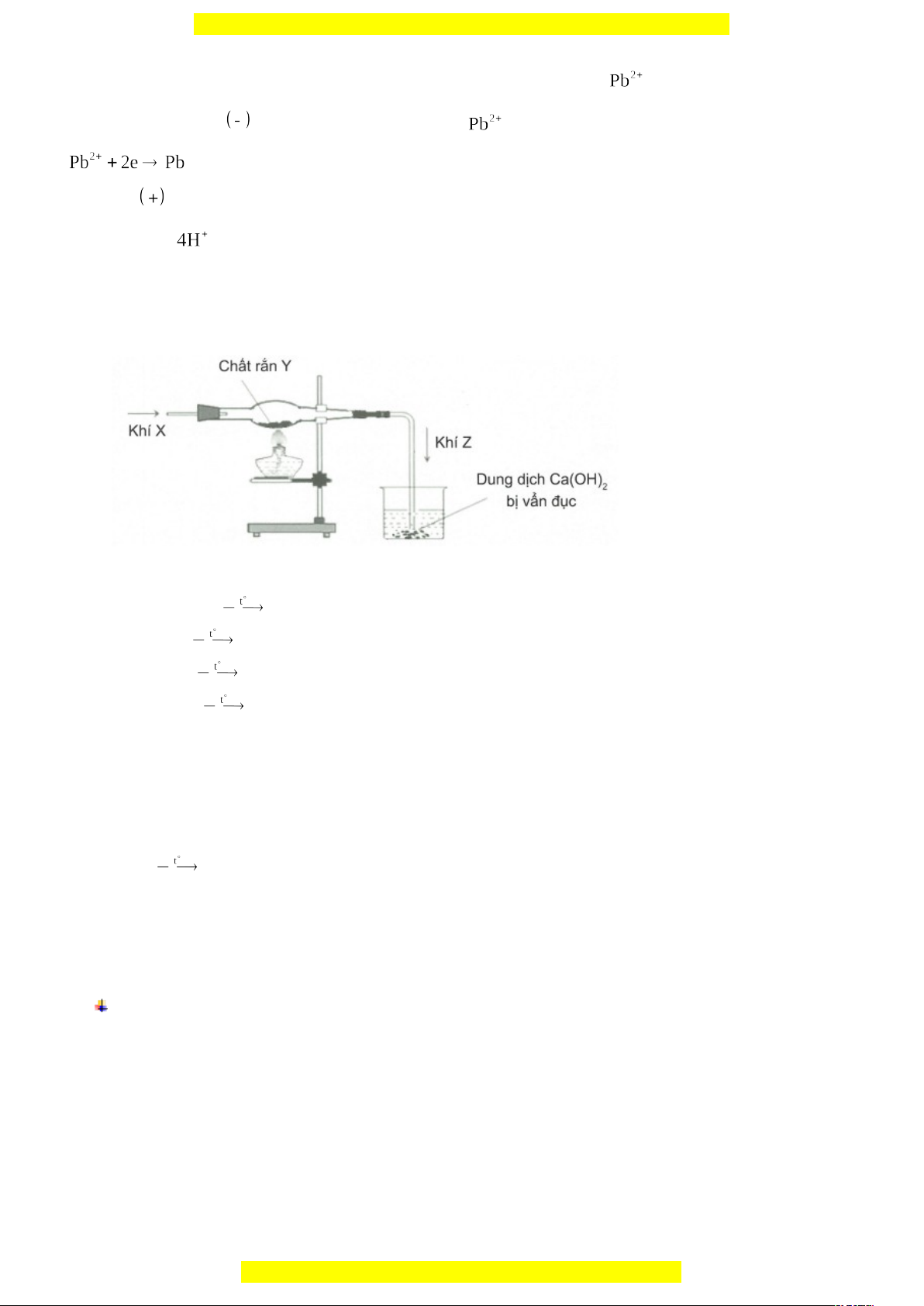
Ví dụ 5: Hình vẽ sau đây mô tả thí nghiệm khí X tác dụng với chất rắn Y, nung
nóng sinh ra khí Z:
Phản ứng hóa học nào sau đây thỏa mãn thí nghiệm trên là?
A. CaSO
3
+ 2HCl CaCl
2
+ SO
2
+ H
2
O
B. CuO + CO Cu + CO
2
C. 2C + Fe
3
O
4
3Fe + 2CO
2
D. Fe
2
O
3
+ 3H
2
2Fe + 3H
2
O
Hướng dẫn giải
Khí Z được tạo thành từ khí X và chất rắn Y → Loại A, C.
Khí Z sinh ra làm vẩn đục dung dịch nước vôi trong → Loại D.
Vậy phản ứng hóa học thỏa mãn thí nghiệm trên là:
CuO + CO Cu + CO
2
(Khí Z)
Khí Z làm vẩn đục nước vôi trong:
CO
2
+ Ca(OH)
2
→ CaCO
3
+ H
2
O
→ Chọn B.
Bài tập tự luyện dạng 1
Câu 1: Nguyên tắc điều chế kim loại là
A. oxi hóa ion kim loại thành kim loại.
B. khử ion kim loại thành nguyên tử kim loại.
C. dùng H
2
hoặc CO để khử oxit kim loại thành kim loại ở nhiệt độ cao.
D. dùng kim loại có tính khử mạnh đẩy kim loại có tính khử yếu hơn ra khỏi dung dịch muối.
Câu 2: Phương pháp duy nhất để điều chế kim loại kiềm là
A. nhiệt luyện. B. điện phân nóng chảy. C. thủy luyện. D. điện phân dung dịch.
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85