TRƯỜNG THPT CHUYÊN
KÌ THI CHỌN HỌC SINH GIỎI KHU VỰC
LÊ KHIẾT - QUẢNG NGÃI
DUYÊN HẢI VÀ ĐỒNG BẰNG BẮC BỘ
LẦN THỨ XV - NĂM 2024
MÔN THI: HOÁ HỌC LỚP 10 ĐỀ THI ĐỀ XUẤT
(Đề thi gồm 05 trang)
(Thời gian làm bài 180 phút)
Câu 1: (2,5 điểm) Cấu tạo nguyên tử. Phản ứng hạt nhân. ĐL tuần hoàn
Năm 1888, nhà Vật lí Thụy Điển Johannes Rydberg đã công bố một công thức
mà ngày nay được đặt theo tên ông cho số sóng của các vạch phổ trong quang phổ hydrogen: (1)
Với hydrogen, giá trị hằng số Rydberg là RH = 109 678 cm–1. Công thức giúp
xác định năng lượng ion hóa chính xác của nguyên tử H ở trạng thái cơ bản (13,6 eV),
cũng như số sóng hoặc bước sóng của các vạch phố trong các dãy khác nhau.
Một dãy phổ của nguyên tử H bắt đầu ở 7459,9 nm và có vạch sóng ngắn nhất ở 2279,4 nm.
a) Xác định số lượng tử n của dãy này.
b) Xác định bước sóng của ba vạch đầu của dãy này, nghĩa là với (1) n2 = n1 +1,
(2) n2 = n1 + 2 và (3) n2 = n1 + 3.
c) Cho biết các vạch phổ này thuộc ở những vùng nào trong phổ điện từ (,
Röntgen, tử ngoại, khả kiến, hồng ngoại,...)
Hằng số Rydberg có thể được chia thành hai phần và tổng quát hóa: trong đó (2)
H là khối lượng rút gọn của nguyên tử hydrogen (một proton và một electron),
me là khối lượng electron và còn lại là các hằng số tự nhiên khác.
Như đã biết, phương trình Schrödinger cũng cho biết các mức năng lượng của
electron trong nguyên tử hydrogen, và trong các ion tựa hydrogen nói chung với
nguyên tử khối Z và khối lượng rút gọn : Trang 1/5 (3)
d) Trước tiên, hãy chứng minh rằng công thức Rydberg (1) có thể nhận được từ
công thức (3) bằng cách chia (3) cho số sóng của bước chuyển giữa các mức n1 và n2 trong hydrogen (Z =1).
e) Tính hằng số Rydberg RLi cho ion Li2+ theo cm–1. Sử dụng giá trị khối lượng hạt nhân Li là 6,941 amu.
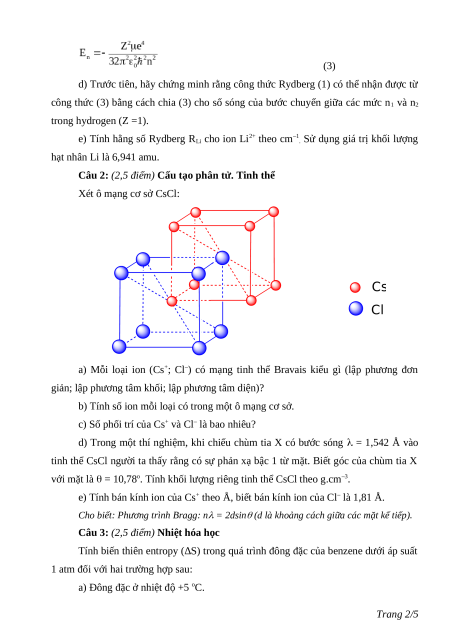
Câu 2: (2,5 điểm) Cấu tạo phân tử. Tinh thể Xét ô mạng cơ sở CsCl: Cs Cl
a) Mỗi loại ion (Cs+; Cl–) có mạng tinh thể Bravais kiểu gì (lập phương đơn
giản; lập phương tâm khối; lập phương tâm diện)?
b) Tính số ion mỗi loại có trong một ô mạng cơ sở.
c) Số phối trí của Cs+ và Cl– là bao nhiêu?
d) Trong một thí nghiệm, khi chiếu chùm tia X có bước sóng = 1,542 Å vào
tinh thể CsCl người ta thấy rằng có sự phản xạ bậc 1 từ mặt. Biết góc của chùm tia X
với mặt là = 10,78o. Tính khối lượng riêng tinh thể CsCl theo g.cm–3.
e) Tính bán kính ion của Cs+ theo Å, biết bán kính ion của Cl– là 1,81 Å.
Cho biết: Phương trình Bragg: n = 2dsin (d là khoảng cách giữa các mặt kế tiếp).
Câu 3: (2,5 điểm) Nhiệt hóa học
Tính biến thiên entropy (∆S) trong quá trình đông đặc của benzene dưới áp suất
1 atm đối với hai trường hợp sau:
a) Đông đặc ở nhiệt độ +5 oC. Trang 2/5
b) Đông đặc ở nhiệt độ –5 oC.
Cho biết: Nhiệt độ đông đặc của benzene là +5 oC, enthalpy nóng chảy ∆Hnc = 9,916
kJ.mol–1, nhiệt dung Cp (benzene lỏng) = 126,8 J.mol–1.K–1, Cp (benzene rắn) = 122,6 J.mol– 1.K–1.
Trong mỗi trường hợp hãy sử dụng biến thiên entropy (với độ chính xác 2 số
sau dấu phẩy) làm tiêu chuẩn để xét chiều của quá trình và điều kiện cân bằng của hệ.
Câu 4: (3,0 điểm) Động hóa học (không có cơ chế). Cân bằng hóa học trong pha khí
4.1. Khảo sát bằng thực nghiệm ở 25 oC phản ứng thủy phân methyl acetate với
sự có mặt của HCl dư, nồng độ 0,05 M. Thể tích dung dịch NaOH có nồng độ cố định
dùng để trung hòa 20 mL hỗn hợp phản ứng theo thời gian như sau: t (min) 0 21 75 119 V dd NaOH (mL) 19,52 20,64 23,44 25,36 37,76
a) Viết phương trình hóa học của phản ứng xảy ra.
b) Chứng minh phản ứng thủy phân methyl acetate là phản ứng bậc 1. Tính
hằng số tốc độ và thời gian nửa phản ứng.
4.2. Giảm thiểu tối đa sự phát thải khí độc CO là một trong những vấn đề cấp
thiết của nhiều cơ sở công nghiệp, đặc biệt là với các lò thiêu hủy chất thải rắn. Một
trong các giải pháp được đề xuất là chuyển hóa CO bằng hơi nước theo phản ứng:
H2O(g) + CO(g) ⇌ H2(g) + CO2(g) (a)
Cho 0,2 mol H2O và 0,1 mol CO vào bình chân không ở 450 oC. Khi phản ứng
(a) đạt đến cân bằng hỗn hợp phản ứng chứa 0,09 mol CO2.
a) Tính hằng số cân bằng của phản ứng (a) ở 450 oC.
b) Phản ứng (a) cần được tiến hành ở nhiệt độ bao nhiêu để 99% lượng CO ban
đầu bị chuyển hóa thành CO2.
Cho biết: Biến thiên enthalpy tạo thành (kJ.mol–1) của các chất ở 25 oC và 1 bar:
CO(g): –110,5; CO2(g): –393,51; H2O(g): –241,84.
Câu 5: (3,0 điểm) Cân bằng acid – base và cân bằng các hợp chất ít tan.
Phương án thực hành
5.1. Dung dịch A gồm CH3COOH 0,10 M và H3PO4 0,10 M.
a) Tính pH của dung dịch A. Trang 3/5
b) Trộn 10,00 mL dung dịch A với 10,00 mL dung dịch B gồm NaOH 0,100 M và NH3
0,100 M, thu được 20,00 mL dung dịch C. Xác định thành phần giới hạn của dung dịch C.
c) Thêm 1 giọt dung dịch chỉ thị phenolphthalein vào dung dịch C. Không tính
pH, hãy cho biết màu của dung dịch C (Coi thể tích của chỉ thị phenolphthalein là
không đáng kể). Biết rằng phenolphthalein xuất hiện màu hồng nếu pH 9,0, còn pH
8,0 thì dung dịch không có màu.
d) Tính giá trị pH của dung dịch C. Cho biết: CH +
3COOH có pKa = 4,76; NH4 có pKa = 9,24; H3PO4 có pKa1 = 2,15; pKa2 = 7,21; pKa3 = 12,32.
5.2. Quy trình chuẩn độ dung dịch A gồm Na2CO3 0,040 M và NaHCO3 0,040 M như sau:
Lấy 10,0 mL dung dịch trên cho vào bình nón, thêm vài giọt chất chỉ thị X và chuẩn
độ bằng dung dịch HCl 0,040 M đến khi dung dịch đổi màu thì dừng lại. Thêm tiếp vài giọt
chất chỉ thị Y vào dung dịch thu được ở trên. Chuẩn độ tiếp bằng dung dịch HCl 0,040 M
đến khi dung dịch đổi màu.
Hãy tính pH tại điểm tương đương thứ nhất và thứ hai, từ đó chọn chất chỉ thị X, Y
thích hợp từ những chất chỉ thị cho dưới đây. Cho biết CO2 tạo thành tan hoàn toàn trong
dung dịch; Hỗn hợp H2O + CO2 có pKa1 = 6,62; pKa2 = 10,35. Độ tan của CO2 là = 0,03 M. Chất chỉ thị Khoảng pH đổi màu Chất chỉ thị Khoảng pH đổi màu Metyl lục 0,1–2,0 Bromthymol xanh 6,0–7,6 Metyl da cam 3,1–4,4 Phenolphtalein 8,0–10,0 Metyl đỏ 4,2–6,2 Alizarin vàng 10,1–12,1
Câu 6: (2,5 điểm) Phản ứng oxi hóa – khử. Pin điện (không liên quan phức chất)
Kỹ thuật điện hóa thường được dùng để xác định độ tan của các muối khó tan. Cho pin điện hóa:
(–) Zn | Zn(NO3)2 0,2M || AgNO3 0,1 M | Ag (+) Trang 4/5
Đề thi HSG Hóa học 10 Trường THPT Chuyên Lê Khiết - Quảng Ngãi
811
406 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu Tổng hợp đề thi chọn học sinh giỏi Hóa học 10 của các trường THPT Chuyên khu vực Duyên hải và Đồng bằng Bắc Bộ gồm 29 đề đề xuất và 1 đề chính thức có lời giải giúp giáo viên, học sinh có thêm tài liệu tham khảo.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(811 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)