SỞ GIÁO DỤC VÀ ĐÀO TẠO QUẢNG NINH
ĐỀ ĐỀ XUẤT DUYÊN HẢI BẮC BỘ
TRƯỜNG THPT CHUYÊN HẠ LONG NĂM HỌC 2023 - 2034 -----***----- Môn: HÓA HỌC - 10
Thời gian làm bài: 180 phút
Câu 1. (2,5 điểm) Cấu tạo chất. Phản ứng hạt nhân. Định luật tuần hoàn
1. Phương pháp nhiễu xạ neutron được sử dụng rộng rãi trong việc xác định các tính
chất và cấu trúc của chất. Một yêu cầu quan trọng trong phương pháp này là các neutron
phải có bước sóng de Broglie ngắn và chuyển động theo cùng một hướng. Điều này có thể
đạt được bằng cách sử dụng các máy gia tốc neutron năng lượng cao.
a) Neutron có khả năng đâm xuyên vật chất rất lớn, chẳng hạn dễ dàng xuyên qua lớp
chì kim loại dày 10 cm. Hãy nêu các nguyên nhân để giải thích khả năng đâm xuyên này của neutron.
b) Tốc độ của neutron có thể được tính từ công thức v = √3kT/m, m là khối lượng
của neutron (1,67.10−27kg), kB là hằng số Boltzman (1,38.10−23 m2∙kg∙s−2∙K−1). Hãy xác
định nhiệt độ cần áp đặt lên neutron để thu được neutron có bước sóng de Broglie là 0,2
nm. Vì sao khi xác định cấu trúc của chất bằng phương pháp nhiễu xạ neutron, dòng
neutron có nhiệt độ thấp lại được dùng phổ biến?
2. Một mẫu phóng xạ nặng 3 gam chứa các đồng vị A1 (35% về khối lượng, T1/2 = 2,1
ngày) và A2 (65 % về khối lượng, T1/2 = 4,4 ngày). Số khối của A1 lớn hơn số khối của A
là 1 amu, số khối của A2 nhỏ hơn của A là 3 amu. Biết rằng sau 12 giờ kể từ khi điều chế
thì độ phóng xạ của mẫu là 4,61∙105 Curie. Độ phóng xạ của mẫu chứa nhiều đồng vị được
tính theo tổng độ phóng xạ thành phần. Khối lượng nguyên tử của A lớn gấp 2,548 lần trị
số điện tích hạt nhân.
a) Xác định đồng vị mẹ A.
b) Xác định các hạt nhân B, G, H, K.
c) Viết 2 phương trình phản ứng hạt nhân phân rã alpha và beta trong chuỗi trên. Tính
năng lượng liên kết các nucleon trong hạt nhân 209Bi, theo 1 nucleon, đơn vị MeV.
Cho KLNT: Bi = 208,980u; p = 1,0072747u; n = 1,008666u; e = 5,485794∙10-4u; 1 eV
= 1,602∙10-19 J; c = 2,998∙108 m/s, 1u = 1,66054∙10-27 kg. Biết 1 năm có 365 ngày.
Câu 2. (2,5 điểm) Cấu tạo phân tử. Tinh thể
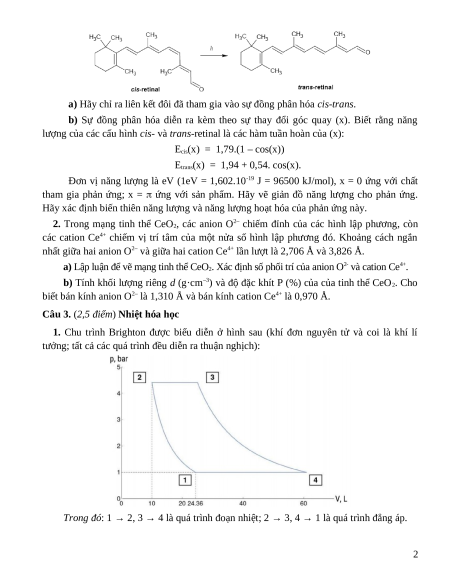
1. Bước đầu tiên trong cơ chế nhìn bằng mắt là sự đồng phân hóa cis trans-retinal có
trong võng mạc của mắt. Cis-retinal hấp thụ được ánh sáng nhìn thấy do thay đổi cấu hình của một liên kết đôi: 1
a) Hãy chỉ ra liên kết đôi đã tham gia vào sự đồng phân hóa cis-trans.
b) Sự đồng phân hóa diễn ra kèm theo sự thay đổi góc quay (x). Biết rằng năng
lượng của các cấu hình cis- và trans-retinal là các hàm tuần hoàn của (x): Ecis(x) = 1,79.(1 – cos(x))
Etrans(x) = 1,94 + 0,54. cos(x).
Đơn vị năng lượng là eV (1eV = 1,602.10-19 J = 96500 kJ/mol), x = 0 ứng với chất
tham gia phản ứng; x = ứng với sản phẩm. Hãy vẽ giản đồ năng lượng cho phản ứng.
Hãy xác định biến thiên năng lượng và năng lượng hoạt hóa của phản ứng này.
2. Trong mạng tinh thể CeO2, các anion O2– chiếm đỉnh của các hình lập phương, còn
các cation Ce4+ chiếm vị trí tâm của một nửa số hình lập phương đó. Khoảng cách ngắn
nhất giữa hai anion O2– và giữa hai cation Ce4+ lần lượt là 2,706 Å và 3,826 Å.
a) Lập luận để vẽ mạng tinh thể CeO2. Xác định số phối trí của anion O2- và cation Ce4+.
b) Tính khối lượng riêng d (g·cm–3) và độ đặc khít P (%) của của tinh thể CeO2. Cho
biết bán kính anion O2– là 1,310 Å và bán kính cation Ce4+ là 0,970 Å.
Câu 3. (2,5 điểm) Nhiệt hóa học
1. Chu trình Brighton được biểu diễn ở hình sau (khí đơn nguyên tử và coi là khí lí
tưởng; tất cả các quá trình đều diễn ra thuận nghịch):
Trong đó: 1 → 2, 3 → 4 là quá trình đoạn nhiệt; 2 → 3, 4 → 1 là quá trình đẳng áp. 2
a) Cho biết chiều của chu trình diễn ra (thuận chiều hay ngược chiều) với một động cơ nhiệt (sinh công).
b) Vẽ (định tính) chu trình trong hệ tọa độ T – S (S là entropy).
c) Hiệu suất của chu trình được tính theo công thức: . Xác định biểu thức
của x và tính hiệu suất của chu trình trên, biết p1 và p2 là áp suất của khí ở 1 và 2.
d) Một máy lạnh hoạt động theo chu trình trên. Xác định hệ số hiệu suất của máy lạnh.
Biết: Hiệu suất của động cơ nhiệt
với A – công thực hiện, Qh – nhiệt lấy từ ngồn
nóng; Hệ số hiệu suất máy lạnh:
với A – công giãn nở, Qc – nhiệt lấy từ nguồn lạnh.
2. Nạp 0,01 mol but-1-yne (CH3-CH2-C≡CH) vào một lò phản ứng có thể tích thay đổi
được với V0 = 0,1 m3 chỉ chứa không khí ở 1,0 atm và 298 K. Tiến hành đốt cháy hoàn
toàn hydrocarbon này ở điều kiện đoạn nhiệt, đẳng áp (là phản ứng duy nhất xảy ra trong
điều kiện này). Sau khi đốt cháy hoàn toàn thì trong bình phản ứng chỉ chứa carbon
dioxide, hơi nước, nitrogen và oxygen.
a) Tính enthalpy chuẩn của phản ứng ở 298 K. Từ đó tính lượng nhiệt toả ra khi
đốt cháy 0,01 mol but-1-yne trong thí nghiệm trên?
b) Tính số mol các chất có trong bình phản ứng sau khi phản ứng đốt cháy xảy ra
hoàn toàn. Coi không khí là hỗn hợp của oxygen và nitrogen với tỉ lệ mol 1 : 4.
c) Tính nhiệt độ cực đại trong bình sau phản ứng cháy. Biết: C4H6(g) CO2(g) H2O(g) O2(g) N2(g) ΔfHo298K (kJ/mol) 165,2 -393,5 -241,8 - - C0p (J/mol.K) 13,5 46,6 41,2 32,3 27,6
Giả sử các giá trị nhiệt dung và nhiệt tạo thành không phụ thuộc nhiệt độ.
Câu 4. (3,0 điểm) Động hóa học (không cơ chế). Cân bằng hóa học trong pha phí
1. Ở 4530C sự đồng phân hoá cis - trans của dimethyl cyclopropane là phản ứng
thuận nghịch bậc một. Thành phần phần trăm của hỗn hợp phản ứng theo thời gian thu được như sau: t (s) 0 45 90 225 270 360 495 675 trans (%) 0 10,8 18,9 37,7 41,8 49,3 56,5 62,7 70
Tính hằng số cân bằng và hằng số tốc độ của phản ứng thuận nghịch.
2. Một hỗn hợp khí thải gồm 10 mol CO, 30 mol CO2 và 90 mol N2.
Biết phản ứng: CO(g) + H2O(g)
CO2(g) + H2(g) (1) có Kp = 0,312 3
a) Tính số mol H2O cần phải thêm vào hỗn hợp này để ở trạng thái cân bằng (1500 K
và 1,0 bar) lượng CO còn lại là 1% so với lượng ban đầu. Cho biết có nên sử dụng nước để
chuyển hóa CO trong trường hợp này hay không? Giải thích cho sự lựa chọn.
b) Tính áp suất riêng phần (bar) của các chất tại thời điểm cân bằng.
c) Ở nhiệt độ và áp suất cố định, hỗn hợp ban đầu chỉ gồm CO, H2O và N2. Xác định
tỉ lệ số mol CO/H2O ban đầu để tại thời điểm cân bằng phần mol của CO2 đạt giá trị lớn nhất.
d) Hãy cho biết chiều hướng chuyển dịch cân bằng của phản ứng (1) nếu thêm hỗn
hợp gồm CO và N2 vào hỗn hợp phản ứng ở trạng thái cân bằng trong điều kiện nhiệt độ
và áp suất của hệ được giữ cố định. Giải thích.
Câu 5. (3,0 điểm) Cân bằng acid-base và cân bằng hợp chất ít tan. Phương án thực hành
1. a) Để nghiên cứu GFAJ-1 (một loại vi khuẩn có khả năng chịu được nồng độ cao
arsenic) trong phòng thí nghiệm, người ta tiến hành pha các dung dịch bằng cách trộn dung
dịch NaOH 0,5M (dung dịch A) với dung dịch H3AsO4 0,5 M (dung dịch B). Thêm một
lượng thể tích xác định dung dịch A và B vào trong bình định mức 100 mL. Sau đó thêm
vào nước cất đến vạch và lăc đều được dung dịch C có pH = 10,4 và tổng nồng độ As(V)
là 0,04M. Tính thể tích (mL) dung dịch A và B đã được dùng để pha dung dịch C.
b) Một trong những phương pháp mà các doanh nghiệp luyện kim sử dụng để loại bỏ
arsenic khỏi nước thải là kết tủa chúng dưới dạng Ca3(AsO4)2 (Ksp = 7,24.10-22). Nhược
điểm của phương pháp này là độ tan của Ca3(AsO4)2 còn phụ thuộc đáng kể vào pH, do đó
mà khi điều kiện bên ngoài thay đổi có thể khiến Ca3(AsO4)2 trở thành nguồn arsenic gây ô nhiễm môi trường.
Cho 100mL dung dịch đệm có pH = 5,6 không chứa arsenic và calcium vào một mẫu
Ca3(AsO4)2 có khối lượng 10 gam. Tính độ tan (g/L) của Ca3(AsO4)2 trong dung dịch đệm.
Giả sử rằng thành phần của dung dịch đệm không tham gia vào các cân bằng cạnh tranh.
Cho biết: H3AsO4 có pKa1 = 2,19, pKa2 = 6,94, pKa3 = 11,5.
2. Để xác định hàm lượng NaCl trong mẫu muối bị chảy rữa (mẫu X, coi nhỉ gồm NaCl
và H2O), tiến hành như sau:
- Cân chính xác 0,1324 gam X; hoà tan hoàn toàn rồi chuyển hết vào bình định mức
100 mL; định mức đến vạch, thu được dung dịch Y (nồng độ NaCl là Co M).
- Lấy chính xác Vo = 10,00 mL Y vào bình tam giác; thêm V1 = 1,00 mL dung dịch K2CrO4 Co1 M, lắc đều.
- Chuẩn độ dung dịch thu được bằng dung dịch AgNO3 C = 1,5010-2 M đến khi
quan sát rõ sự xuất hiện kết tủa Ag2CrO4 thì hết V = 14,00 mL.
Cho biết: Ở 298K, pKs(AgCl) = 9,75; pKs(Ag2CrO4) = 11,95; lg*(AgOH) = -11,70; MNaCl = 58,5 g.mol-1 4
Đề thi HSG Hóa học 10 Trường THPT Chuyên Quảng Ninh
635
318 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu Tổng hợp đề thi chọn học sinh giỏi Hóa học 10 của các trường THPT Chuyên khu vực Duyên hải và Đồng bằng Bắc Bộ gồm 29 đề đề xuất và 1 đề chính thức có lời giải giúp giáo viên, học sinh có thêm tài liệu tham khảo.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(635 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)