KÌ THI CHỌN HỌC SINH GIỎI KHU VỰC MỞ RỘNG
NĂM HỌC 2023 – 2024 MÔN THI: HÓA HỌC LỚP 10
(Thời gian làm bài 180 phút không kể thời gian giao đề) ĐỀ THI ĐỀ XUẤT Đề thi gồm 5 trang
Thảo luận về thi học sinh giỏi DHBB năm 2024 + Khối 10 Câu Nội dung Điểm 1
Cấu tạo nguyên tử. Phản ứng hạt nhân. Định luật tuần hoàn 2,5 2
Cấu tạo phân tử. Tinh thể 2,5 3 Nhiệt hóa học. 2,5 4
Động hóa học (không có cơ chế). Cân bằng hóa học trong pha khí 3,0 5
Cân bằng acid – base và cân bằng các hợp chất ít tan. Phương án thực hành 3,0 6
Phản ứng oxi hóa – khử. Pin điện (không liên quan phức chất) 2,5 7 Halogen. 2,0 8
Đại cương hóa hữu cơ (quan hệ giữa cấu trúc và tính chất) 2,0 Nội Dung
Câu 1: (2,5 điểm) Cấu tạo nguyên tử. Phản ứng hạt nhân. Định luật tuần hoàn.
Đồng vị 32P phân rã β- với chu kì bán huỷ 14,28 ngày, được điều chế bằng phản ứng giữa nơtron với hạt nhân 32S.
a) Viết các phương trình phản ứng hạt nhân để điều chế 32P và biểu diễn sự phân rã phóng xạ của 32P.
b) Có hai mẫu phóng xạ 32P được kí hiệu là mẫu I và mẫu II. Mẫu I có hoạt độ phóng xạ 20 mCi được
lưu giữ trong bình đặt tại buồng làm mát có nhiệt độ 10oC. Mẫu II có hoạt độ phóng xạ 2 µCi bắt
đầu được lưu giữ cùng thời điểm với mẫu I nhưng ở nhiệt độ 20 oC. Khi hoạt độ phóng xạ của mẫu
II chỉ còn 5.10-1 µCi thì lượng lưu huỳnh xuất hiện trong bình chứa mẫu I là bao nhiêu gam? Trước
khi lưu giữ, trong bình không có lưu huỳnh.
Cho: 1 Ci = 3,7.1010 Bq (1Bq = 1 phân rã/giây); số Avogađro NA = 6,02.1023 mol-1; hoạt độ phóng xạ A
= λ.N (λ là hằng số tốc độ phân rã, N là số hạt nhân phóng xạ ở thời điểm t).
Câu 2: (2,5 điểm) Cấu tạo phân tử. Tinh thể
Nhiệt độ sôi của các hợp chất với hydrogen các nguyên tố nhóm VA, VIA và VIIA được biểu diễn qua đồ thị sau: 20 35 80 130
Khối lượng phân tử
a. Tại sao hợp chất với hydrogen của các nguyên tố đầu tiên trong mỗi nhóm lại có nhiệt sôi cao
bất thường so với hợp chất hydrogen của các nguyên tố còn lại.
b. Nhận xét nhiệt độ sôi của các hợp chất với hydrogen của các nguyên tố còn lại ở mỗi nhóm và
giải thích nguyên nhân sự biến đổi nhiệt độ sôi của chúng.
2. Một số hợp chất ion của các ion hóa trị II cũng kết tinh cùng kiểu cấu trúc tinh thể như NaCl, ví dụ
như galena PbS. Hằng số mạng của nó là a = 5,94 Å.
a. Vẽ cấu trúc ô mạng cơ sở của galena và tính khối lượng riêng của galena.
b. Một mẫu galena chứa silver, trong đó một phần ion Pb2+ bị thay thế bởi ion Ag+ và sự giảm điện tích
được bù trừ bởi các lỗ trống của ion S2-, có khối lượng riêng là 7,21 g/cm3, hằng số mạng của mẫu này
là a = 5,88 Å và thành phần của tinh thể khi đó có thể được biểu diễn bởi công thức tổng quát Pb(1-
x)AgxSy. Xác định công thức đơn giản nhất của mẫu galena chứa silver.
Câu 3: (2,5 điểm) Nhiệt hóa học.
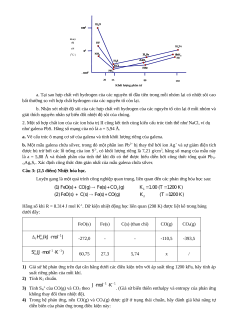
Luyện gang là một quá trình công nghiệp quan trọng, liên quan đến các phản ứng hóa học sau:
Hằng số khi R = 8.314 J mol K-1. Dữ kiện nhiệt động học liên quan (298 K) được liệt kê trong bảng dưới đây: FeO(s) Fe(s) C(s) (than chì) CO(g) CO2(g) -272,0 - - -110,5 -393,5 60,75 27,3 5,74 x /
1) Giả sử hệ phản ứng trên đạt cân bằng dưới các điều kiện trên với áp suất tổng 1200 kPa, hãy tính áp
suất riêng phần của mỗi khí. 2) Tính K2 chuẩn. 3) Tính S o m của CO(g) và CO2 theo
. (Giả sử biến thiên enthalpy và entropy của phản ứng
không thay đổi theo nhiệt độ).
4) Trong hệ phản ứng, nếu CO(g) và CO2(g) được giữ ở trạng thái chuẩn, hãy đánh giá khả năng tự
diễn biến của phản ứng trong điều kiện này: Phản ứng (1) A. tự diễn biến
B. không tự diễn biến C. cân bằng Phản ứng (2) A. tự diễn biến
B. không tự diễn biến C. cân bằng
5) Hãy cho biết nếu tăng nhiệt độ thì hằng số cân bằng phản ứng thay đổi như thế nào? Phản ứng (1) A. tăng B. không thay đổi C. giảm Phản ứng (2) A. tăng B. không thay đổi C. giảm
Câu 4: (3,0 điểm) Động hóa học (không có cơ chế). Cân bằng hóa học trong pha khí
Phản ứng sau đây có thể được sử dụng để phân tích nồng độ ion iodide:
Khảo sát tốc độ phản ứng ở 25 oC và nhận được các kết quả sau đây:
1) Xác định bậc phản ứng i. theo I- ii. theo IO -3 iii. theo H+
2) Dẫn ra biểu thức tốc độ và tính hằng số tốc độ k.
3) Năng lượng hoạt hóa của phản ứng trên là 84 kJ·mol-1 ở 25 oC. Hằng số tốc độ phản ứng tăng bao
nhiêu khi năng lượng hoạt hóa bị hạ thấp (ví dụ, bởi xúc tác) đi 10 kJ mol-1.
Câu 5: (3,0 điểm) Cân bằng acid – base và cân bằng các hợp chất ít tan.
Hydrogen sulfide trong không khí sẽ làm bạc xỉn màu do bị bao phủ bởi một lớp mỏng silver
sulfide. Để làm sạch khỏi mảng bám sulfide, một đồng xu bằng bạc được đặt vào cốc mỏ chứa một lá
nhôm ở đáy và thêm dung dịch soda làm bánh (baking soda) (NaHCO3, 20 g trong 0.4 L) đã đun sôi từ
trước vào. Kết quả là lá nhôm bị hòa tan và màu sáng bóng ban đầu của bạc được phục hồi. Cho biết các dữ kiện:
1. Viết phương trình của phản ứng
a) tạo thành silver sulfide trên bề mặt khi để đồng bạc trong không khí. b) đun sôi baking soda.
c) giữa lá nhôm và silver sulfide trong dung dịch soda đã đun sôi.
2. Tính pH của dung dịch soda sau khi kết thúc phản ứng 1c.
3. Tính khối lượng cực tiểu của lá nhôm cần để làm sạch một đồng xu (độ dày 2 mm, đường kính 20
mm) nếu độ dày lớp sulfide là 42 nm
4. Tính tỉ lệ nhôm đã phản ứng dưới các điều kiện đã mô tả ở trên tạo thành dạng phức hydroxo
5. Trong phương pháp này, nhôm và bạc tạo thành một cặp pin điện khi tiếp xúc. Cho biết kim loại nào
là cathode, kim loại nào là anode. Viết phương trình các bán phản ứng.
Câu 6: (2,5 điểm) Phản ứng oxi hóa – khử. Pin điện (không liên quan phức chất)
Pin galvanic đầu tiên được A. Volta chế tạo vào năm 1800, dựa vào những thí nghiệm của L.
Galvani. Sau này, các pin galvanic đã được ứng dụng rộng rãi trong khoa học, công nghệ và cuộc sống thường ngày.
Nửa bên trái của pin chứa một điện cực sắt (dư) bị oxid hoá trong quá trình hoạt động và dung
dịch iron(III) nitrate có nồng độ 0.01 M. Nửa bên phải của pin chứa điện cực than chì và hỗn hợp
iron(II) và (III) nitrate với nồng độ lần lượt là 0.05 M và 0.30 M. Thể tích của mỗi nửa pin là 1 L.
1) Xác định điện cực nào là cathode, điện cực nào là anode. Chỉ rõ các điện cực này thuộc loại nào.
2) Viết sơ đồ pin theo dạng (-) … | … || … | … (+)
3) Viết các bán phản ứng ở mỗi điện cực và phản ứng tổng.
4) Sử dụng các thông tin về độ linh động ion (μ0), chọn ra (các) hợp chất ion phù hợp nhất làm cầu muối.
Từ dữ kiện nhiệt động, biết rằng entropy chuẩn của Fe(s), Fe2+(aq), Fe3+(aq) ở 25oC là 27.3, -137.7 và -
316.0 J/mol.K. Tăng nhiệt độ thêm 20oC sẽ làm giảm hằng số cân bằng K 85 lần.
5) a) Chỉ ra ion có entropy chuẩn trong dung dịch nước được giả định là bằng 0;
b) Chỉ ra nguyên nhân tại sao entropy của ion có trị số điện tích bằng 3 lại thấp hơn nhiều so với ion
có trị số điện tích bằng 2 (chọn một trường hợp trong Phiếu trả lời);
c) Tính entropy, enthalpy và năng lượng Gibbs (ở 25oC) của phản ứng tổng. Chú ý rằng ∆rHo và ∆rSo
là các hằng số trong khoảng nhiệt độ này, R = 8.314 J/mol.K, F = 96485 C/mol (hằng số Faraday).
6) Tính (theo volt, tới độ chính xác là 3 chữ số thập phân) suất điện động (EMF) ban đầu của pin và
các thế ban đầu của cathode, anode ở 25oC. Biết E0(Fe2+/Fe) = -0.447 V.
Pin hoạt động trong 3 giờ 20 phút cho đến khi được sử dụng hoàn toàn.
7) Tính cường độ trung bình của dòng.
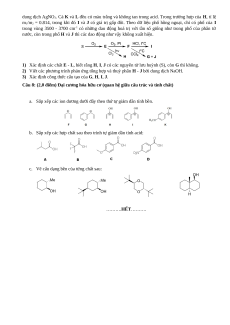
Câu 7: (2,0 điểm) Halogen.
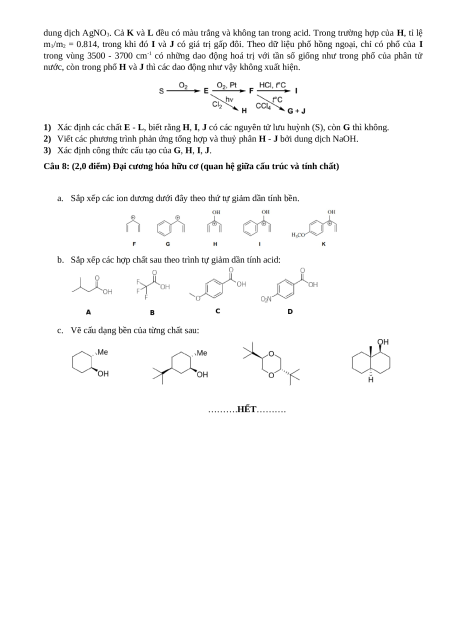
Có thể tổng hợp ba chất lỏng không màu H, I, J từ lưu huỳnh (S) theo sơ đồ dưới đây. E và G là
những chất khí độc. Trong điều kiện thường, khối lượng riêng của G là 4.42 gram/L. F là chất rắn có
nhiệt độ nóng chảy thấp. Thuỷ phân H, I, J bởi dung dịch kiềm thu được cùng hỗn hợp của các sản
phẩm tan trong nước, phản ứng với dung dịch Ba(NO3)2 tạo thành kết tủa K (khối lượng m1). Sau khi
gạn kết tủa K, dung dịch còn lại có thể tạo thành kết tủa L (khối lượng m2) khi phản ứng với lượng dư
Đề thi HSG Hóa học 10 Trường THPT Chuyên Thái Bình
500
250 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu Tổng hợp đề thi chọn học sinh giỏi Hóa học 10 của các trường THPT Chuyên khu vực Duyên hải và Đồng bằng Bắc Bộ gồm 29 đề đề xuất và 1 đề chính thức có lời giải giúp giáo viên, học sinh có thêm tài liệu tham khảo.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(500 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)