Ngày soạn:…/…/… Ngày dạy:…/…/…
CHỦ ĐỀ 8: SƠ LƯỢC VỀ KIM LOẠI CHUYỂN TIẾP DÃY THỨ NHẤT VÀ PHỨC CHẤT
BÀI 20. SƠ LƯỢC VỀ KIM LOẠI CHUYỂN TIẾP DÃY THỨ NHẤT I. MỤC TIÊU 1. Về kiến thức
Trong bài học này, HS sẽ tìm hiểu:
- Đặc điểm cấu hình electron nguyên tử của các kim loại chuyển tiếp dãy thứ nhất.
- Số oxi hóa và mà sắc của các kim loại chuyển tiếp dãy thứ nhất.
- Thí nghiệm xác định nồng độ của dung dịch FeSO4 bằng dung dịch KMnO4 (dung dịch thuốc tím).
- Thí nghiệm kiểm tra sự có mặt của cation Cu2+ hoặc Fe3+ trong dung dịch.
- Một số tính chất vật lí và ứng dụng của kim loại chuyển tiếp từ các tính chất đó. 2. Năng lực
Năng lực chung:
- Tự chủ và tự học: Chủ động, tích cực tìm hiểu về kim loại chuyển tiếp dãy thứ nhất.
- Giao tiếp và hợp tác: Sử dụng ngôn ngữ khoa học để diễn đạt các vấn đề về
kim loại chuyển tiếp dãy thứ nhất; Hoạt động nhóm và cặp đôi một cách hiệu
quả, đảm bảo các thành viên trong nhóm đều được tham gia và trình bày báo cáo.
- Giải quyết vấn đề và sáng tạo: Thảo luận với các thành viên trong nhóm nhằm
giải quyết các vấn đề trong bài học để hoàn thành nhiệm vụ học tập.
Năng lực đặc thù: 1
- Nhận thức hoá học: Nêu được đặc điểm về cấu hình electron của các
nguyên tử kim loại chuyển tiếp dãy thứ nhất (từ Sc đến Cu); Nêu được xu
hướng có nhiều số oxi hóa của các nguyên tố chuyển tiếp; Nêu được các
trạng thái oxi hóa phổ biến, cấu hình electron, đặc tính có màu của một số
ion kim loại chuyển tiếp dãy thứ nhất; Trình bày được một số tính chất vật
lí của kim loại chuyển tiếp (nhiệt độ nóng chảy, khối lượng riêng, độ dẫn
điện và dẫn nhiệt, độ cứng) và ứng dụng của kim loại chuyển tiếp từ các
tính chất đó; Nêu được sự khác biệt về nhiệt độ nóng chảy, khối lượng
riêng, độ dẫn điện, độ cứng,… giữa một số kim loại chuyển tiếp so với các kim loại họ s.
- Tìm hiểu thế giới tự nhiên dưới góc độ hóa học: Thực hiện được thí
nghiệm xác định hàm lượng muối Fe(II) bằng dung dịch thuốc tím; Thực
hiện được thí nghiệm kiểm tra sự có mặt của từng ion riêng biệt: Cu2+, Fe3+. 3. Phẩm chất
- Tham gia tích cực hoạt động nhóm phù hợp với khả năng của bản thân.
- Cẩn trọng, trung thực và thực hiện các yêu cầu trong bài học.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
1. Đối với giáo viên
- Tài liệu: SGK, SGV Hóa học 12, các hình ảnh liên quan đến bài học.
- Thiết bị dạy học: Máy tính, máy chiếu.
2. Đối với học sinh
- Tài liệu: SGK Hóa học 12.
- Tranh ảnh, tư liệu sưu tầm liên quan đến bài học theo yêu cầu của GV.
III. TIẾN TRÌNH DẠY HỌC
A. HOẠT ĐỘNG KHỞI ĐỘNG
a. Mục tiêu: HS có hứng thú học tập, nhu cầu tìm hiểu; dùng những kiến thức, kĩ
năng cần thiết để thực hiện yêu cầu, khám phá kiến thức mới.
b. Nội dung: GV đặt vấn đề, HS suy nghĩ trả lời câu hỏi mở đầu. 2
c. Sản phẩm: Câu trả lời của HS.
d. Tổ chức thực hiện
Bước 1: GV chuyển giao nhiệm vụ học tập - GV nêu câu hỏi:
Kim loại chuyển tiếp dãy thứ nhất gồm 9 nguyên tố từ Sc (Z = 21) đến Cu (Z =
29) trong bảng tuần hoàn các nguyên tố hóa học. Các nguyên tố này thường thể
hiện nhiều số oxi hóa khác nhau. Chẳng hạn, nguyên tố sắt (Z = 26) có số oxi hóa
+2 trong hợp chất FeCl2 và có số oxi hóa +3 trong hợp chất FeCl3.
a. Vì sao kim loại chuyển tiếp dãy thứ nhất thường tạo được nhiều hợp chất với
các số oxi hóa dương khác nhau?
b. Nêu một số tính chất và ứng dụng của đơn chất kim loại chuyển tiếp dãy thứ nhất.
Bước 2: HS tiếp nhận, thực hiện nhiệm vụ học tập
- HS làm việc cá nhân, quan sát hình và suy nghĩ trả lời câu hỏi của GV.
- GV hướng dẫn, hỗ trợ HS (nếu cần thiết).
Bước 3: Báo cáo kết quả hoạt động, thảo luận
- GV mời 2 – 3 HS trả lời câu hỏi theo hiểu biết và tìm hiểu của HS.
- Các HS khác lắng nghe để nhận xét câu trả lời của bạn mình.
- GV khuyến khích HS có thể có nhiều ý kiến khác nhau.
Bước 4: Đánh giá kết quả thực hiện nhiệm vụ học tập
- GV không nhận xét đúng sai mà dẫn dắt HS vào bài học: Kim loại chuyển tiếp
dãy thứ nhất, từ Sc đến Cu có vai trò quan trọng trong hóa học và công nghiệp
nhờ cấu hình electron đặc trưng và tính chất đa dạng. Bài học hôm nay sẽ giới
thiệu tổng quan về các tính chất và ứng dụng nổi bật của nhóm nguyên tố này.
Chúng ta cùng vào Bài 20. Sơ lược về kim loại chuyển tiếp dãy thứ nhất.
B. HOẠT ĐỘNG HÌNH THÀNH KIẾN THỨC
Hoạt động 1. Tìm hiểu đặc điểm của nguyên tố chuyển tiếp dãy thứ nhất 3
a. Mục tiêu: HS nêu được đặc điểm về cấu hình electron của các nguyên tử kim loại
chuyển tiếp dãy thứ nhất (từ Sc đến Cu); nêu được xu hướng có nhiều số oxi hóa của
các nguyên tố chuyển tiếp; nêu được các trạng thái oxi hóa phổ biến, cấu hình
electron, đặc tính có màu của một số ion kim loại chuyển tiếp dãy thứ nhất.
b. Nội dung: HS đọc các thông tin trong SGK và thực hiện yêu cầu của GV.
c. Sản phẩm: Câu trả lời của HS về đặc điểm của nguyên tố chuyển tiếp dãy thứ nhất.
d. Tổ chức hoạt động:
HOẠT ĐỘNG CỦA GV - HS
DỰ KIẾN SẢN PHẨM
Bước 1: GV chuyển giao nhiệm vụ học tập
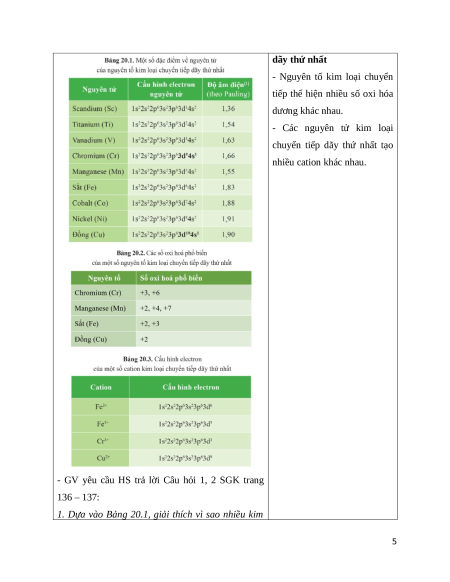
I. KHÁI QUÁT VỀ KIM
- GV yêu cầu HS đọc thông tin, quan sát các Bảng LOẠI CHUYỂN TIẾP DÃY
20.1 – 20.3 trang 136 – 137 SGK, trao đổi cặp đôi THỨ NHẤT
để hoàn thành các yêu cầu sau:
1. Đặc điểm cấu hình
(1) Các kim loại chuyển tiếp dãy thứ nhất gồm electron nguyên tử của các
những nguyên tố nào? Thuộc chu kì mấy? Cho biết nguyên tố kim loại chuyển
đặc điểm cấu hình electron nguyên tử nguyên tố tiếp dãy thứ nhất
chuyển tiếp dãy thứ nhất.
- Kim loại chuyển tiếp dãy
(2) Cho biết một nguyên tố chuyển tiếp có một hay thứ nhất gồm các nguyên tố
nhiều số oxi hóa và tạo một hay nhiều cation.
có số hiệu nguyên tử từ 21
(Sc) đến 29 (Cu), thuộc chu kì 4.
- Cấu hình electron nguyên tử
của các nguyên tố trong dãy
từ Sc đến Cu có xu hướng xếp
đầy electron ở phân lớp 4s và
tăng dần số electron ở phân lớp 3d (trừ Cr và Cu).
2. Số oxi hóa và màu sắc của
các ion kim loại chuyển tiếp 4
Giáo án Bài 20 Hóa học 12 Cánh Diều: Sơ lược về kim lại chuyển tiếp dãy thứ nhất
467
234 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Bộ giáo án Hóa học 12 Cánh diều đã cập nhật đủ Cả năm.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Bộ giáo án Hóa học 12 Cánh diều năm 2024 mới, chuẩn nhất được thiết kế theo phong cách hiện đại, đẹp mắt, trình bày chi tiết cho từng bài học và bám sát chương trình Sách giáo khoa Hóa học 12 Cánh diều.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(467 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)