Trường THPT ………….
Họ và tên giáo viên
Tổ: ………………………
BÀI 3: NĂNG LƯỢNG HOẠT HÓA CỦA PHẢN ỨNG HÓA HỌC Lớp: Ngày soạn: Thời gian thực hiện: I. MỤC TIÊU 1. Kiến thức
- Trình bày được khái niệm năng lượng hoạt hoá (theo khía cạnh ảnh hưởng đến tốc độ phản ứng).
- Nêu được ảnh hưởng của năng lượng hoạt hoá và nhiệt độ tới tốc độ phản ứng thông
qua phương trình Arrhenius k = A.e(–Ea / RT ).
- Giải thích được vai trò của chất xúc tác. 2. Năng lực 2.1. Năng lực chung
- Năng lực tự chủ và tự học: Kĩ năng tìm kiếm thông tin trong SGK, quan sát hình ảnh,
thí nghiệm để rút ra nhận xét.
- Năng lực giao tiếp và hợp tác: Làm việc nhóm tìm hiểu về các yếu tố làm cho phản ứng có thể xảy ra.
- Năng lực giải quyết vấn đề và sáng tạo: Giải thích được tại sao ứng dụng được một
số yếu tố làm cho phản ứng không xảy ra, làm thay đổi tốc độ phản ứng theo ý muốn. 2.2. Năng lực hóa học
a. Nhận thức hoá học: Học sinh đạt được các yêu cầu sau:
+ Nêu được khái niệm năng lượng hoạt hóa.
+ Nêu được ảnh hưởng của năng lượng hoạt hóa và nhệt độ đến tốc độ phản ứng thông qua phương trình Arrhenius.
+ Giải thích được vài trò của chất xúc tác.
+ Vận dụng phương trình Arrhenius tính được năng lượng hoạt hóa, so sánh tốc độ
phản ứng ở những mức nhiệt độ xác định.
b. Tìm hiểu tự nhiên dưới góc độ hóa học được thực hiện thông qua các hoạt động:
Thảo luận, quan sát thí nghiệm tìm ra nguyên nhân ảnh hưởng đến tốc độ phản ứng
của các yếu tố nhiệt độ, năng lượng hoạt hoá, chất xúc tác.
c. Vận dụng kiến thức, kĩ năng đã học để giải thích được làm thế nào để thay đổi tốc
độ phản ứng theo ý muốn. 3. Phẩm chất
- Chăm chỉ, tự tìm tòi thông tin trong SGK, tích cực quan sát video và làm thí nghiệm
để tìm ra được các yếu tố ảnh hưởng đến tốc độ phản ứng.
- HS có trách nhiệm trong việc hoạt động nhóm, hoàn thành các nội dung được giao.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
- Máy tính, máy chiếu.
- Dụng cụ và hóa chất làm thí nghiệm. Dụng cụ Hóa chất Ống nghiệm Dung dịch HCl 0,5M Đèn cồn Dung dịch phenolphtalein Bình tam giác Mg dạng phoi bào Kẹp gỗ Dung dịch H2O2 10% Bột MnO2 Nước cất
Đá vôi dạng viên, đá vôi dạng đập nhỏ - Phiếu học tập:
Phiếu học tập số 1: Ảnh hưởng của nhiệt độ đến tốc độ phản ứng
Thực hiện thí nghiệm nghiên cứu ảnh hưởng của nhiệt độ đến tốc độ phản ứng,
quan sát hiện tượng, tìm hiểu thông tin và trả lời các câu hỏi sau:
1. Sự thay đổi màu sắc trong ống nghiệm nào nhanh hơn?
2. Nhiệt độ ảnh hưởng như thế nào đến tốc độ phản ứng?
3. Giải thích mối liên hệ giữa nhiệt độ đến tốc độ phản ứng
Phiếu học tập số 2: Ảnh hưởng của chất xúc tác đến tốc độ phản ứng
Thực hiện thí nghiệm Nghiên cứu ảnh hưởng của chất xúc tác đến tốc độ phản
ứng, quan sát hiện tượng, tìm hiểu thông tin và trả lời các câu hỏi sau:
1. So sánh tốc độ thoát khí ở 2 bình.
2. Chất xúc tác ảnh hưởng thế nào đến tốc độ phản ứng?
3. Rút ra kết luận: Chất xúc tác là gì?
III. TIẾN TRÌNH DẠY HỌC Phương pháp/Công Hoạt động
Phương pháp/Kỹ thuật dạy học cụ đánh giá 1. Mở đầu (5’) + Phương pháp hỏi đáp Câu hỏi
Phương pháp/Công Hoạt động
Phương pháp/Kỹ thuật dạy học cụ đánh giá
+ Phương pháp nêu và giải quyết vấn đề
2. Hình thành kiến thức - PPDH thuyết trình - Phiếu học tập mới
- Kĩ thuật: thảo luận cặp đôi, nhóm - Câu hỏi thảo luận
2.1. Năng lượng hoạt hoá (15’) - PPDH hợp tác - Phiếu học tập
2.2. Chất xúc tác (10’)
- Kĩ thuật: thảo luận cặp đôi, nhóm - Câu hỏi thảo luận Phương pháp hợp tác
3. Luyện tập củng cố (5’) - Câu hỏi thảo luận
- Kỹ thuật dạy học: Thảo luận nhóm
- Kết quả trả lời câu 4. Vận dụng (10’)
- KT giao nhiệm vụ, KT đặt câu hỏi hỏi
1. Hoạt động 1: Khởi động (5 phút) a) Mục tiêu
Tạo nhu cầu tìm hiểu kiến thức mới của HS. b) Nội dung:
HS tham gia trò chơi “Hỏi nhanh - đáp gọn” bằng việc trả lời các câu hỏi sau:
Câu 1. Hydrogen và oxygen không phản ứng với nhau ở nhiệt độ thường, nhưng khi
đưa một ít bột platinium (Pt) vào hỗn hợp 2 khí đó, phản ứng xảy ra ngay tức khắc, tạo
thành nước. Yếu tố nào quyết định sự thay đổi đó?
Câu 2. Trong các phản ứng sau, phản ứng nào có tốc độ nhanh, phản ứng nào có tốc độ chậm? a. Đốt cháy than b. Sắt bị gỉ c. Trung hoà acid – base d. Tinh bột lên men rượu e. Lên men sữa chua
- Hoạt động chung cả lớp: GV yêu cầu HS khác nhận xét, bổ sung, GV hướng dẫn HS chuẩn hóa kiến thức.
- GV: Ngoài yếu tố xúc tác ảnh hưởng tới tốc độ của phản ứng, còn có những yếu tố
nào nữa. Chúng ta cùng nghiên cứu trong tiết học hôm nay. c) Sản phẩm
- Sản phẩm: HS trả lời các câu hỏi GV yêu cầu
- Đánh giá kết quả hoạt động :
+ Thông qua câu trả lời của HS, GV kịp thời phát hiện những khó khăn, vướng mắc
của HS và có giải pháp hỗ trợ hợp lý Đáp án:
Câu 1. Yếu tố xúc tác
Câu 2. a. nhanh, b. chậm; c. nhanh; d. chậm; e. chậm
d) Tổ chức thực hiện
- Hoạt động cá nhân: GV yêu cầu HS tham gia trò chơi “Hỏi nhanh - đáp gọn” bằng
việc trả lời các câu hỏi.
2. Hoạt động 2: Hình thành kiến thức mới
Hoạt động 2.1: Năng lượng hoạt hoá (15 phút)
Mục tiêu: Tìm hiểu khái niệm năng lượng hoạt hoá và ảnh hưởng của năng lượng hoạt
hoá và nhiệt độ đến tốc độ phản ứng hoá học
Hoạt động của GV và HS
Sản phẩm dự kiến
GV hướng dẫn HS hoàn thiện năng lực nhận thức I. Năng lượng hoạt hoá
hoá học theo phương pháp tiên đề:
1. Khái niệm năng lượng hoạt hoá
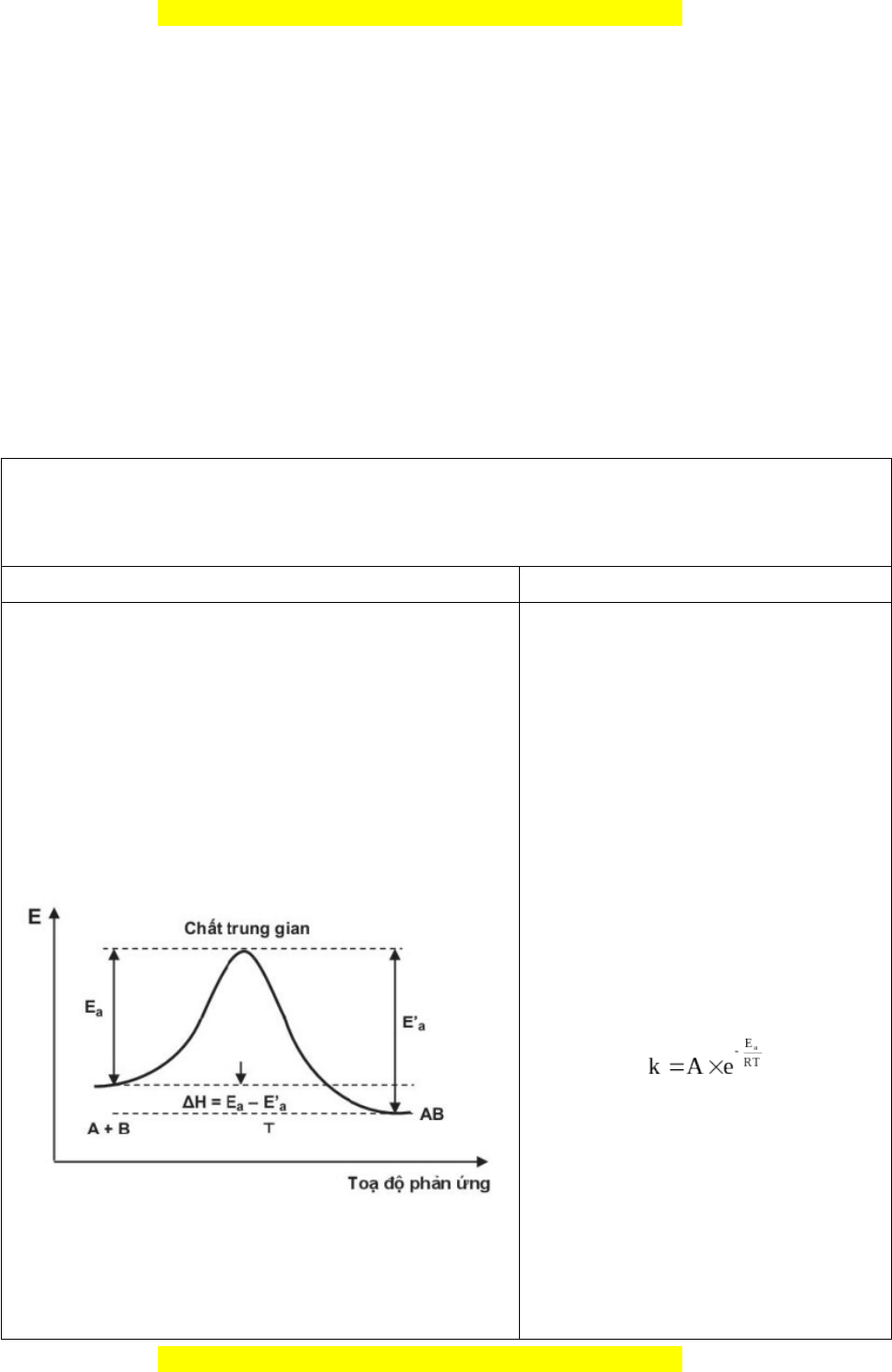
1. GV đưa ra đồ thị về năng lượng hoạt hoá và + Năng lượng hoạt hóa là năng
phân tích (có thể sử dụng video để theo dõi tiến lượng tối thiểu mà chất phản ứng trình phản ứng)
cần phải có để phản ứng có thể xảy
GV giới thiệu khái niệm về năng lượng hoạt hoá, ra.
có thể sử dụng sơ đồ đơn giản hơn trong SGK để 2. Ảnh hưởng của năng lượng hoạt HS dễ hiểu
hoá và nhiệt độ đến tốc độ phản ứng
+ Phương trình Arrhenius: biểu
diễn sự ảnh hưởng của năng lượng
hoạt hóa và nhiệt độ đến hằng số tốc độ phản ứng. Trong đó:
k là hằng số tốc độ phản ứng
A là hằng só thực nghiệm
2. GV giới thiệu phương trình Arrhenius để HS biết Arrhenius
ảnh hưởng của năng lượng hoạt hoá và nhiệt độ đến
e là cơ số của logarit tự
tốc độ phản ứng (giới thiệu cả hai dạng của pt) và nhiên, e = 2,7183
nêu ví dụ minh hoạ kèm theo
Ea là năng lượng hoạt hóa
Giáo án chuyên đề Năng lượng hoạt hóa của phản ứng hóa học Hóa 10 Cánh diều
832
416 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Bộ giáo án chuyên đề Hóa 10 Cánh diều được cập nhật liên tục trong gói này từ nay đến hết tháng 3/2024.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Bộ giáo án chuyên đề Hóa 10 Cánh diều năm 2023 mới, chuẩn nhất được thiết kế theo phong cách hiện đại, đẹp mắt, trình bày chi tiết cho từng bài học và bám sát chuyên đề Hóa 10 Cánh diều.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(832 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 10
Xem thêmTài liệu bộ mới nhất

Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
I. MỤC TIÊU
1. Kiến thức
- Trình bày được khái niệm năng lượng hoạt hoá (theo khía cạnh ảnh hưởng đến tốc độ
phản ứng).
- Nêu được ảnh hưởng của năng lượng hoạt hoá và nhiệt độ tới tốc độ phản ứng thông
qua phương trình Arrhenius k = A.e
(–Ea / RT )
.
- Giải thích được vai trò của chất xúc tác.
2. Năng lực
2.1. Năng lực chung
- Năng lực tự chủ và tự học: Kĩ năng tìm kiếm thông tin trong SGK, quan sát hình ảnh,
thí nghiệm để rút ra nhận xét.
- Năng lực giao tiếp và hợp tác: Làm việc nhóm tìm hiểu về các yếu tố làm cho phản
ứng có thể xảy ra.
- Năng lực giải quyết vấn đề và sáng tạo: Giải thích được tại sao ứng dụng được một
số yếu tố làm cho phản ứng không xảy ra, làm thay đổi tốc độ phản ứng theo ý muốn.
2.2. Năng lực hóa học
a. Nhận thức hoá học: Học sinh đạt được các yêu cầu sau:
+ Nêu được khái niệm năng lượng hoạt hóa.
+ Nêu được ảnh hưởng của năng lượng hoạt hóa và nhệt độ đến tốc độ phản ứng thông
qua phương trình Arrhenius.
+ Giải thích được vài trò của chất xúc tác.
+ Vận dụng phương trình Arrhenius tính được năng lượng hoạt hóa, so sánh tốc độ
phản ứng ở những mức nhiệt độ xác định.
b. Tìm hiểu tự nhiên dưới góc độ hóa học được thực hiện thông qua các hoạt động:
Thảo luận, quan sát thí nghiệm tìm ra nguyên nhân ảnh hưởng đến tốc độ phản ứng
của các yếu tố nhiệt độ, năng lượng hoạt hoá, chất xúc tác.
c. Vận dụng kiến thức, kĩ năng đã học để giải thích được làm thế nào để thay đổi tốc
độ phản ứng theo ý muốn.
3. Phẩm chất
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Trường THPT ………….
Tổ: ………………………
Họ và tên giáo viên
BÀI 3: NĂNG LƯỢNG HOẠT HÓA CỦA PHẢN ỨNG HÓA HỌC
Lớp: Ngày soạn: Thời gian thực hiện:

Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
- Chăm chỉ, tự tìm tòi thông tin trong SGK, tích cực quan sát video và làm thí nghiệm
để tìm ra được các yếu tố ảnh hưởng đến tốc độ phản ứng.
- HS có trách nhiệm trong việc hoạt động nhóm, hoàn thành các nội dung được giao.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
- Máy tính, máy chiếu.
- Dụng cụ và hóa chất làm thí nghiệm.
Dụng cụ Hóa chất
Ống nghiệm
Đèn cồn
Bình tam giác
Kẹp gỗ
Dung dịch HCl 0,5M
Dung dịch phenolphtalein
Mg dạng phoi bào
Dung dịch H
2
O
2
10%
Bột MnO
2
Nước cất
Đá vôi dạng viên, đá vôi dạng đập
nhỏ
- Phiếu học tập:
Phiếu học tập số 1: Ảnh hưởng của nhiệt độ đến tốc độ phản ứng
Thực hiện thí nghiệm nghiên cứu ảnh hưởng của nhiệt độ đến tốc độ phản ứng,
quan sát hiện tượng, tìm hiểu thông tin và trả lời các câu hỏi sau:
1. Sự thay đổi màu sắc trong ống nghiệm nào nhanh hơn?
2. Nhiệt độ ảnh hưởng như thế nào đến tốc độ phản ứng?
3. Giải thích mối liên hệ giữa nhiệt độ đến tốc độ phản ứng
Phiếu học tập số 2: Ảnh hưởng của chất xúc tác đến tốc độ phản ứng
Thực hiện thí nghiệm Nghiên cứu ảnh hưởng của chất xúc tác đến tốc độ phản
ứng, quan sát hiện tượng, tìm hiểu thông tin và trả lời các câu hỏi sau:
1. So sánh tốc độ thoát khí ở 2 bình.
2. Chất xúc tác ảnh hưởng thế nào đến tốc độ phản ứng?
3. Rút ra kết luận: Chất xúc tác là gì?
III. TIẾN TRÌNH DẠY HỌC
Hoạt động Phương pháp/Kỹ thuật dạy học
Phương pháp/Công
cụ đánh giá
1. Mở đầu (5’) + Phương pháp hỏi đáp Câu hỏi
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85

Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Hoạt động Phương pháp/Kỹ thuật dạy học
Phương pháp/Công
cụ đánh giá
+ Phương pháp nêu và giải quyết vấn đề
2. Hình thành kiến thức
mới
2.1. Năng lượng hoạt hoá
(15’)
- PPDH thuyết trình
- Kĩ thuật: thảo luận cặp đôi, nhóm
- Phiếu học tập
- Câu hỏi thảo luận
2.2. Chất xúc tác (10’)
- PPDH hợp tác
- Kĩ thuật: thảo luận cặp đôi, nhóm
- Phiếu học tập
- Câu hỏi thảo luận
3. Luyện tập củng cố (5’)
Phương pháp hợp tác
- Kỹ thuật dạy học: Thảo luận nhóm
- Câu hỏi thảo luận
4. Vận dụng (10’) - KT giao nhiệm vụ, KT đặt câu hỏi
- Kết quả trả lời câu
hỏi
1. Hoạt động 1: Khởi động (5 phút)
a) Mục tiêu
Tạo nhu cầu tìm hiểu kiến thức mới của HS.
b) Nội dung:
HS tham gia trò chơi “Hỏi nhanh - đáp gọn” bằng việc trả lời các câu hỏi sau:
Câu 1. Hydrogen và oxygen không phản ứng với nhau ở nhiệt độ thường, nhưng khi
đưa một ít bột platinium (Pt) vào hỗn hợp 2 khí đó, phản ứng xảy ra ngay tức khắc, tạo
thành nước. Yếu tố nào quyết định sự thay đổi đó?
Câu 2. Trong các phản ứng sau, phản ứng nào có tốc độ nhanh, phản ứng nào có tốc
độ chậm?
a. Đốt cháy than
b. Sắt bị gỉ
c. Trung hoà acid – base
d. Tinh bột lên men rượu
e. Lên men sữa chua
- Hoạt động chung cả lớp: GV yêu cầu HS khác nhận xét, bổ sung, GV hướng dẫn HS
chuẩn hóa kiến thức.
- GV: Ngoài yếu tố xúc tác ảnh hưởng tới tốc độ của phản ứng, còn có những yếu tố
nào nữa. Chúng ta cùng nghiên cứu trong tiết học hôm nay.
c) Sản phẩm
- Sản phẩm: HS trả lời các câu hỏi GV yêu cầu
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
- Đánh giá kết quả hoạt động :
+ Thông qua câu trả lời của HS, GV kịp thời phát hiện những khó khăn, vướng mắc
của HS và có giải pháp hỗ trợ hợp lý
Đáp án:
Câu 1. Yếu tố xúc tác
Câu 2. a. nhanh, b. chậm; c. nhanh; d. chậm; e. chậm
d) Tổ chức thực hiện
- Hoạt động cá nhân: GV yêu cầu HS tham gia trò chơi “Hỏi nhanh - đáp gọn” bằng
việc trả lời các câu hỏi.
2. Hoạt động 2: Hình thành kiến thức mới
Hoạt động 2.1: Năng lượng hoạt hoá (15 phút)
Mục tiêu: Tìm hiểu khái niệm năng lượng hoạt hoá và ảnh hưởng của năng lượng hoạt
hoá và nhiệt độ đến tốc độ phản ứng hoá học
Hoạt động của GV và HS Sản phẩm dự kiến
GV hướng dẫn HS hoàn thiện năng lực nhận thức
hoá học theo phương pháp tiên đề:
1. GV đưa ra đồ thị về năng lượng hoạt hoá và
phân tích (có thể sử dụng video để theo dõi tiến
trình phản ứng)
GV giới thiệu khái niệm về năng lượng hoạt hoá,
có thể sử dụng sơ đồ đơn giản hơn trong SGK để
HS dễ hiểu
2. GV giới thiệu phương trình Arrhenius để HS biết
ảnh hưởng của năng lượng hoạt hoá và nhiệt độ đến
tốc độ phản ứng (giới thiệu cả hai dạng của pt) và
nêu ví dụ minh hoạ kèm theo
I. Năng lượng hoạt hoá
1. Khái niệm năng lượng hoạt hoá
+ Năng lượng hoạt hóa là năng
lượng tối thiểu mà chất phản ứng
cần phải có để phản ứng có thể xảy
ra.
2. Ảnh hưởng của năng lượng hoạt
hoá và nhiệt độ đến tốc độ phản ứng
+ Phương trình Arrhenius: biểu
diễn sự ảnh hưởng của năng lượng
hoạt hóa và nhiệt độ đến hằng số tốc
độ phản ứng.
Trong đó:
k là hằng số tốc độ phản ứng
A là hằng só thực nghiệm
Arrhenius
e là cơ số của logarit tự
nhiên, e = 2,7183
E
a
là năng lượng hoạt hóa
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85

Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Dùng phương pháp hoạt động nhóm, đàm thoại gợi
mở để HS rèn luyện năng lực giao tiếp hợp tác và
năng lực giải quyết vấn đề khi vận dụng phương
trình Arrhenius để tính:
+ Năng lượng hoạt hoá của phản ứng
+ Hằng số tốc độ của phản ứng
+ Nhiệt độ ảnh hưởng đến tốc độ của phản ứng
3. GV có thể giới thiệu quy tắc Vant’ Hoff để HS
tính hệ số nhiệt độ Vant’ Hoff
GV hướng dẫn HS tiến hành thí nghiệm nghiên cứu
ảnh hưởng của nhiệt độ đến tốc độ phản ứng
Chuẩn bị: Mg dạng phoi bào, nước cất, đèn cồn, 2
ống nghiệm, kẹo gỗ, dung dịch phenolphtalein
Tiến hành
Cho vào mỗi ống nghiệm khoảng 3ml nước cất
Nhỏ vào ống nghiệm 1-2 giọt phenolphtalein và
cho vào mỗi ống một mẩu phoi bào Mg
Đun nóng một ống nghiệm
Lưu ý: Làm sạch bề mặt Mg trước khi tiến hành thí
nghiệm
Trả lời câu hỏi trong phiếu học tập số 1
(J/mol)
R là hằng số khí lí tưởng, R
= 8,314 (J/mol·K)
T là nhiệt độ theo thang
Kelvin (K)
+ Khi năng lượng hoạt hóa E
a
lớn,
hằng số tốc độ k nhỏ, tốc độ phản
ứng chậm.
+ Phương trình Arrhenius viết lại
cho 2 nhiệt độ T
1
và T
2
xác định,
ứng với 2 hằng số tốc độ k
1
và k
2
:
+ Phản ứng có năng lượng hoạt hóa
nhỏ hoặc nhiệt độ của phản ứng cao,
tốc độ phản ứng càng lớn.
+ Chất xúc tác có vai trò làm giảm
năng lượng hoạt hóa để tăng tốc độ
của phản ứng. Chất xúc tác có tính
chọn lọc.
1. Sự thay đổi màu sắc trong ống
nghiệm đun nóng diễn ra nhanh
hơn.
2. Nhiệt độ càng cao, tốc độ phản
ứng càng nhanh.
3. Khi tăng nhiệt độ, các hạt (phân
tử, nguyên tử hoặc ion) sẽ chuyển
động nhanh hơn, động năng cao
hơn, số va chạm hiệu quả giữa các
hạt tăng, dẫn tới tốc độ phản ứng
tăng
Hoạt động 2.2: Chất xúc tác (10 phút)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85























