Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t (c ế ó đáp án) SỞ GIÁO D C Ụ VA ĐAO T O Ạ H I Ả KỲ THI CHỌN H C Ọ SINH GI I Ỏ C P Ấ TRƯỜNG PHÒNG NĂM H C Ọ 2022 - 2023 TRƯ N Ờ G THPT PH M Ạ NGŨ LÃO Đ Ề THI LÝ THUY T Ế MÔN: HÓA H C Ọ 10 Đ C Ề HÍNH TH C Ứ Th i
ờ gian: 120 phút (không kể th i ờ gian giao đ ) ề (Đề thi g m ồ 08 câu, 02 trang) Câu 1 (1,5 đi m ể ) . 1/ M t ộ nguyên tố R có 3 đ ng ồ v X ị , Y, Z, t ng s ổ h ố t ạ c b ơ n (e ả , p, n) c a ủ 3 đ ng v ồ b ị ng 129. S ằ ne ố utron của đ ng v ồ ị X bằng s prot ố on , s ne ố utron c a ủ đ ng v ồ ị Z h n đ ơ ng ồ v ịY 1 h t ạ . a. Xác đ nh s ị kh ố i ố c a ủ 3 đ ng v ồ ị . b. Cho biết tỷ l s ệ nguyê ố n t c ử a ủ các đ ng v ồ ị nh s
ư au: X : Y = 1846 : 94 và Y : Z = 141 : 90 , xác đ nh ị kh i ố lư ng nguyê ợ n t t ử rung bình c a ủ R và kh i ố lư ng c ợ a ủ 30,1.1023 nguyên tử R. 2/ Trong công th c ứ oxide cao nh t ấ c a ủ nguyên t ố A (n m ằ nhóm ở A) oxygen chi m ế 72,73% kh i ố lư ng ợ . Xác đ nh ị công th c ứ phân tử c a ủ oxide trên. Câu 2 (1 đi m ể ). Biết X ở chu kì 3 và Y c ở hu kì 2 trong b ng ả tu n ầ hoàn các nguyên t hóa ố h c ọ . T ng ổ s ố electron l p ớ ngoài cùng c a
ủ X và Y là 10. Ở trạng thái cơ b n s ả ố electron p c a ủ X nhi u ề h n s ơ e ố lectron p c a ủ Y là 8. a) Xác đ nh ị s e ố lectron phân l p ớ ngoài cùng c a ủ X, Y. b) Vi t
ế cấu hình electron đầy đ c ủ a ủ X, Y. G i ọ tên X, Y c) Viết công th c ứ c a ủ oxide, hydroxide ng ứ v i ớ hóa trị cao nh t ấ c a
ủ các nguyên tố X,Y. So sánh tính chất c a
ủ các hydroxide (Viết phư ng ơ trình minh h a ọ ). Câu 3 (1 đi m)
ể . Cho các chất sau: C2H6, CH3OH, CH3COOH
a) Chất nào có thể tạo đư c ợ liên k t ế hydrogen? Vì sao?
b) Trong dung dịch CH3COOH có nh ng ki ữ u l ể iên k t ế hydrogen nào? Ki u nà ể o b n nh ề t ấ và kém b n ề
nhất? Mô tả bằng hình vẽ. Câu 4: (1,5 đi m). ể Cân bằng các phản ng
ứ oxi hoá khử sau theo phư ng ơ pháp thăng b ng e ằ lectron:
a) C2H5OH + K2Cr2O7 + HCl ® CH3CHO +KCl + CrCl3 + H2O
b) C6H5-CH=CH2 + KMnO4 ® C6H5-COOK + K2CO3 + MnO2 + KOH + H2O
c) Na2SO3 + KMnO4 + NaHSO4 ® Na2SO4 + MnSO4 + K2SO4 + H2O Câu 5: (2,0 đi m). ể 1. Đ t ố b t ộ iron (s t
ắ ) trong khí oxygen thu đư c ợ h n ỗ h p ợ ch t ấ r n ắ X g m ồ Fe và 3 oxide c a ủ iron. Hòa tan hoàn toàn 19,2 gam h n ỗ h p ợ X vào dung d c ị h ch a ứ 0,8 mol H2SO4 đặc, d , ư đun nóng, thu đư c ợ dung d c ị h
Y và khí V ((lit) SO2 (sản phẩm khử duy nh t
ấ đo ở đktc). Cho 350ml dung d c ị h NaOH 2M vào dung d c ị h Y thu đư c ợ 21,4 gam k t
ế tủa và dung dịch Z chứa m (gam) chất tan. Tính V, m. M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t (c ế ó đáp án)
Câu 41. 2. Trong quá trình b o ả qu n, ả m t ộ m u ẫ mu i ố FeSO4.7H2O (có kh i ố lư ng ợ m gam) bị oxi hóa b i ở oxygen không khí t o ạ thành h n ỗ h p ợ X ch a ứ các h p ợ ch t ấ c a
ủ Fe (II) và Fe (III). Hòa tan toàn b ộ X trong dung d c ị h loãng ch a
ứ 0,025 mol H2SO4, thu đư c ợ 100 ml dung d c ị h Y. Ti n ế hành hai thí nghi m ệ v i ớ Y: Thí nghi m ệ 1: Cho lư ng ợ d dung d ư c
ị h BaCl2 vào 20 ml dung d c ị h Y, thu đư c ợ 2,33 gam k t ế t a ủ . Thí nghi m ệ 2: Thêm dung d c ị h H2SO4 (loãng, d ) ư vào 20 ml dung d c ị h Y, thu được dung d c ị h Z. Nh t ỏ ừ từ dung d c ị h KMnO4 0,1M vào Z đ n ế khi ph n ả ng ứ đ t ủ hì h t
ế 8,6 mls. Tính giá trị c a ủ m và ph n ầ trăm số
mol Fe(II) đã bị oxi hóa trong không khí . Câu 6 : (1 đi m). ể M t ộ ngư i ờ thợ xây trong bu i
ổ sáng kéo được 500 kg vật li u ệ xây d ng l ự ên t ng c ầ ao 10 m. Đ bù và ể o năng lư ng đã ợ tiêu hao, ngư i ờ đó c n u ầ ng ố c c ố nư c
ớ hòa tan m gam glucose. Bi t ế nhi t ệ tạo thành c a
ủ glucose ( C6H12O6), CO2 và H2O lần lư t
ợ là -1271, -393,5 và 285,8 kJ/ mol. Tính giá tr c ị a ủ m. Câu 7: (1 đi m). ể 2 2 a) Giải thích t i
ạ sao ion CO 3 , không thể nh n ậ thêm m t
ộ nguyên tử oxygen để t o ạ ion CO 4 trong 2 2 khi đó ion SO 3 có th nh ể ận thêm 1 nguyên t oxyge ử
n để tạo thành ion SO 4 ? b) Giải thích t i
ạ sao hai phân tử NO2 có thể k t ế h p ợ v i ớ nhau t o
ạ ra phân tử N2O4, trong khi đó
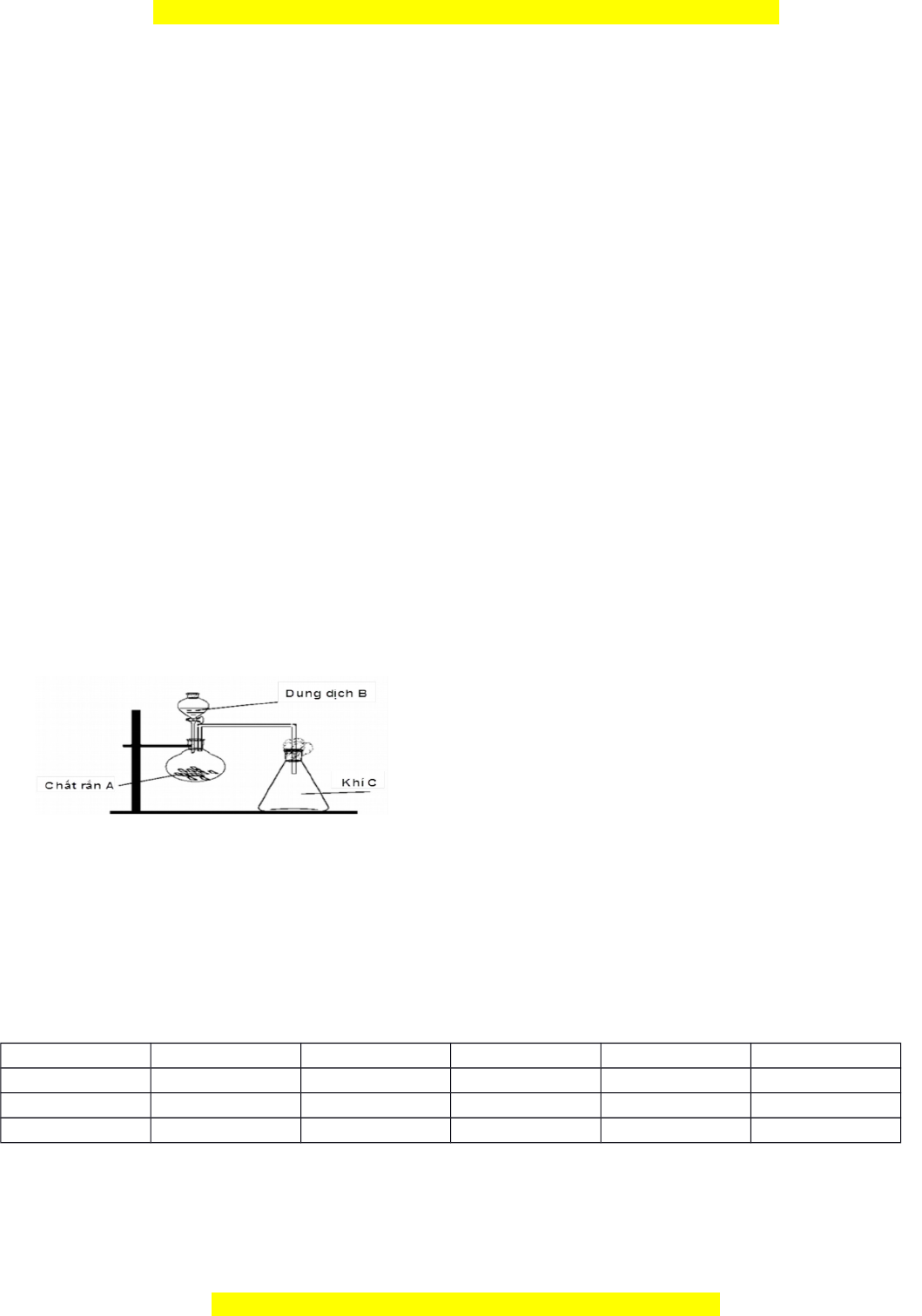
hai phân tử CO2 không thể kết h p v ợ i ớ nhau đ t ể ạo ra phân tử C2O4 Câu 8: (1 đi m). ể 1. Hình v d
ẽ ưới đây mô tả thí nghiệm sinh ra khí C: Hãy xác đ nh c ị hất rắn A, dung d c ị h B, khí C (có th c ể ó) trong thí nghi m ệ trên. Vi t ế phư ng t ơ rình ph n ả ng ứ minh h a ọ . [các điều ki n khá ệ c (to) coi như có đ ] ủ 2. Cho phản ng đ ứ t ố cháy butane sau:
C4H10(g) + O2(g) ® CO2 (g) + H2O(g) (1) Biết năng lư ng ợ liên k t ế trong các h p c ợ hất cho trong b ng s ả au: Liên k t ế Phân tử Eb (kJ /mol) Liên k t ế Phân tử Eb (kJ /mol) C-C C4H10 346 C=O CO2 799 C-H C4H10 418 O-H H2O 467 O=O O2 495 a) Xác đ nh ị bi n t
ế hiên enthalpy (∆r Ho298) c a ủ phản ng (1) ứ b) M t ộ bình gas ch a ứ 12 kg butane có th đun s ể i ố bao nhiêu ấm nư c ớ ? (Gi t ả hi t ế m i ỗ ấm nư c ớ ch a ứ 2 lit nước 25 ở oC, nhi t ệ dung c a ủ nư c
ớ là 4,2J/g.K, có 40% nhi t ệ đ t ố cháy butane b t ị h t ấ thoát ra ngoài môi trư ng. ờ M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t (c ế ó đáp án)
…………………………….. H t………………………………… ế SỞ GIÁO D C Ụ VA ĐAO T O Ạ H I Ả HƯỚNG D N Ẫ CH M Ấ THI CHỌN H C Ọ SINH PHÒNG GIỎI C P
Ấ TRƯỜNG NĂM HỌC 2022 – 2023 TRƯỜNG THPT PH M Ạ NGŨ LÃO Đáp án g m ồ 04 trang Câu 1: Hướng d n ẫ chấm Đi m ể (1 đi m) ể
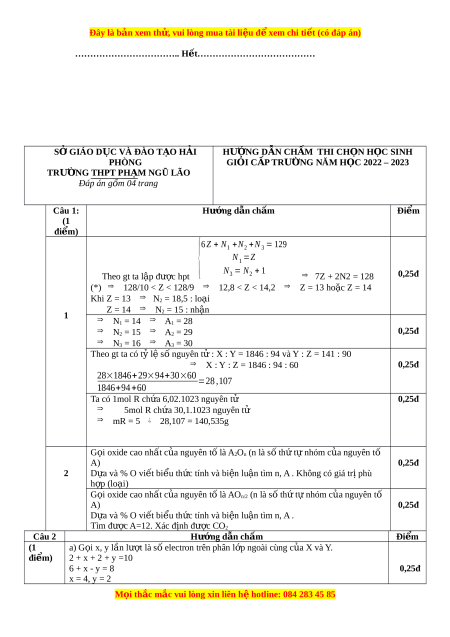
{6Z+N1+N2+N3=129 N 1 =Z N
Theo gt ta lập đư c ợ hpt 3 = N 2 + 1 ⇒ 7Z + 2N2 = 128 0,25đ
(*) ⇒ 128/10 < Z < 128/9 ⇒ 12,8 < Z < 14,2 ⇒ Z = 13 hoặc Z = 14
Khi Z = 13 ⇒ N2 = 18,5 : loại Z = 14 ⇒ N ậ 1 2 = 15 : nh n ⇒ N1 = 14 ⇒ A1 = 28 ⇒ N 0,25đ 2 = 15 ⇒ A2 = 29 ⇒ N3 = 16 ⇒ A3 = 30 Theo gt ta có tỷ l s ệ nguyê ố
n tử : X : Y = 1846 : 94 và Y : Z = 141 : 90
⇒ X : Y : Z = 1846 : 94 : 60 0,25đ
28×1846+29×94+30×60 =28,107 1846+94 +60 Ta có 1mol R ch a ứ 6,02.1023 nguyên tử 0,25đ
⇒ 5mol R chứa 30,1.1023 nguyên tử
⇒ mR = 5 ¿ 28,107 = 140,535g G i ọ oxide cao nhất c a
ủ nguyên tố là A2On (n là s t ố h t ứ ự nhóm c a ủ nguyên tố A) 0,25đ 2 D a ự và % O viết biểu th c ứ tính và bi n
ệ luận tìm n, A . Không có giá tr phù ị h p (l ợ oại) G i ọ oxide cao nhất c a
ủ nguyên tố là AOn/2 (n là s t ố hứ t nhóm ự của nguyên t ố A) 0,25đ D a ự và % O viết biểu th c ứ tính và bi n ệ luận tìm n, A . Tìm đư c ợ A=12. Xác đ nh ị đư c ợ CO2 Câu 2 Hư n ớ g d n ẫ chấm Đi m ể (1 a) G i ọ x, y lần lư t ợ là s e
ố lectron trên phân l p ngoà ớ i cùng c a ủ X và Y. đi m) ể 2 + x + 2 + y =10 6 + x - y = 8 0,25đ x = 4, y = 2 M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t (c ế ó đáp án) b) X: 1s22s22p63s23p4. Y: 1s22s22p2. 0,25đ X là sulfur, Y là carbon. c) SO3, H2SO4. Và CO2. H2CO3 0,25đ Tính axit: H2SO4. > H2CO3
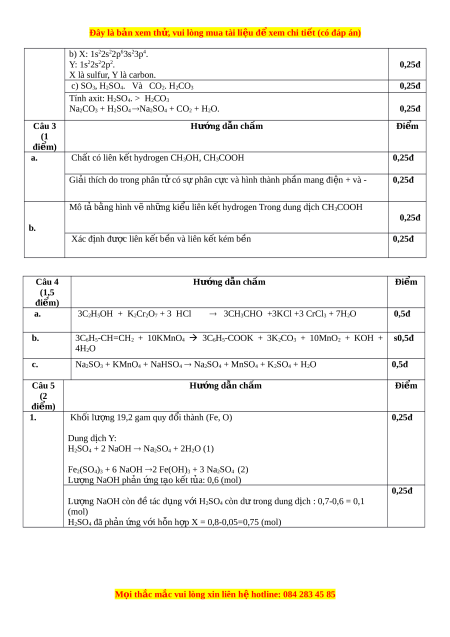
Na2CO3 + H2SO4 ®Na2SO4 + CO2 + H2O. 0,25đ Câu 3 Hư n ớ g d n ẫ chấm Đi m ể (1 đi m) ể a.
Chất có liên kết hydrogen CH3OH, CH3COOH 0,25đ
Giải thích do trong phân t c ử ó s phâ ự n c c ự và hình thành ph n m ầ ang đi n + ệ và - 0,25đ Mô tả bằng hình v ẽ nh ng ki ữ
ểu liên kết hydrogen Trong dung dịch CH3COOH 0,25đ b. Xác đ nh ị đư c ợ liên k t ế b n và ề liên k t ế kém b n ề 0,25đ Câu 4 Hư n ớ g d n ẫ chấm Đi m ể (1,5 đi m) ể a.
3C2H5OH + K2Cr2O7 + 3 HCl ® 3CH3CHO +3KCl +3 CrCl3 + 7H2O 0,5đ b.
3C6H5-CH=CH2 + 10KMnO4 3C6H5-COOK + 3K2CO3 + 10MnO2 + KOH + s0,5đ 4H2O c.
Na2SO3 + KMnO4 + NaHSO4 ® Na2SO4 + MnSO4 + K2SO4 + H2O 0,5đ Câu 5 Hướng d n ẫ chấm Đi m ể (2 đi m) ể 1. Kh i ố lư ng ợ 19,2 gam quy đ i ổ thành (Fe, O) 0,25đ Dung d c ị h Y:
H2SO4 + 2 NaOH ® Na2SO4 + 2H2O (1)
Fe2(SO4)3 + 6 NaOH ®2 Fe(OH)3 + 3 Na2SO4 (2) Lư ng N ợ aOH phản ng t ứ ạo kết tủa: 0,6 (mol) 0,25đ Lư ng N ợ aOH còn đ t ề ác d ng ụ v i ớ H2SO4 còn d t ư rong dung d c ị h : 0,7-0,6 = 0,1 (mol) H2SO4 đã phản ng v ứ i ớ h n h ỗ p ợ X = 0,8-0,05=0,75 (mol) M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
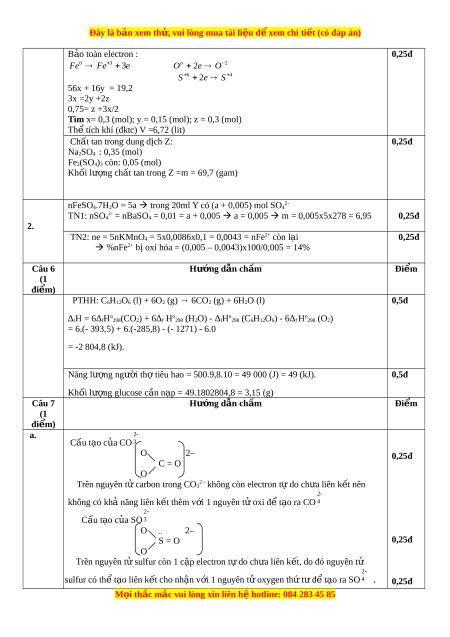
Đề HSG Hóa 10 Trường THPT Phạm Ngũ Lão 2023 có đáp án
2.2 K
1.1 K lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Tài liệu được cập nhật liên tục trong gói này từ nay đến hết tháng 3/2024. Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu Đề HSG Hóa 10 Trường THPT Phạm Ngũ Lão năm 2023 có đáp án.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(2186 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 10
Xem thêmTài liệu bộ mới nhất

ả ử ệ ể ế
! " #$ $ % & Ở Ụ Ạ Ả
'&()
%* )%&'%'& +),-. ƯỜ Ạ
(Đ thi g mề ồ 08 câu, 02 trang)
/0%&"& )& ")& Ọ Ọ Ỏ " '%* )Ấ ƯỜ
)1+& "2322423Ọ 25
%&Ề -6%&78 %Ế +9):&;<& "=3Ọ
Th i gian: ờ 120 phút (không kể th i gianờ giao đ )ề
"==> ?ể
1/ M t nguyên t R có 3 đ ng v X, Y, Z, t ng s h t c b n (e, p, n) c a 3 đ ng v b ng 129. S neutronộ ố ồ ị ổ ố ạ ơ ả ủ ồ ị ằ ố
c a đ ng v X b ng s proton , s neutron c a đ ng v Z h n đ ng v Y 1 h t.ủ ồ ị ằ ố ố ủ ồ ị ơ ồ ị ạ
a. Xác đ nh s kh i c a 3 đ ng v .ị ố ố ủ ồ ị
b. Cho bi t t l s nguyên t c a các đ ng v nh sau: X : Y = 1846 : 94 và Y : Z = 141 : 90 , xác ế ỷ ệ ố ử ủ ồ ị ư
đ nh kh i l ng nguyên t trung bình c a R và kh i l ng c a 30,1.10ị ố ượ ử ủ ố ượ ủ
23
nguyên t R.ử
2/ Trong công th c oxide cao nh t c a nguyên t A (n m nhóm A) oxygen chi m 72,73% kh i l ng . ứ ấ ủ ố ằ ở ế ố ượ
Xác đ nh công th c phân t c a oxide trên.ị ứ ử ủ
"2= ể ?
Bi t X chu kì 3 và Y chu kì 2 trong b ng tu n hoàn các nguyên t hóa h c. T ng s electron l pế ở ở ả ầ ố ọ ổ ố ớ
ngoài cùng c a X và Y là 10. tr ng thái c b n s electron p c a X nhi u h n s electron p c a Y là 8. ủ Ở ạ ơ ả ố ủ ề ơ ố ủ
a) Xác đ nh s electron phân l p ngoài cùng c a X, Y.ị ố ớ ủ
b) Vi t c u hình electron đ y đ c a X, Y. G i tên X, Yế ấ ầ ủ ủ ọ
c) Vi t công th c c a ế ứ ủ oxide, hydroxide ng v i hóa tr cao nh t c a các nguyên t X,Y. So sánhứ ớ ị ấ ủ ố
tính ch t c a các hydroxide (Vi t ph ng trình minh h a).ấ ủ ế ươ ọ
"5 = ể ? Cho các ch t sau: Cấ
2
H
6
, CH
3
OH, CH
3
COOH
a) Ch t nào có th t o đ c liên k t hydrogen? Vì sao?ấ ể ạ ượ ế
b) Trong dung d ch CHị
3
COOH có nh ng ki u liên k t hydrogen nào? Ki u nào b n nh t và kém b n ữ ể ế ể ề ấ ề
nh t? Mô t b ng hình v .ấ ả ằ ẽ
"@:=> ?ể Cân b ng các ph n ng oxi hoá kh sau theo ph ng pháp thăng b ng electron: ằ ả ứ ử ươ ằ
a) C
2
H
5
OH + K
2
Cr
2
O
7
+ HCl ® CH
3
CHO +KCl + CrCl
3
+ H
2
O
b) C
6
H
5
-CH=CH
2
+ KMnO
4
® C
6
H
5
-COOK + K
2
CO
3
+ MnO
2
+ KOH + H
2
O
c) Na
2
SO
3
+ KMnO
4
+ NaHSO
4
® Na
2
SO
4
+ MnSO
4
+ K
2
SO
4
+ H
2
O
">:23 ?ể
=?Đ t b t iron (s t) trong khí oxygen thu đ c h n h p ch t r n X g m Fe và 3 oxide c a iron. Hòa tanố ộ ắ ượ ỗ ợ ấ ắ ồ ủ
hoàn toàn 19,2 gam h n h p X vào dung d ch ch a 0,8 mol Hỗ ợ ị ứ
2
SO
4
đ c, d , đun nóng, thu đ c dung d chặ ư ượ ị
Y và khí V ((lit) SO
2
(s n ph m kh duy nh t đo đktc). Cho 350ml dung d ch NaOH 2M vào dung d chả ẩ ử ấ ở ị ị
Y thu đ c 21,4 gam k t t a và dung d ch Z ch a m (gam) ch t tan. Tính V, m.ượ ế ủ ị ứ ấ
+ A B:3C@2C5@>C>ọ ắ ắ ệ
"&D)&%& "Ề Ứ
ả ử ệ ể ế
"@=? 2?Trong quá trình b o qu n, m t m u mu i FeSOả ả ộ ẫ ố
4
.7H
2
O (có kh i l ng m gam) b oxi hóa b iố ượ ị ở
oxygen không khí t o thành h n h p X ch a các h p ch t c a Fe (II) và Fe (III). Hòa tan toàn b X trongạ ỗ ợ ứ ợ ấ ủ ộ
dung d ch loãng ch a 0,025 mol Hị ứ
2
SO
4
, thu đ c 100 ml dung d ch Y. Ti n hành hai thí nghi m v i Y:ượ ị ế ệ ớ
Thí nghi m 1: Cho l ng d dung d ch BaClệ ượ ư ị
2
vào 20 ml dung d ch Y, thu đ c 2,33 gam k t t a.ị ượ ế ủ
Thí nghi m 2: Thêm dung d ch Hệ ị
2
SO
4
(loãng, d ) vào 20 ml dung d ch Y, thu đ c dung d ch Z. Nh tư ị ượ ị ỏ ừ
t dung d ch KMnOừ ị
4
0,1M vào Z đ n khi ph n ng đ thì h t 8,6 mlsế ả ứ ủ ế . Tính giá tr c a m và ph n trăm sị ủ ầ ố
mol Fe(II) đã b oxi hóa trong không khí .ị
"E:= ?ể M t ng i th xây trong bu i sáng kéo đ c 500 kg v t li u xây d ng lên t ng cao ộ ườ ợ ổ ượ ậ ệ ự ầ
10 m. Đ bù vào năng l ng đã tiêu hao, ng i đó c n u ng c c n c hòa tan m gam glucose. Bi t nhi t ể ượ ườ ầ ố ố ướ ế ệ
t o thành c a glucose ( Cạ ủ
6
H
12
O
6
), CO
2
và H
2
O l n l t là -1271, -393,5 và 285,8 kJ/ mol. Tính giá tr c a ầ ượ ị ủ
m.
"F:= ?ể
a) Gi i thích t i sao ion COả ạ
2
3
, không th nh n thêm m t nguyên t oxygen đ t o ion COể ậ ộ ử ể ạ
2
4
trong
khi đó ion SO
2
3
có th nh n thêm 1 nguyên t oxygen đ t o thành ion SOể ậ ử ể ạ
2
4
?
b) Gi i thích t i sao hai phân t NOả ạ ử
2
có th k t h p v i nhau t o ra phân t Nể ế ợ ớ ạ ử
2
O
4
, trong khi đó
hai phân t COử
2
không th k t h p v i nhau đ t o ra phân t Cể ế ợ ớ ể ạ ử
2
O
4
"C:= ?ể
=? Hình v d i đây mô tẽ ướ ảthí nghi m sinh ra khí C:ệ
Hãy xác đ nh ch t r n A, dung d ch B, khí C (có th có) trong thí nghi m trên. Vi t ph ng trình ph n ị ấ ắ ị ể ệ ế ươ ả
ng minh h a. [các đi u ki n khác (tứ ọ ề ệ
o
) coi nh có đ ]ư ủ
2? Cho ph n ng đ t cháy butane sau:ả ứ ố
C
4
H
10(g)
+ O
2(g)
® CO
2 (g)
+ H
2
O
(g)
(1)
Bi t năng l ng liên k t trong các h p ch t cho trong b ng sau:ế ượ ế ợ ấ ả
Liên k tế Phân tử E
b
(kJ /mol) Liên k tế Phân tử E
b
(kJ /mol)
C-C C
4
H
10
346 C=O CO
2
799
C-H C
4
H
10
418 O-H H
2
O 467
O=O O
2
495
a) Xác đ nh bi n thiên enthalpy (∆ị ế
r
H
o
298
) c a ph n ng (1)ủ ả ứ
b) M t bình gas ch a 12 kg butane có th đun s i bao nhiêu m n c? (Gi thi t m i m n c ch a 2 ộ ứ ể ố ấ ướ ả ế ỗ ấ ướ ứ
lit n c 25ướ ở
o
C, nhi t dung c a n c là 4,2J/g.K, có 40% nhi t đ t cháy butane b th t thoát ra ngoài ệ ủ ướ ệ ố ị ấ
môi tr ng.ườ
+ A B:3C@2C5@>C>ọ ắ ắ ệ
ả ử ệ ể ế
GGGGGGGGGGG??& GGGGGGGGGGGGGế
! "#$$ % & Ở Ụ Ạ Ả
'&()
%* )%&'%'& +),-. ƯỜ Ạ
Đáp án g m 04 trangồ
& )! )"& +%&ƯỚ Ẫ Ấ "& )& ")&Ọ Ọ
Ỏ " '%* )Ấ ƯỜ )1+& "23Ọ 22H2325
"=:
=
ể
& I ướ ẫ ấ ể
=
Theo gt ta l p đ c hpt ậ ượ
{
6 Z + N
1
+N
2
+N
3
= 129
N
1
=Z
N
3
= N
2
+ 1
⇒
7Z + 2N2 = 128
(*)
⇒
128/10 < Z < 128/9
⇒
12,8 < Z < 14,2
⇒
Z = 13 ho c Z = 14ặ
Khi Z = 13
⇒
N
2
= 18,5 : lo iạ
Z = 14
⇒
N
2
= 15 : nh nậ
32>
⇒
N
1
= 14
⇒
A
1
= 28
⇒
N
2
= 15
⇒
A
2
= 29
⇒
N
3
= 16
⇒
A
3
= 30
32>
Theo gt ta có t l s nguyên tỷ ệ ố ử : X : Y = 1846 : 94 và Y : Z = 141 : 90
⇒
X : Y : Z = 1846 : 94 : 60
28×1846+29×94+30×60
1846+94 +60
=28 ,107
32>
Ta có 1mol R ch a 6,02.1023 nguyên tứ ử
⇒
5mol R ch a 30,1.1023 nguyên tứ ử
⇒
mR = 5
¿
28,107 = 140,535g
32>
2
G i oxide cao nh t c a nguyên t là Aọ ấ ủ ố
2
O
n
(n là s th t nhóm c a nguyên t ố ứ ự ủ ố
A)
D a và % O vi t bi u th c tính và bi n lu n tìm n, A . Không có giá tr phù ự ế ể ứ ệ ậ ị
h p (lo i)ợ ạ
32>
G i oxide cao nh t c a nguyên t là AOọ ấ ủ ố
n/2
(n là s th t nhóm c a nguyên t ố ứ ự ủ ố
A)
D a và % O vi t bi u th c tính và bi n lu n tìm n, A . ự ế ể ứ ệ ậ
Tìm đ c A=12. Xác đ nh đ c COượ ị ượ
2
32>
"2 & I ướ ẫ ấ ể
=
ể
a) G i x, y l n l t là s electron trên phân l p ngoài cùng c a X và Y.ọ ầ ượ ố ớ ủ
2 + x + 2 + y =10
6 + x - y = 8
x = 4, y = 2
32>
+ A B:3C@2C5@>C>ọ ắ ắ ệ
ả ử ệ ể ế
b) X: 1s
2
2s
2
2p
6
3s
2
3p
4
.
Y: 1s
2
2s
2
2p
2
.
X là sulfur, Y là carbon.
32>
c) SO
3
, H
2
SO
4
. Và CO
2
. H
2
CO
3
32>
Tính axit: H
2
SO
4
. > H
2
CO
3
Na
2
CO
3
+ H
2
SO
4
®Na
2
SO
4
+ CO
2
+ H
2
O. 32>
"5
=
ể
& I ướ ẫ ấ ể
? Ch t có liên k tấ ế hydrogen CH
3
OH, CH
3
COOH 32>
Gi i thích do trong phân t có s phân c c và hình thành ph n mang đi n + và -ả ử ự ự ầ ệ 32>
?
Mô t b ng hình v ả ằ ẽ nh ng ki u liên k t hydrogen Trong dung d ch CHữ ể ế ị
3
COOH
32>
Xác đ nh đ c liên k t b n và liên k t kém b nị ượ ế ề ế ề 32>
"@
=>
ể
& I ướ ẫ ấ ể
? 3C
2
H
5
OH + K
2
Cr
2
O
7
+ 3 HCl ® 3CH
3
CHO +3KCl +3 CrCl
3
+ 7H
2
O 3>
? 3C
6
H
5
-CH=CH
2
+ 10KMnO
4
3C
6
H
5
-COOK + 3K
2
CO
3
+ 10MnO
2
+ KOH +
4H
2
O
J3>
? Na
2
SO
3
+ KMnO
4
+ NaHSO
4
® Na
2
SO
4
+ MnSO
4
+ K
2
SO
4
+ H
2
O 3>
">
2
ể
& I ướ ẫ ấ ể
=? Kh i l ng 19,2 gam quy đ i thành (Fe, O)ố ượ ổ
Dung d ch Y:ị
H
2
SO
4
+ 2 NaOH ® Na
2
SO
4
+ 2H
2
O (1)
Fe
2
(SO
4
)
3
+ 6 NaOH ®2 Fe(OH)
3
+ 3 Na
2
SO
4
(2)
L ng NaOH ph n ng t o k t t a: 0,6 (mol)ượ ả ứ ạ ế ủ
32>
L ng NaOH còn đ tác d ng v i Hượ ề ụ ớ
2
SO
4
còn d trong dung d ch : 0,7-0,6 = 0,1 ư ị
(mol)
H
2
SO
4
đã ph n ng v i h n h p X = 0,8-0,05=0,75 (mol)ả ứ ớ ỗ ợ
32>
+ A B:3C@2C5@>C>ọ ắ ắ ệ

ả ử ệ ể ế
B o toàn electron :ả
0 3
3Fe Fe e
®
2
2
o
O e O
®
6 4
2S e S
®
56x + 16y = 19,2
3x =2y +2z
0,75= z +3x/2
%Kx= 0,3 (mol); y = 0,15 (mol); z = 0,3 (mol)
Th tích khí (đktc) V =6,72 (lit)ể
32>
Ch t tan trong dung d ch Z: ấ ị
Na
2
SO
4
: 0,35 (mol)
Fe
2
(SO
4
)
3
còn: 0,05 (mol)
Kh i l ng ch t tan trong Z =m = 69,7 (gam)ố ượ ấ
32>
2?
nFeSO
4
.7H
2
O = 5a trong 20ml Y có (a + 0,005) mol SO
4
2-
TN1: nSO
4
2-
= nBaSO
4
= 0,01 = a + 0,005 a = 0,005 m = 0,005x5x278 = 6,95 32>
TN2: ne = 5nKMnO
4
= 5x0,0086x0,1 = 0,0043 = nFe
2+
còn l iạ
%nFe
2+
b oxi hóa = (0,005 – 0,0043)x100/0,005 = 14%ị
32>
"E
=
ể
& I ướ ẫ ấ ể
PTHH: C
6
H
12
O
6
(l) + 6O
2
(g) → 6CO
2
(g) + 6H
2
O (l)
∆
r
H = 6Δ
f
H
o
298
(CO
2
) + 6Δ
f
H
o
298
(H
2
O) - Δ
f
H
o
298
(C
6
H
12
O
6
) - 6Δ
f
H
o
298
(O
2
)
= 6.(- 393,5) + 6.(-285,8) - (- 1271) - 6.0
= -2 804,8 (kJ).
3>
Năng l ng ng i th tiêu hao = 500.9,8.10 = 49 000 (J) = 49 (kJ).ượ ườ ợ
Kh i l ng glucose c n n p =ố ượ ầ ạ 49.1802804,8 = 3,15 (g)
3>
"F
=
ể
& I ướ ẫ ấ ể
?
C u t o c a COấ ạ ủ
2
3
O 2–
C = O
O
Trên nguyên t carbon trong COử
3
2 –
không còn electron t do ch a liên k t nên ự ư ế
không có kh năng liên k t thêm v i 1 nguyên t oxi đ t o ra COả ế ớ ử ể ạ
2
4
C u t o c a SOấ ạ ủ
2
3
O
??
2–
S = O
O
Trên nguyên t ử sulfur còn 1 c p electron t do ch a liên k t, do đó nguyên t ặ ự ư ế ử
sulfur có th t o liên k t cho nh n v i 1 nguyên t oxygen th t đ t o ra SOể ạ ế ậ ớ ử ứ ư ể ạ
2
4
.
32>
32>
32>
+ A B:3C@2C5@>C>ọ ắ ắ ệ