Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có l i ờ gi i ả ) S
Ở GD – ĐT BÌNH Đ NH Ị KỲ THI CH N Ọ H C Ọ SINH GI I Ỏ C P Ấ T NH Ỉ L P Ớ 12
KHÓA NGÀY: 22 – 10 – 2022 ĐỀ CHÍNH TH C Ứ Môn thi: HOÁ H C Ọ (Đề thi có 2 trang) Th i
ờ gian: 180 phút (không k ể th i ờ gian phát đ ) ề Ngày thi: 22/ 10/ 2022
Câu 1: (2,0 đi m) ể 1. Nguyên t ử c a ủ nguyên t ố Ca có Z = 20. a) Viết c u ấ hình electron nguyên t . ử b) Khi nguyên t ử Ca như n ờ g đi 2 electron t o
ạ thành Ca2+. So sánh bán kính nguyên t ử c a ủ Ca và Ca2+. Giải thích? 2. Trong quá trình s n ả xu t ấ axit sunfuric, ngư i ờ ta dùng H2SO4 đ c ặ h p ấ thụ SO3 theo phư n ơ g pháp ngư c ợ dòng. Vi t ế công th c ứ c u ấ t o ạ c a ủ SO3, H2SO4 và m t ộ oleum d n ạ g H2SO4.SO3.
Câu 2: (2,0 đi m) ể 1. Xét cân b n ằ g: N2 + 3H2 2NH3 ΔH = -92 KJ Cân b n ằ g chuy n ể d ch ị theo chi u ề nào khi: a) Giảm nhi t ệ đ . ộ b) Tăng áp su t ấ chung. 2. Xét phư n ơ g trình nhi t ệ hóa h c: ọ CaCO3(r )
CaO(r ) + CO2(k) ΔH = +144,6 KJ Tính nhi t ệ lư n ợ g c n ầ cung c p ấ để nhi t ệ phân hoàn toàn 1 t n ấ CaCO3. Giả thi t ế r n ằ g ph n ả n ứ g là hoàn toàn và không th t ấ thoát nhi t ệ trong s n ả xu t. ấ 3. Xác đ n ị h nhi t ệ đ ộ sôi c a
ủ PCl3 từ các dữ liệu sau: Ch t ấ S0(J.K-1.mol-1 ) 0 -1 ΔH (KJ.mol ) f PCl3 (l n ỏ g) 217,1 -319,7 PCl3 (khí) 311,7 -287,0
Câu 3: (2,0 đi m) ể 1. Viết phư n ơ g trình hóa h c ọ c a ủ các ph n ả n ứ g sau dư i ớ d n ạ g ion, khi cho: a) Cu vào dung d c ị h FeCl3. b) Dung d ch ị AgNO3 vào dung d ch ị Fe(NO3)2. c) Cho dung d ch ị KMnO4 vào dung d ch ị FeSO4/ H2SO4. d) Cho Zn vào dung d c ị h Na[Ag(CN)2]. 2. Tính pH c a ủ dung d ch ị h n ỗ h p ợ g m
ồ HCOOH 0,01M và HCOONa 0,001M. Bi t ế Ka= 10-3,75.
Câu 4: (2,0 đi m) ể S c ụ khí clo vào dung d c ị h NH4Cl bão hòa ngu i ộ (25 gam dung d ch ị có n n
ồ g độ 26% tính theo kh i ố lư n
ợ g) ở các pH khác nhau. Ở pH = 3 và pH = 9 thu đư c ợ ch t ấ l n ỏ g A (ch a ứ 11,6% kh i ố lư n ợ g nit ) ơ và B (ch a ứ 27,2% kh i ố lư n ợ g nit ) ơ tư n ơ g n ứ g.
Ở pH = 6 thì có 0,242 mol Cl2 bị h p ấ th , ụ thu đư c ợ ch t ấ C. Khi thêm AgNO3 vào dung d c ị h s n ả ph m ẩ n ứ g ở pH = 6 thì lư n ợ g k t ế t a ủ AgCl g p ấ 3 l n ầ so v i ớ trư c ớ khi s c ụ khí clo. 1. Xác đ n ị h công th c ứ các ch t ấ A, B, C và vi t ế phư n ơ g trình ph n ả n ứ g. 2. Tính th
ể tích khí clo (đktc) đã tham gia ph n ả n ứ g ở pH = 3 và pH = 9.
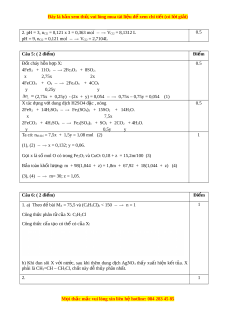
Câu 5: (2,0 đi m) ể Cho m gam h n ỗ h p ợ X g m
ồ FeS2, FeCO3, CuO và Fe2O3 (trong X oxi chi m ế 15,2% về kh i ố lư n ợ g)
vào bình kín (thể tích không đ i) ổ ch a ứ 0,54 mol O2 d . ư Nung nóng bình đ n ế khi các ph n ả n ứ g x y ả ra hoàn toàn r i ồ đ a ư v ề nhi t ệ đ ộ ban đ u ầ thì áp su t ấ trong bình gi m ả 10% so v i ớ áp su t ấ ban đ u ầ 9coi thể tích ch t ấ r n ắ thay đ i ổ không đáng k ) ể . M t ặ khác, hòa tan h t ế m gam X b n ằ g dung d ch ị H2SO4 đ c ặ nóng, thu đư c ợ dung d ch ị Y ch a ứ 1,8m gam h n ỗ h p ợ mu i ố g m
ồ CuSO4 và Fe2(SO4)3 và 1,08 mol h n ỗ h p ợ khí g m
ồ CO2, SO2. Viết các phư n ơ g trình hóa h c ọ x y ả ra và tính m.
Câu 6: (2,0 đi m) ể 1. H p ợ ch t ấ h u ữ c ơ X m c ạ h h ở có d n ạ g (C3H5Cl)n. a) Xác đ n ị h CTPT và c u ấ trúc có th ể có c a ủ X, bi t ế MX < 150. M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có l i ờ gi i ả ) b) Khi đun sôi X v i ớ nư c, ớ sau đó thêm dung d ch ị AgNO3 th y ấ xu t ấ hi n ệ k t ế t a. ủ Xác đ n ị h c u ấ trúc c a ủ X. 2. Nung nóng a mol h n ỗ h p ợ X g m
ồ propen, axetilen và hidro v i
ớ xúc tác Ni trong bình kín (ch ỉx y ả ra ph n ả n ứ g c n ộ g H2), sau m t ộ th i ờ gian thu đư c ợ h n ỗ h p ợ khí Y có t ỷ kh i ố so v i ớ X là 1,25. Đ t ố cháy h t ế Y, thu đư c
ợ 0,87 mol CO2 và 1,05 mol H2O. Mặt khác, Y ph n ả n ứ g t i ố đa v i ớ 0,42 mol brom trong dung d c ị h. Tính a.
Câu 7: (2,0 đi m) ể Ch t ấ béo X t o ạ b i
ở 3 axit béo Y, Z, T. Cho 26,12 gam E g m ồ X, Y, Z và T tác d n ụ g v i ớ lư n ợ g d ư H 2 trong đi u ề ki n ệ Ni, toC, thu đư c ợ 26,32 gam h n ỗ h p ợ F g m ồ ch t
ấ béo no và các axit béo no. M t ặ khác, để tác d n ụ g hoàn toàn v i ớ 26,12 gam E c n ầ v a ừ đ ủ 0,09 mol NaOH, thu đư c ợ 27,34 gam mu i. ố Đ ể đ t ố
cháy hoàn toàn 39,18 gam E c n ầ t i
ố đa a mol khí O2. Tính a.
Câu 8: (2,0 đi m) ể 1. Xác đ nh
ị cấu tạo các chất trong s đ ơ s ồ au: 2. Xác đ nh ị cấu tạo c a ủ các chất từ X1 đ n X ế 8
Câu 9: (2,0 điểm) Viết cơ ch c ế a ủ s c ự huy n ể hóa sau:
Câu 10: (2,0 điểm) 1. α-Glucoz c ơ ó cấu trúc nh s ư au: M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có l i ờ gi i ả ) Hãy v c ẽ ấu trúc c a
ủ β-Glucozơ và Glucozơ mạch h . ở Vì sao β-Glucoz b ơ n h ề n α ơ -Glucoz ? ơ 2. Bằng nhiều phản ng, t ứ h c ự hi n ệ chuy n hóa ể sau:
……………….. HẾT ……………….
SỞ GD – ĐT BÌNH Đ N Ị H KỲ THI CH N Ọ H C Ọ SINH GI I Ỏ C P Ấ T N Ỉ H
LỚP 12 THPT – KHÓA NGÀY 22 – 10 – 2022 ĐỀ CHÍNH TH C Ứ Môn thi: HÓA H C Ọ HƯỚNG D N Ẫ CH M Ấ MÔN HÓA H C Ọ ( Bảng hư n ớ g d n ẫ ch m
ấ có 05 trang) Câu 1: ( 2 đi m) ể Đi m ể
1. a) Cấu hình electron nguyên t c ử a ủ Ca: 1s22s22p63s23p64s2. 1.5 b) Cấu hình e;ectron c a ủ Ca2+:1s22s22p63s23p6. Bán kính c a
ủ Ca > Ca2+ vì Ca có 4 l p
ớ electron còn Ca2+ có 3 l p ớ electron. 0.5 Câu 2: ( 2 đi m) ể Đi m ể 1. a) Khi gi m ả nhi t ệ độ cân b ng ằ chuy n ể d c ị h theo chi u ề thu n, ậ vì chi u ề thu n ậ là 0.5 chiều t a ỏ nhi t ệ . b) Khi tăng áp su t ấ cân b ng ằ chuy n ể d c ị h theo chi u ề thu n ậ vì chi u ề thu n ậ là chi u ề giảm s m ố ol phân tử khí 2. Nhiệt lư ng ợ cần cung cấp đ nhi ể t
ệ phân 1 mol CaCO3 là 144,6 KJ.mol-1. 0.5 S m ố ol CaCO3: 10000 mol. Lư ng ợ nhi t
ệ cần cung cấp: (144,6*10000) = 144,6.104KJ. 3. Xét quá trình: PCl 1 3(l ng) ỏ PCl3(khí) 0
ΔS = 311,7 – 217,1 = 94,6 J.K-1 0
ΔH = (-287,0) – (-319,7) = 32,7 KJ 0 ΔH Nhiệt đ s ộ ôi: T = = 345 K 0 ΔS M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có l i ờ gi i ả ) Vậy PCl 0 3 sôi ở 346 – 273 = 73 C. Câu 3: ( 2 đi m) ể Đi m ể
1. a) Cu + 2Fe3+ Cu2+ + 2Fe2+. 1
b) Fe2+ + Ag+ Fe3+ + Ag.
c) 5Fe2+ + 8H+ + MNO -4 5Fe3+ + Mn2+ + 4H2O.
d) Zn + 2[Ag(CN)2]- [Zn(CN)4]2- + 2Ag. 2. Các quá trình: 1 HCOONa HCOO- + Na+ H2O H+ + OH- (1) HCOOH H+ + HCOO- (2) Ka HCOO- + H2O HCOOH + OH- (3) Kb Đây là dung d c ị h đ m ệ . Trư c ớ h t
ế ta tính gần đúng n ng đ ồ ộ H+. CHCOOH 2,75 7 Do [H+] ≈ K . 10 10 a C - HCOO Vậy dung d c ị h có môi trư ng a ờ xit. Vì th c ế ân b ng (2) quy ằ t ế đ nh pH ị c a ủ dung d c ị h.
Xét cân bằng: HCOOH H+ + HCOO- Ka Ban đầu: 10-2 0 10-3 [ ]: 10-2 - x x 10-3 + x x(0,001 x) 3,75 K 10 a 0,01 x = 8,69.10-4 pH = 3,06 x Câu 4: ( 2 đi m) ể Đi m ể 1. G i
ọ A và B là các chất có công th c ứ t ng ổ quát NHxCly, ta có 0.75 + V i ớ chất A: 14 0,116; x + 35,5y = 106,7 14 + x + 35,5y x = 0, y = 3 A: NCl3. + V i ớ chất B: 14 0,272; x + 35,5y = 37,5 14 + x + 35,5y x = 2, y = 1 B: NH2Cl. 25*0,26 0.75 Trư c ớ khi s c ụ khí clo ta có: n = n = n = = 0,121mol - NH 4Cl AgCl Cl 53,5 Khi đã s c ụ 0,242 mol Cl2 ta đư c
ợ số mol AgCl: 0,121x3 = 0,363 mol, t c ứ đã có thêm 0,242 mol Cl-. n - 0,242*2 - 0,242 2 Tính: Cl = = ư ậ ị n 0,121
1 . Nh v y NHCl2 sinh ra trong dung d ch. + NH4 Các phản ng x ứ ảy ra:
NH4Cl + 3Cl2 NCl3 + 4HCl
NH4Cl + 2Cl2 NHCl2 + 3HCl
NH4Cl + Cl2 NH2Cl + 2HCl Ag+ + Cl- AgCl M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đề HSG Hóa 12 Bình Định năm 2023 có đáp án
1.6 K
808 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Tài liệu được cập nhật liên tục trong gói này từ nay đến hết tháng 3/2024. Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu Đề HSG Hóa 12 Bình Định năm 2023 có đáp án.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(1616 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 12
Xem thêmTài liệu bộ mới nhất
Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
S GD – ĐT BÌNH Đ NHỞ Ị
Đ CHÍNH TH CỀ Ứ
(Đ thi có 2 trang)ề
KỲ THI CH N H C SINH GI I C P T NH L P 12Ọ Ọ Ỏ Ấ Ỉ Ớ
KHÓA NGÀY: 22 – 10 – 2022
Môn thi: HOÁ H C Ọ
Th i gian: ờ 180 phút (không k th i gian phát đ )ể ờ ề
Ngày thi: 22/ 10/ 2022
Câu 1: (2,0 đi m)ể
1. Nguyên t c a nguyên t Ca có Z = 20.ử ủ ố
a) Vi t c u hình electron nguyên t .ế ấ ử
b) Khi nguyên t Ca nh ng đi 2 electron t o thành Caử ườ ạ
2+
. So sánh bán kính nguyên t c a Ca và ử ủ
Ca
2+
. Gi i thích?ả
2. Trong quá trình s n xu t axit sunfuric, ng i ta dùng Hả ấ ườ
2
SO
4
đ c h p th SOặ ấ ụ
3
theo ph ng phápươ
ng c dòng. Vi t công th c c u t o c a SOượ ế ứ ấ ạ ủ
3
, H
2
SO
4
và m t oleum d ng Hộ ạ
2
SO
4
.SO
3
.
Câu 2: (2,0 đi m)ể
1. Xét cân b ng: Nằ
2
+ 3H
2
2NH
3
ΔH = -92 KJ
Cân b ng chuy n d ch theo chi u nào khi: ằ ể ị ề
a) Gi m nhi t đ .ả ệ ộ
b) Tăng áp su t chung.ấ
2. Xét ph ng trình nhi t hóa h c: CaCOươ ệ ọ
3(r )
CaO
(r )
+ CO
2(k)
ΔH = +144,6 KJ
Tính nhi t l ng c n cung c p đ nhi t phân hoàn toàn 1 t n CaCOệ ượ ầ ấ ể ệ ấ
3
. Gi thi t r ng ph n ng là hoànả ế ằ ả ứ
toàn và không th t thoát nhi t trong s n xu t.ấ ệ ả ấ
3. Xác đ nh nhi t đ sôi c a PClị ệ ộ ủ
3
từ các dữ liệu sau:
Ch tấ S
0
(J.K
-1
.mol
-1
)
0 -1
f
ΔH (KJ.mol )
PCl
3
(l ng)ỏ 217,1 -319,7
PCl
3
(khí) 311,7 -287,0
Câu 3: (2,0 đi m)ể
1. Vi t ph ng trình hóa h c c a các ph n ng sau d i d ng ion, khi cho:ế ươ ọ ủ ả ứ ướ ạ
a) Cu vào dung d ch FeClị
3
.
b) Dung d ch AgNOị
3
vào dung d ch Fe(NOị
3
)
2
.
c) Cho dung d ch KMnOị
4
vào dung d ch FeSOị
4
/ H
2
SO
4
.
d) Cho Zn vào dung d ch Na[Ag(CN)ị
2
].
2. Tính pH c a dung d ch h n h p g m HCOOH 0,01M và HCOONa 0,001M. Bi t Kủ ị ỗ ợ ồ ế
a
= 10
-3,75
.
Câu 4: (2,0 đi m)ể
S c khí clo vào dung d ch NHụ ị
4
Cl bão hòa ngu i (25 gam dung d ch có n ng đ 26% tính theo kh iộ ị ồ ộ ố
l ng) các pH khác nhau. pH = 3 và pH = 9 thu đ c ch t l ng A (ch a 11,6% kh i l ng nit ) vàượ ở Ở ượ ấ ỏ ứ ố ượ ơ
B (ch a 27,2% kh i l ng nit ) t ng ng. pH = 6 thì có 0,242 mol Clứ ố ượ ơ ươ ứ Ở
2
b h p th , thu đ c ch t C.ị ấ ụ ượ ấ
Khi thêm AgNO
3
vào dung d ch s n ph m ng pH = 6 thì l ng k t t a AgCl g p 3 l n so v i tr cị ả ẩ ứ ở ượ ế ủ ấ ầ ớ ướ
khi s c khí clo.ụ
1. Xác đ nh công th c các ch t A, B, C và vi t ph ng trình ph n ng.ị ứ ấ ế ươ ả ứ
2. Tính th tích khí clo (đktc) đã tham gia ph n ng pH = 3 và pH = 9.ể ả ứ ở
Câu 5: (2,0 đi m)ể
Cho m gam h n h p X g m FeSỗ ợ ồ
2
, FeCO
3
, CuO và Fe
2
O
3
(trong X oxi chi m 15,2% v kh i l ng)ế ề ố ượ
vào bình kín (th tích không đ i) ch a 0,54 mol Oể ổ ứ
2
d . Nung nóng bình đ n khi các ph n ng x y raư ế ả ứ ả
hoàn toàn r i đ a v nhi t đ ban đ u thì áp su t trong bình gi m 10% so v i áp su t ban đ u 9coi thồ ư ề ệ ộ ầ ấ ả ớ ấ ầ ể
tích ch t r n thay đ i không đáng k ). M t khác, hòa tan h t m gam X b ng dung d ch Hấ ắ ổ ể ặ ế ằ ị
2
SO
4
đ c nóng,ặ
thu đ c dung d ch Y ch a 1,8m gam h n h p mu i g m CuSOượ ị ứ ỗ ợ ố ồ
4
và Fe
2
(SO
4
)
3
và 1,08 mol h n h p khíỗ ợ
g m COồ
2
, SO
2
. Vi t các ph ng trình hóa h c x y ra và tính m.ế ươ ọ ả
Câu 6: (2,0 đi m)ể
1. H p ch t h u c X m ch h có d ng (Cợ ấ ữ ơ ạ ở ạ
3
H
5
Cl)
n
.
a) Xác đ nh CTPT và c u trúc có th có c a X, bi t Mị ấ ể ủ ế
X
< 150.
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
b) Khi đun sôi X v i n c, sau đó thêm dung d ch AgNOớ ướ ị
3
th y xu t hi n k t t a. Xác đ nh c u trúcấ ấ ệ ế ủ ị ấ
c a X.ủ
2. Nung nóng a mol h n h p X g m propen, axetilen và hidro v i xúc tác Ni trong bình kín (ch x yỗ ợ ồ ớ ỉ ả
ra ph n ng c ng Hả ứ ộ
2
), sau m t th i gian thu đ c h n h p khí Y có t kh i so v i X là 1,25. Đ tộ ờ ượ ỗ ợ ỷ ố ớ ố
cháy h t Y, thu đ c 0,87 mol COế ượ
2
và 1,05 mol H
2
O. M t khác, Y ph n ng t i đa v i 0,42 molặ ả ứ ố ớ
brom trong dung d ch. Tính a.ị
Câu 7: (2,0 đi m)ể
Ch t béo X t o b i 3 axit béo Y, Z, T. Cho 26,12 gam E g m X, Y, Z và T tác d ng v i l ng d Hấ ạ ở ồ ụ ớ ượ ư
2
trong đi u ki n Ni, tề ệ
o
C, thu đ c 26,32 gam h n h p F g m ch t béo no và các axit béo no. M t khác,ượ ỗ ợ ồ ấ ặ
đ tác d ng hoàn toàn v i 26,12 gam E c n v a đ 0,09 mol NaOH, thu đ c 27,34 gam mu i. Đ đ tể ụ ớ ầ ừ ủ ượ ố ể ố
cháy hoàn toàn 39,18 gam E c n t i đa a mol khí Oầ ố
2
. Tính a.
Câu 8: (2,0 đi m)ể
1. Xác đ nh c u t o các ch t trong s đ sau: ị ấ ạ ấ ơ ồ
2. Xác đ nh c u t o c a các ch t t X1 đ n X8ị ấ ạ ủ ấ ừ ế
Câu 9: (2,0 đi m)ể
Vi t c ch c a s chuy n hóa sau: ế ơ ế ủ ự ể
Câu 10: (2,0 đi m)ể
1. α-Glucoz có c u trúc nh sau: ơ ấ ư
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
Hãy v c u trúc c a β-Glucoz và Glucoz m ch h . Vì sao β-Glucoz b n h n α-Glucoz ?ẽ ấ ủ ơ ơ ạ ở ơ ề ơ ơ
2. B ng nhi u ph n ng, th c hi n chuy n hóa sau:ằ ề ả ứ ự ệ ể
……………….. H T ……………….Ế
S GD – ĐT BÌNH Đ NHỞ Ị
Đ CHÍNH TH CỀ Ứ
KỲ THI CH N H C SINH GI I C P T NH Ọ Ọ Ỏ Ấ Ỉ
L P 12 THPT – KHÓA NGÀY 22 – 10 – 2022Ớ
Môn thi: HÓA H CỌ
H NG D N CH M MÔN HÓA H CƯỚ Ẫ Ấ Ọ
( B ng h ng d n ch m có 05 trang)ả ướ ẫ ấ
Câu 1: ( 2 đi m)ể Đi mể
1. a) C u hình electron nguyên t c a Ca: 1sấ ử ủ
2
2s
2
2p
6
3s
2
3p
6
4s
2
.
b) C u hình e;ectron c a Caấ ủ
2+
:1s
2
2s
2
2p
6
3s
2
3p
6
.
Bán kính c a Ca > Caủ
2+
vì Ca có 4 l p electron còn Caớ
2+
có 3 l p electron.ớ
1.5
0.5
Câu 2: ( 2 đi m)ể Đi mể
1. a) Khi gi m nhi t đ cân b ng chuy n d ch theo chi u thu n, vì chi u thu n làả ệ ộ ằ ể ị ề ậ ề ậ
chi u t a nhi t.ề ỏ ệ
b) Khi tăng áp su t cân b ng chuy n d ch theo chi u thu n vì chi u thu n là chi uấ ằ ể ị ề ậ ề ậ ề
gi m s mol phân t khíả ố ử
0.5
2. Nhi t l ng c n cung c p đ nhi t phân 1 mol CaCOệ ượ ầ ấ ể ệ
3
là 144,6 KJ.mol
-1
.
S mol CaCOố
3
: 10000 mol.
L ng nhi t c n cung c p: (144,6*10000) = 144,6.10ượ ệ ầ ấ
4
KJ.
0.5
3. Xét quá trình: PCl
3(l ng)ỏ
PCl
3(khí)
0
ΔS =
311,7 – 217,1 = 94,6 J.K
-1
0
ΔH =
(-287,0) – (-319,7) = 32,7 KJ
Nhi t đ sôi: ệ ộ
0
0
ΔH
T = = 345 K
ΔS
1
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
V y PClậ
3
sôi 346 – 273 = 73ở
0
C.
Câu 3: ( 2 đi m)ể Đi mể
1. a) Cu + 2Fe
3+
Cu
2+
+ 2Fe
2+
.
b) Fe
2+
+ Ag
+
Fe
3+
+ Ag.
c) 5Fe
2+
+ 8H
+
+ MNO
4
-
5Fe
3+
+ Mn
2+
+ 4H
2
O.
d) Zn + 2[Ag(CN)
2
]
-
[Zn(CN)
4
]
2-
+ 2Ag.
1
2. Các quá trình:
HCOONa
HCOO
-
+ Na
+
H
2
O
H
+
+ OH
-
(1)
HCOOH
H
+
+ HCOO
-
(2) K
a
HCOO
-
+ H
2
O
HCOOH + OH
-
(3) K
b
Đây là dung d ch đ m. Tr c h t ta tính g n đúng n ng đ Hị ệ ướ ế ầ ồ ộ
+
.
Do [H
+
] ≈
-
2,75 7
HCOOH
a
HCOO
C
K . 10 10
C
V y dung d ch có môi tr ng axit. Vì th cân b ng (2) quy t đ nh pH c a dung d ch.ậ ị ườ ế ằ ế ị ủ ị
Xét cân b ng: HCOOH ằ
H
+
+ HCOO
-
K
a
Ban đ u: 10ầ
-2
0 10
-3
[ ]: 10
-2
- x x 10
-3
+ x
3,75
(0,001 )
10
0,01
a
x x
K
x
x = 8,69.10
-4
pH = 3,06
1
Câu 4: ( 2 đi m)ể Đi mể
1. G i A và B là các ch t có công th c t ng quát NHọ ấ ứ ổ
x
Cl
y
, ta có
+ V i ch t A: ớ ấ
14
0,116; x + 35,5y = 106,7
14 + x + 35,5y
x = 0, y = 3
A: NCl
3
.
+ V i ch t B: ớ ấ
14
0,272; x + 35,5y = 37,5
14 + x + 35,5y
x = 2, y = 1
B: NH
2
Cl.
0.75
Tr c khi s c khí clo ta có: ướ ụ
-
4
NH Cl AgCl
Cl
25*0,26
n = n = n = = 0,121mol
53,5
Khi đã s c 0,242 mol Clụ
2
ta đ c s mol AgCl: 0,121xượ ố
3
= 0,363 mol, t c đã có thêmứ
0,242 mol Cl
-
.
Tính:
-
+
4
Cl
NH
n
0,242*2 - 0,242 2
= =
n 0,121 1
. Nh v y NHClư ậ
2
sinh ra trong dung d ch.ị
Các ph n ng x y ra:ả ứ ả
NH
4
Cl + 3Cl
2
NCl
3
+ 4HCl
NH
4
Cl + 2Cl
2
NHCl
2
+ 3HCl
NH
4
Cl + Cl
2
NH
2
Cl + 2HCl
Ag
+
+ Cl
-
AgCl
0.75
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
2. pH = 3, n
Cl2
= 0,121 x 3 = 0,363 mol
V
Cl2
= 8,1312 L
pH = 9, n
Cl2
= 0,121 mol
V
Cl2
= 2,7104L
0.5
Câu 5: ( 2 đi m)ể Đi mể
Đ t cháy h n h p X:ố ỗ ợ
4FeS
2
+ 11O
2
2Fe
2
O
3
+ 8SO
2
.
x 2,75x 2x
4FeCO
3
+ O
2
2Fe
2
O
3
+ 4CO
2
y 0,25y y
n
(2,75x + 0,25y) - (2x + y) = 0,054
0,75x – 0,75y = 0,054 (1)
0.5
X tác d ng v i dung d ch H2SO4 đ c , nóngụ ớ ị ặ
2FeS
2
+ 14H
2
SO
4
Fe
2
(SO
4
)
3
+ 15SO
2
+ 14H
2
O.
x 7,5x
2FeCO
3
+ 4H
2
SO
4
Fe
2
(SO
4
)
3
+ SO
2
+ 2CO
2
+ 4H
2
O.
y 0,5y y
0.5
Ta có: n
hh khí
= 7,5x + 1,5y = 1,08 mol (2)
(1), (2)
x = 0,132; y = 0,06.
G i x là s mol O có trong Feọ ố
2
O
3
và CuO: 0,18 + z = 15,2m/100 (3)
B o toàn kh i l ng: m + 98(1,044 + z) = 1,8m + 67,92 + 18(1,044 + z) (4)ả ố ượ
(3), (4)
m= 30; z = 1,05.
1
Câu 6: ( 2 đi m)ể Đi mể
1. a) Theo đ bài Mề
X
= 75,5 và (C
3
H
5
Cl)
n
< 150
n = 1
Công th c phân t c a X: Cứ ử ủ
3
H
5
Cl
Công th c c u t o có th có c a X:ứ ấ ạ ể ủ
b) Khi đun sôi X v i n c, sau khi thêm dung d ch AgNOớ ướ ị
3
th y xu t hi n k t t a. Xấ ấ ệ ế ủ
ph i là CHả
2
=CH – CH
2
Cl, ch t này d th y phân nh t.ấ ễ ủ ấ
1
2. 1
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ