Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t (c ế ó l i ờ gi i ả ) SỞ GIÁO D C Ụ VÀ ĐÀO T O Ạ KÌ THI CH N Ọ H C Ọ SINH GI I Ỏ THÀNH PHỐ HÀ N I Ộ
LỚP 12 THPT NĂM H C Ọ 2022 - 2023 Môn: HÓA H C Ọ Đ C Ề HÍNH TH C Ứ
Ngày thi: 28 tháng 9 năm 2022 Th i
ờ gian làm bài: 180 phút (Đề thi g m ồ 02 trang) Cho bi t ế nguyên tử khối c a
ủ các nguyên tố: H = 1; Li = 7; C = 12; N = 14; O = 16; Na = 23; Mg =
24; S = 32; Cl = 35,5; K = 39; Ca = 40; Fe = 56; Rb = 85; Ag = 108; Ba = 137. Các ph n ả ng ứ x y ả ra hoàn toàn. NA = 6,02.1023.
Câu I (3,0 điểm) 1. Vì sao để d p ậ t t ắ các đám cháy xăng d u ầ nhỏ ngư i ờ ta không đư c ợ dùng nư c ớ nh ng ư có th ể dùng
chăn chiên (loại chăn làm từ s i ợ cotton v i ớ nguyên li u ệ chính là s i ợ bông) th m ấ nư c ớ ?
2. Máu trong cơ thể ngư i ờ có màu đ ỏ vì ch a ứ hemoglobin (là ch t ấ v n ậ chuy n ể oxi ch a ứ s t ắ ). Máu c a ủ một số loài đ ng ộ v t ậ chân kh p ớ và thân m m ề l i ạ có màu xanh vì ch a ứ hemocyanin (là ch t ấ v n ậ chuy n ể oxi ch a ứ kim lo i ạ M). M t n ồ t i ạ trong tự nhiên v i ớ 2 lo i ạ đ ng
ồ vị X và Y trong đó Y chi m ế 27,3% số nguyên t . ử Nguyên tử X có t ng ổ số h t ạ proton, n t
ơ ron, electron là 92 trong đó số h t ạ mang đi n ệ nhi u ề h n ơ s h ố ạt không mang đi n l ệ à 24. S n ố t
ơ ron trong nguyên tử Y nhi u h ề n t ơ rong nguyên t X ử là 2. a) Tính nguyên tử kh i ố trung bình của kim lo i ạ M.
b) Viết cấu hình electron và cho bi t ế v t ị rí c a ủ M trong b ng t ả u n hoà ầ n các nguyên t hóa ố h c ọ . c) Tế bào đ n ơ vị (ô m ng ạ cơ s ) ở c a ủ M có d ng ạ l p ậ phư ng ơ tâm di n. ệ Kh i ố lư ng ợ riêng c a ủ tinh thể
M là 8,92 g/cm3. Tính bán kính nguyên tử M và ph n
ầ trăm thể tích bị chi m ế b i ở các nguyên tử trong ô mạng cơ s . ở 3. Trong công nghi p
ệ cũng như trong phòng thí nghi m ệ , Br2 có thể đư c ợ đi u ề chế b ng ằ phư ng ơ pháp dùng Cl2 oxi hóa ion - Br trong dung d c ị h mu i ố . Công nghi p ệ hóa h c ọ đi u ề chế Br2 từ nư c ớ bi n ể (ch a ứ
brom ở dạng NaBr) theo quy trình sau: s c ụ khí Cl2 vào nư c ớ bi n ể đã đư c ợ axit hóa b ng ằ dung d c ị h H2SO4, sau đó ch ng ư cất thu đư c ợ Br2 sạch. a) Viết phư ng ơ trình hóa h c ọ c a ủ ph n ả ng đi ứ u c ề h Br ế 2. b) Nêu vai trò c a ủ H2SO4. c) Br2 l ng ỏ hay h i ơ đ u ề r t ấ đ c ộ . Khi làm thí nghi m ệ , do s ơ su t ấ m t ộ h c ọ sinh làm đ ổ m t ộ lư ng ợ Br2 l ng. ỏ Đề xuất một hóa ch t ấ thông d ng
ụ để xử lý Br2 bị đổ ra, vi t ế phư ng ơ trình hóa h c ọ gi i ả thích.
Câu II (3,0 điểm)
1. Cân bằng các phư ng ơ trình hóa h c ọ sau b ng ằ phư ng ơ
pháp thăng bằng electron, xác đ nh c ị hất kh và ử chất oxi hóa:
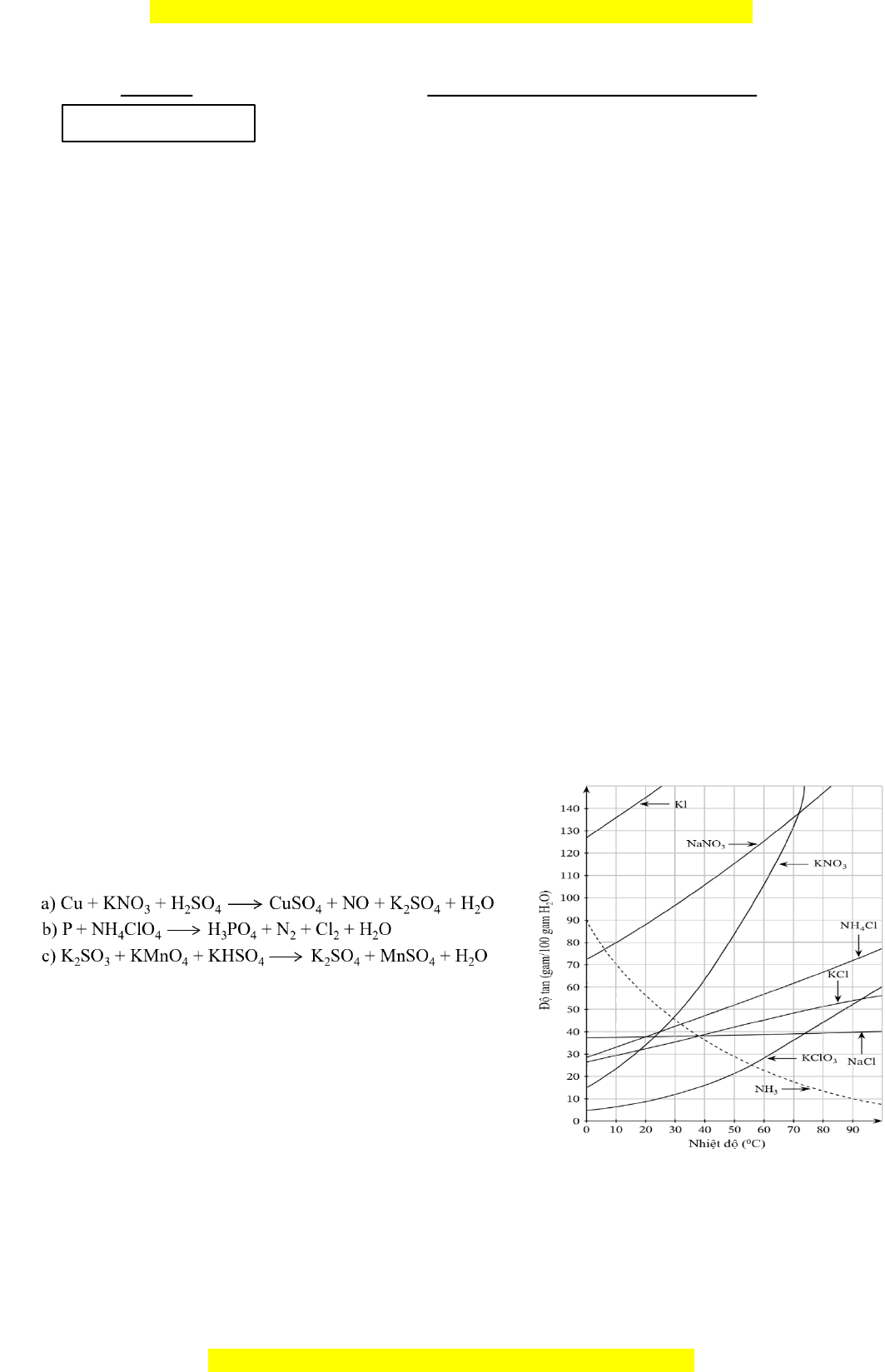
2. Giản đồ hình bên mô tả sự bi n ế đ i ổ độ tan trong nư c ớ của m t ộ s c ố hất theo nhi t ệ đ . ộ a) Ở nhi t ệ độ phòng, ch t ấ nào tan ít nh t ấ , ch t ấ nào tan nhiều nhất? b) Khi nhi t ệ độ tăng, độ tan c a ủ ch t ấ nào gi m ả ? Gi i ả thích. c) Chất nào có đ ộ tan ít ph ụ thu c ộ vào nhi t ệ đ ộ nh t ấ , ch t ấ nào có đ t ộ an thay đ i ổ nhi u nh ề ất theo nhi t ệ đ ? ộ d) Người ta d a
ự vào sự khác nhau về độ tan trong nư c ớ theo nhi t ệ độ c a ủ NaCl và KCl đ ể tách riêng t ng ừ chất ra kh i
ỏ quặng xinvinit (NaCl.KCl). Nêu cách làm. 3. Dẫn h n ỗ h p ợ khí g m
ồ CO2, C2H4, C2H2 vào dung d c ị h ch a ứ lư ng ợ dư m t ộ ch t ấ tan X th y ấ thoát ra h n ỗ h p ợ khí Y g m ồ hai ch t ấ . Đề xu t ấ hai ch t ấ X (khác lo i ạ ) th a ỏ mãn đi u ề ki n ệ trên và vi t ế phư ng ơ trình hóa h c ọ c a ủ các ph n ả ng x ứ y ra ả .
Câu III (3,5 điểm) M i
ọ thắc mắc vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t (c ế ó l i ờ gi i ả ) 2- 1. Để xác đ nh ị sự có m t ặ c a
ủ ion SO3 trong rau quả khô, m t ộ h c ọ sinh ngâm m t ộ ít quả đ u ậ trong nước. Sau m t ộ th i ờ gian, l c ọ l y ấ dung d c ị h r i ồ cho tác d ng v ụ i ớ dung d c
ị h H2O2, sau đó cho tác d ng ụ ti p ế v i ớ dung d c ị h BaCl2. Viết phư ng ơ trình ion rút g n c ọ a ủ các ph n ả ng x ứ y ra ả . 2. Axit X là ch t ấ r n, ắ trong su t
ố , không màu, dễ tan trong nư c ớ . Khi thêm canxi oxit t i ớ d ư vào dung d c ị h X thì t o ạ thành h p ợ ch t ấ Y màu tr ng, ắ không tan trong nư c ớ . Khi nung Y ở nhi t ệ đ ộ cao v i ớ cát và than thì t o ạ thành đ n ơ ch t
ấ photpho có trong thành ph n ầ c a
ủ X. Trong phòng thí nghi m ệ , có th ể đi u ề chế X từ ph n ả ng ứ c a ủ photpho v i ớ axit Z. Cho bi t ế X, Y, Z là nh ng ữ ch t ấ gì? Vi t ế phư ng ơ trình hóa h c ọ c a ủ các phản ng x ứ ảy ra. 3. Xác đ nh ị các chất h u c ữ X
ơ , Y, Z, T, M, N, K (có hai ch t ấ thu c ộ lo i
ạ anđehit, MZ + MN = 123) và viết phư ng ơ trình hóa h c ọ thực hi n dã ệ y chuy n hóa ể sau (ghi rõ đi u ki ề n, ệ n u c ế ó):
Câu IV (3,5 điểm) 1. Dẫn 0,55 mol h n ỗ h p ợ X g m ồ h i ơ nư c
ớ và khí cacbonic qua than nung đ ỏ thu đư c ợ a mol h n ỗ h p ợ
khí Y gồm CO, H2, CO2 (trong Y có b mol CO2). Hấp thụ hết b mol CO2 ở trên bằng dung d c ị h chứa
hỗn hợp KOH 0,15M và Na2CO3 0,05M thu được dung dịch Z. Nh ỏ từ t ừ toàn b ộ dung d c ị h Z vào 200
ml dung dịch NaHSO4 0,5M đồng thời khuấy đều, sau khi k t ế thúc ph n ả n ứ g thu đư c ợ 1,568 lít (đktc)
khí CO2 và dung dịch T. Thêm dung d c
ị h Ba(OH)2 tới dư vào T thì thu đư c ợ 78,46 gam kết t a ủ . Tìm giá trị của a và b. 2. Cho 0,025 mol h n ỗ h p ợ X có kh i ố lư ng ợ 1,11 gam g m ồ hai anđehit đ n ơ ch c ứ tác d ng hoà ụ n toàn v i ớ lư ng ợ dư dung d c
ị h AgNO3 trong NH3, đun nóng thu đư c ợ 7,56 gam b c ạ . M t ặ khác, m gam X ph n ả ng ứ t i ố đa v i
ớ 2,464 lít (đktc) khí H2 khi có xúc tác Ni, đun nóng. Tìm giá trị c a ủ m và vi t ế phư ng ơ trình hóa h c ọ c a ủ các phản ng x ứ ảy ra.
Câu V (3,5 điểm) 1. Để xác đ nh ị công th c ứ c a ủ m t
ộ khoáng vật X, người ta ti n hà ế nh các thí nghi m ệ sau: - Thí nghi m
ệ 1: Cho 4,44 gam X tác d ng ụ v i ớ lư ng ợ d ư dung d c ị h axit HCl thu đư c ợ 0,5376 lít (đktc)
khí Y không màu, không mùi, làm đ c ụ nư c ớ vôi trong nh ng ư không làm m t ấ màu nư c ớ brom. 159m - Thí nghi m ệ 2: Nung nóng m gam X 200 ở 0C thu đư c
ợ 370 gam chất rắn Z (ch c ỉ h a ứ m t ộ chất), h n ỗ h p ợ g m ồ khí và h i
ơ không màu, không mùi. N u ế ti p ế t c ụ nung nóng Z ở nhi t ệ đ ộ cao h n ơ thì kh i ố lư ng ợ v n ẫ không đ i ổ . L y 1, ấ 325 gam Z cho tác d ng v ụ i ớ lư ng d ợ ư dung d c ị h axit HCl thu đư c ợ 0,28 lít (đktc) khí Y. Xác đ nh ị công th c ứ c a ủ X. 2. H n ỗ h p ợ E gồm este X ba ch c ứ và este Y hai ch c ứ (phân t ử X, Y đ u ề không ch a ứ nhóm ch c ứ nào
khác) có tỉ lệ mol tư ng ơ ng ứ là a : b. Khi tỉ l ệ a : b thay đ i ổ , số mol NaOH ph n ả ng ứ t i ố đa luôn g p ấ 3
lần số mol E. Trong trư ng ờ h p
ợ a : b = 1 : 3, xà phòng hóa hoàn toàn x mol E b ng ằ dung d c ị h NaOH v a ừ đ , ủ cô c n ạ dung d c ị h sau ph n ả ng ứ thu đư c ợ 19,92 gam mu i ố và 1,25x mol m t ộ ancol duy nh t ấ . Cho toàn bộ lư ng
ợ ancol này vào bình đ ng
ự Na dư thì có 1,12 lít (đktc) khí H2 thoát ra và kh i ố lư ng ợ bình tăng 4,5 gam. Xác đ nh c ị ông th c ứ cấu t o c ạ a ủ X, Y.
Câu VI (3,5 điểm)
1. Hiđrocacbon mạch hở X ch a ứ 7,69% hiđro về kh i ố lư ng
ợ (74 < MX < 100). X ph n ả ng ứ v i ớ H2
dư có xúc tác Ni, đun nóng thu đư c ợ hiđrocacbon Y. Y ph n ả ng ứ v i ớ Cl2 trong đi u ề ki n ệ chi u ế sáng thu được 4 dẫn xu t ấ monoclo. Z là đ ng ồ phân c a ủ X và Z không làm m t ấ màu nư c ớ brom. Xác đ nh ị công thức cấu tạo c a ủ X, Y, Z. 2. Hòa tan h t ế 10,52 gam h n ỗ h p ợ X g m
ồ Mg, Fe, Fe(NO3)2 bằng dung d c ị h ch a ứ 0,42 mol HCl và a mol NaNO3 thu đư c ợ dung d c ị h Y chỉ ch a ứ 22,12 gam h n ỗ h p ợ mu i ố clorua và 1,34 gam h n ỗ h p ợ Z g m ồ
4 khí không màu (trong đó 3 khí có s ố mol b ng ằ nhau). Dung d c ị h Y ph n ả ng ứ t i ố đa v i ớ 0,41 mol KOH thu đư c ợ 13,6 gam k t ế t a ủ . Tính phần trăm th t ể ích c a ủ khí có phân t kh ử i ố nh nh ỏ t ấ trong Z. -------------- H t ế -------------- Cán b c
ộ oi thi không giải thích gì thêm H t
ọ ên thí sinh: ………………………………….……….. S bá ố
o danh: ……………………………… Ch kí ữ của cán b c ộ oi thi s 1: ố Chữ kí c a ủ cán b c ộ oi thi s 2: ố M i
ọ thắc mắc vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t (c ế ó l i ờ gi i ả ) SỞ GIÁO D C Ụ VÀ ĐÀO T O Ạ KÌ THI CH N Ọ H C Ọ SINH GI I Ỏ THÀNH PHỐ HÀ N I Ộ
LỚP 12 THPT NĂM H C Ọ 2022 - 2023 Môn thi: HÓA H C Ọ
Ngày thi: 28 tháng 9 năm 2022 HƯ N Ớ G DẪN CHẤM Đ C Ề HÍNH TH C Ứ
Câu I (3,0 điểm) 1. Vì sao để d p ậ t t ắ các đám cháy xăng d u ầ nhỏ ngư i ờ ta không đư c ợ dùng nư c ớ nh ng ư có th ể dùng
chăn chiên (loại chăn làm từ s i ợ cotton v i ớ nguyên li u ệ chính là s i ợ bông) th m ấ nư c ớ ?
2. Máu trong cơ thể ngư i ờ có màu đ ỏ vì ch a ứ hemoglobin (là ch t ấ v n ậ chuy n ể oxi ch a ứ s t ắ ). Máu c a ủ một số loài đ ng ộ v t ậ chân kh p ớ và thân m m ề l i ạ có màu xanh vì ch a ứ hemocyanin (là ch t ấ v n ậ chuy n ể oxi ch a ứ kim lo i ạ M). M t n ồ t i ạ trong tự nhiên v i ớ 2 lo i ạ đ ng
ồ vị X và Y trong đó Y chi m ế 27,3% số nguyên t . ử Nguyên tử X có t ng ổ số h t ạ proton, n t
ơ ron, electron là 92 trong đó số h t ạ mang đi n ệ nhi u ề h n ơ s h ố ạt không mang đi n l ệ à 24. S n ố t
ơ ron trong nguyên tử Y nhi u h ề n t ơ rong nguyên t X ử là 2. a) Tính nguyên tử kh i ố trung bình của kim lo i ạ M.
b) Viết cấu hình electron và cho bi t ế v t ị rí c a ủ M trong b ng t ả u n hoà ầ n các nguyên t hóa ố h c ọ . c) Tế bào đ n ơ vị (ô m ng ạ cơ s ) ở c a ủ M có d ng ạ l p ậ phư ng ơ tâm di n. ệ Kh i ố lư ng ợ riêng c a ủ tinh thể
M là 8,92 g/cm3. Tính bán kính nguyên tử M và ph n
ầ trăm thể tích bị chi m ế b i ở các nguyên tử trong ô mạng cơ s . ở 3. Trong công nghi p
ệ cũng như trong phòng thí nghi m ệ , Br2 đ u ề có thể đư c ợ đi u ề chế b ng ằ phư ng ơ pháp dùng Cl2 oxi hóa ion - Br trong dung d c ị h mu i ố . Công nghi p ệ hóa h c ọ đi u ề chế Br2 từ nư c ớ bi n ể (chứa brom ở d ng
ạ NaBr) theo quy trình sau: s c ụ khí Cl2 vào nư c ớ bi n ể đã đư c ợ axit hóa b ng ằ dung d c ị h H2SO4, sau đó ch ng ư cất thu đư c ợ Br2 sạch. a) Viết phư ng ơ trình hóa h c ọ c a ủ ph n ả ng đi ứ u c ề h Br ế 2. b) Nêu vai trò c a ủ H2SO4. c) Br2 l ng ỏ hay h i ơ đ u ề r t ấ đ c ộ . Khi làm thí nghi m ệ , do s ơ su t ấ m t ộ h c ọ sinh làm đ ổ m t ộ lư ng ợ Br2 l ng. ỏ Đ xu ề
ất một hóa chất thông d ng đ ụ x ể l ử ý Br2 bị đ ra ổ , viết phư ng t ơ rình hóa h c ọ giải thích. Đáp án Điể Câu m
- Xăng dầu không tan trong nư c ớ , nh h ẹ n ơ nư c ớ nên nư c ớ làm xăng d u n ầ i ổ lên trên 0,25
khiến đám cháy càng lan r ng. ộ I.1 - Khi chăn thấm nư c ớ , các s i ợ cotton n ra ở , làm kín b m ề t
ặ chăn, giúp cách li đám cháy (0,75) v i ớ ngu n oxi ồ m ở ôi trư ng bê ờ n ngoài. 0,5 - Chăn thấm nư c ớ còn làm gi m ả nhi t ệ đ c ộ a ủ đám cháy (ngu n nhi ồ t ệ ). I.2 a) Tính nguyên tử kh i ố trung bình (1,5) - G i ọ s h ố ạt proton, electron, n t ơ ron trong nguyên t X ử l n l ầ ư t ợ là Z, Z, N (Z, N N*). 0,25 2Z + N = 92 Z = 29 A = 29 + 34 = 63 X - Có: 2Z - N = 24 N = 34
- Nguyên tử Y: A = A + 2 = 65 Y X 63.(100 27,3) 65.27,3 0,25 A 6 3, 546 - Nguyên tử kh i ố trung bình c a ủ M M: 100 .
b) Viết cấu hình electron, xác đ nh v ị ị trí:
- Cấu hình electron: 1s22s22p63s23p63d104s1. 0,25 - V t ị rí: ô s 29; ố chu kì 4; nhóm IB.
c) Tính bán kính nguyên t Cu ử 0,25 - Xét mạng lập phư ng ơ tâm di n: ệ M i
ọ thắc mắc vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t (c ế ó l i ờ gi i ả ) + M t ộ ô mạng c s ơ c
ở ó 4 nguyên t Cu (3 nguyê ử n t n ử ằm t ở âm của 6 m t ặ và 1 nguyên t n ử ằm 8 đ ở nh). ỉ + Đ dà ộ
i cạnh tế bào (a) liên h v ệ i
ớ bán kính nguyên tử (r) c a ủ Cu: (4r)2 = 2a2 a = 2 2 .r - Kh i ố lư ng ợ riêng c a ủ tinh th : ể 4.A 4.A 63,546.4 M M 3 3 N .a 3 0,25 D = N .16 2.r A N .(2 2.r) A = A = 8,92 r = 1,28.10-8 cm - Đ đ ộ ặc khít c a ủ tinh th : ể 4 16 3 V 3 4. . .r . .r 0,25 4 nguyeâ n töû.100% 3 3 .100% V .100% 3 3 1 teá baøo a = (2 2.r) = 74,05% a) Phư ng ơ trình đi u ề ch Br ế 2: 0,25 Cl2 + 2NaBr 2NaCl + Br → 2
b) Vai trò của H2SO4: Tạo môi trư ng ờ axit, h n c ạ h Cl ế 2, Br2 phản ng ứ v i ớ H2O và làm I.3 giảm đ t
ộ an của Cl2, Br2 trong nư c ớ . (0,75) 0,25 Cl2 + H2O HCl + HClO Br2 + H2O HBr + HbrO c) Kh đ ử c ộ Br2: Dùng dung d c
ị h kiềm (NaOH, Ca(OH)2...) 0,25 Br2 + 2NaOH NaBr + NaBrO + H → 2O
Câu II (3,0 điểm)
1. Cân bằng các phư ng ơ trình hóa h c ọ sau b ng ằ phư ng ơ
pháp thăng bằng electron, xác đ nh c ị hất kh và ử chất oxi hóa:
2. Giản đồ hình bên mô tả sự bi n ế đ i ổ độ tan trong nư c ớ của m t ộ s c ố hất theo nhi t ệ đ . ộ a) Ở nhi t ệ độ phòng, ch t ấ nào tan ít nh t ấ , ch t ấ nào tan nhiều nhất? b) Khi nhi t ệ độ tăng, độ tan c a ủ ch t ấ nào gi m ả ? Gi i ả thích. c) Chất nào có đ ộ tan ít ph ụ thu c ộ vào nhi t ệ đ ộ nh t ấ , ch t ấ nào có đ t ộ an thay đ i ổ nhi u nh ề ất theo nhi t ệ đ ? ộ d) Ngư i ờ ta d a
ự vào sự khác nhau về độ tan trong nư c ớ theo nhi t ệ đ c ộ a ủ NaCl và KCl đ t ể ách riêng t ng ừ ch t ấ ra kh i ỏ qu ng xi ặ
nvinit (NaCl.KCl). Nêu cách làm. 3. Dẫn h n ỗ h p ợ khí g m
ồ CO2, C2H4, C2H2 vào dung d c ị h ch a ứ lư ng ợ dư m t ộ ch t ấ tan X th y ấ thoát ra h n ỗ h p ợ khí Y g m ồ hai ch t ấ . Đề xu t ấ hai ch t ấ X (khác lo i ạ ) th a ỏ mãn đi u ề ki n ệ trên và vi t ế phư ng ơ trình hóa h c ọ c a ủ các ph n ả ng x ứ y ra ả . Đáp án Điể Câu m II.1 a) Cu + KNO3 + H2SO4 CuSO4 + NO + K2SO4 + H2O (1,5) → 3x Cu Cu+2 + 2e → 0,25 2x N+5 + 3e N+2 → 3Cu + 2KNO3 + 4H2SO4 3CuSO → 4 + 2NO + K2SO4 + 4H2O Cu: chất kh ;
ử N+5 (trong KNO3): chất oxi hóa 0,25 b) P + NH4ClO4 H → 3PO4 + N2 + Cl2 + H2O 0,25 M i
ọ thắc mắc vui lòng xin liên h h
ệ otline: 084 283 45 85
Đề HSG Hóa 12 Hà Nội năm 2023 có đáp án
4.9 K
2.5 K lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Tài liệu được cập nhật liên tục trong gói này từ nay đến hết tháng 3/2024. Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu Đề HSG Hóa 12 AHà Nội năm 2023 có đáp án.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(4931 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 12
Xem thêmTài liệu bộ mới nhất
Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
S GIÁO D C VÀ ĐÀO T OỞ Ụ Ạ
HÀ N IỘ
KÌ THI CH N H C SINH GI I THÀNH PHỌ Ọ Ỏ Ố
L P 12 THPT NĂMỚ H C 2022 - 2023Ọ
Môn: HÓA H CỌ
Ngày thi: 28 tháng 9 năm 2022
Th i gian làm bài: ờ 180 phút
(Đ thi g m 02 trangề ồ )
Cho bi t nguyên t kh i c a các nguyên tế ử ố ủ ố: H = 1; Li = 7; C = 12; N = 14; O = 16; Na = 23; Mg =
24; S =
32; Cl = 35,5; K
= 39; Ca = 40; Fe = 56; Rb = 85; Ag = 108; Ba = 137. Các ph n ng x y ra hoànả ứ ả
toàn. N
A
= 6,02.10
23
.
Câu I (3,0 đi mể )
1. Vì sao đ d p t t các đám cháy xăng d u nh ng i ta không đ c dùng n c nh ng có th dùngể ậ ắ ầ ỏ ườ ượ ướ ư ể
chăn chiên (lo i chăn làm t s i cotton v i nguyên li u chính là s i bông) th m n c?ạ ừ ợ ớ ệ ợ ấ ướ
2. Máu trong c th ng i có màu đ vì ch a hemoglobin (là ch t v n chuy n oxi ch a s t). Máu c aơ ể ườ ỏ ứ ấ ậ ể ứ ắ ủ
m t s loài đ ng v t chân kh p và thân m m l i có màu xanh vì ch a hemocyanin (là ch t v n chuy nộ ố ộ ậ ớ ề ạ ứ ấ ậ ể
oxi ch a kim lo i M). M t n t i trong t nhiên v i 2 lo i đ ng v X và Y trong đó Y chi m 27,3% sứ ạ ồ ạ ự ớ ạ ồ ị ế ố
nguyên t . Nguyên t X có t ng s h t proton, n tron, electron là 92 trong đó s h t mang đi n nhi uử ử ổ ố ạ ơ ố ạ ệ ề
h n s h t không mang đi n là 24. S n tron trong nguyên t Y nhi u h n trong nguyên t X là 2.ơ ố ạ ệ ố ơ ử ề ơ ử
a) Tính nguyên t kh i trung bình c a kim lo i M.ử ố ủ ạ
b) Vi t c u hình electron và cho bi t v trí c a M trong b ng tu n hoàn các nguyên t hóa h c.ế ấ ế ị ủ ả ầ ố ọ
c) T bào đ n v (ô m ng c s ) c a M có d ng l p ph ng tâm di n. Kh i l ng riêng c a tinh thế ơ ị ạ ơ ở ủ ạ ậ ươ ệ ố ượ ủ ể
M là 8,92 g/cm
3
. Tính bán kính nguyên t M và ph n trăm th tích b chi m b i các nguyên t trong ôử ầ ể ị ế ở ử
m ng c s .ạ ơ ở
3. Trong công nghi p cũng nh trong phòng thí nghi m, Brệ ư ệ
2
có th đ c đi u ch b ng ph ng phápể ượ ề ế ằ ươ
dùng Cl
2
oxi hóa ion
-
Br
trong dung d ch mu i. Công nghi p hóa h c đi u ch Brị ố ệ ọ ề ế
2
t n c bi n (ch aừ ướ ể ứ
brom d ng NaBr) theo quy trình sau: s c khí Clở ạ ụ
2
vào n c bi n đã đ c axit hóa b ng dung d chướ ể ượ ằ ị
H
2
SO
4
, sau đó ch ng c t thu đ c Brư ấ ượ
2
s ch.ạ
a) Vi t ph ng trình hóa h c c a ph n ng đi u ch Brế ươ ọ ủ ả ứ ề ế
2
.
b) Nêu vai trò c a Hủ
2
SO
4
.
c) Br
2
l ng hay h i đ u r t đ c. Khi làm thí nghi m, do s su t m t h c sinh làm đ m t l ng Brỏ ơ ề ấ ộ ệ ơ ấ ộ ọ ổ ộ ượ
2
l ng. Đ xu t m t hóa ch t thông d ng đ x lý Brỏ ề ấ ộ ấ ụ ể ử
2
b đị ổ
ra, vi t ph ng trình hóa h c gi i thích.ế ươ ọ ả
Câu II (3,0 đi mể )
1. Cân b ng các ph ng trình hóa h c sau b ng ph ngằ ươ ọ ằ ươ
pháp thăng b ng electron, xác đ nh ch t kh và ch t oxi hóa:ằ ị ấ ử ấ
2. Gi n đ hình bên mô t s bi n đ i đ tan trong n cả ồ ả ự ế ổ ộ ướ
c a m t s ch t theo nhi t đ .ủ ộ ố ấ ệ ộ
a) nhi t đ phòng, ch t nào tan ít nh t, ch t nào tanỞ ệ ộ ấ ấ ấ
nhi u nh t?ề ấ
b) Khi nhi t đ tăng, đ tan c a ch t nào gi m? Gi iệ ộ ộ ủ ấ ả ả
thích.
c) Ch t nào có đ tan ít ph thu c vào nhi t đ nh t, ch tấ ộ ụ ộ ệ ộ ấ ấ
nào có đ tan thay đ i nhi u nh t theo nhi t đ ?ộ ổ ề ấ ệ ộ
d) Ng i ta d a vào s khác nhau v đ tan trong n c theo nhi t đ c a NaCl và KCl đ tách riêngườ ự ự ề ộ ướ ệ ộ ủ ể
t ng ch t ra kh i qu ng xinvinit (NaCl.KCl). Nêu cách làm.ừ ấ ỏ ặ
3. D n h n h p khí g m COẫ ỗ ợ ồ
2
, C
2
H
4
, C
2
H
2
vào dung d ch ch a l ng d m t ch t tan X th y thoát raị ứ ượ ư ộ ấ ấ
h n h p khí Y g m hai ch t. Đ xu t hai ch t X (khác lo i) th a mãn đi u ki n trên và vi t ph ngỗ ợ ồ ấ ề ấ ấ ạ ỏ ề ệ ế ươ
trình hóa h c c a các ph n ng x y ra.ọ ủ ả ứ ả
Câu III (3,5 đi mể )
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ
Đ CHÍNH TH CỀ Ứ

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
1. Đ xác đ nh s có m t c a ion ể ị ự ặ ủ
2-
3
SO
trong rau qu khô, m t h c sinh ngâm m t ít qu đ u trongả ộ ọ ộ ả ậ
n c. Sau m t th i gian, l c l y dung d ch r i cho tác d ng v i dung d ch Hướ ộ ờ ọ ấ ị ồ ụ ớ ị
2
O
2
, sau đó cho tác d ng ti pụ ế
v i dung d ch BaClớ ị
2
. Vi t ph ng trình ion rút g n c a các ph n ng x y ra.ế ươ ọ ủ ả ứ ả
2. Axit X là ch t r n, trong su t, không màu, d tan trong n c. Khi thêm canxi oxit t i d vào dungấ ắ ố ễ ướ ớ ư
d ch X thì t o thành h p ch t Y màu tr ng, không tan trong n c. Khi nung Y nhi t đ cao v i cát vàị ạ ợ ấ ắ ướ ở ệ ộ ớ
than thì t o thành đ n ch t photpho có trong thành ph n c a X. Trong phòng thí nghi m, có th đi u chạ ơ ấ ầ ủ ệ ể ề ế
X t ph n ng c a photpho v i axit Z. Cho bi t X, Y, Z là nh ng ch t gì? Vi t ph ng trình hóa h c c aừ ả ứ ủ ớ ế ữ ấ ế ươ ọ ủ
các ph n ng x y ra.ả ứ ả
3. Xác đ nh các ch t h u c X, Y, Z, T, M, N, K (có hai ch t thu c lo i anđehit, Mị ấ ữ ơ ấ ộ ạ
Z
+ M
N
= 123) và vi tế
ph ng trình hóa h c th c hi n dãy chuy n hóa sau (ghi rõ đi u ki n, n u có):ươ ọ ự ệ ể ề ệ ế
Câu IV (3,5 đi mể )
1. D n 0,55 mol h n h p X g m h i n c và khí cacbonic qua than nung đ thu đ c a mol h n h pẫ ỗ ợ ồ ơ ướ ỏ ượ ỗ ợ
khí Y g m CO, Hồ
2
, CO
2
(trong Y có b mol CO
2
). H p th h t b mol COấ ụ ế
2
trên b ng dung d ch ch aở ằ ị ứ
h n h p KOH 0,15M và Naỗ ợ
2
CO
3
0,05M thu đ c dung d ch Z. Nh t t toàn b dung d ch Z vào 200ượ ị ỏ ừ ừ ộ ị
ml dung d ch NaHSOị
4
0,5M đ ng th i khu y đ u, sau khi k t thúc ph n ng thu đ c 1,568 lít (đktc)ồ ờ ấ ề ế ả ứ ượ
khí CO
2
và
dung d ch T. Thêm dung d ch Ba(OH)ị ị
2
t i d vào T thì thu đ c 78,46 gam k t t a. Tìm giáớ ư ượ ế ủ
tr c a a và b.ị ủ
2. Cho 0,025 mol h n h p X có kh i l ng 1,11 gam g m hai anđehit đ n ch c tác d ng hoàn toàn v iỗ ợ ố ượ ồ ơ ứ ụ ớ
l ng d dung d ch AgNOượ ư ị
3
trong NH
3
, đun nóng thu đ c 7,56 gam b c. M t khác, m gam X ph n ngượ ạ ặ ả ứ
t i đa v i 2,464 lít (đktc) khí Hố ớ
2
khi có xúc tác Ni, đun nóng. Tìm giá tr c a m và vi t ph ng trình hóaị ủ ế ươ
h c c a các ph n ng x y ra.ọ ủ ả ứ ả
Câu V (3,5 đi mể )
1. Đ xác đ nh công th c c a m t khoáng v t X, ng i ta ti n hành các thí nghi m sau: ể ị ứ ủ ộ ậ ườ ế ệ
- Thí nghi m 1: Cho 4,44 gam X tác d ng v i l ng d dung d ch axit HCl thu đ c 0,5376 lít (đktc)ệ ụ ớ ượ ư ị ượ
khí Y không màu, không mùi, làm đ c n c vôi trong nh ng không làm m t màu n c brom.ụ ướ ư ấ ướ
- Thí nghi m 2: Nung nóng m gam X 200ệ ở
0
C thu đ c ượ
159m
370
gam ch t r n Z (ch ch a m t ch t), h nấ ắ ỉ ứ ộ ấ ỗ
h p g m khí và h i không màu, không mùi. ợ ồ ơ
N u ti p t c nung nóng Z nhi t đ cao h n thì kh i l ngế ế ụ ở ệ ộ ơ ố ượ
v n không đ i. L y 1,325 gam Z cho tác d ng v i l ng d dung d ch axit HCl thu đ c 0,28 lít (đktc) khíẫ ổ ấ ụ ớ ượ ư ị ượ
Y.
Xác đ nh công th c c a X. ị ứ ủ
2. H n h p E g m este X ba ch c và este Y hai ch c (phân t X, Y đ u không ch a nhóm ch c nàoỗ ợ ồ ứ ứ ử ề ứ ứ
khác) có t l mol t ng ng là a : b. Khi t l aỉ ệ ươ ứ ỉ ệ
: b thay đ i, s mol NaOH ph n ng t i đa luôn g p 3ổ ố ả ứ ố ấ
l n s mol E. Trong tr ng h p a : b = 1 : 3, xà phòng hóa hoàn toàn x mol E b ng dung d ch NaOH v aầ ố ườ ợ ằ ị ừ
đ , cô c n dung d ch sau ph n ng thu đ c 19,92 gam mu i và 1,25x mol m t ancol duy nh t. Cho toànủ ạ ị ả ứ ượ ố ộ ấ
b l ng ancol này vào bình đ ng Na d thì có 1,12 lít (đktc) khí Hộ ượ ự ư
2
thoát ra và kh i l ng bình tăng 4,5ố ượ
gam. Xác đ nh công th c c u t o c a X, Y.ị ứ ấ ạ ủ
Câu VI (3,5 đi mể )
1. Hiđrocacbon m ch h X ch a 7,69% hiđro v kh i l ngạ ở ứ ề ố ượ
(74 < M
X
< 100). X ph n ng v i Hả ứ ớ
2
d có xúc tác Ni, đun nóng thu đ c hiđrocacbon Y. Y ph n ng v i Clư ượ ả ứ ớ
2
trong đi u ki n chi u sáng thuề ệ ế
đ c 4 d n xu t monoclo. Z là đ ng phân c a X và Z không làm m t màu n c brom. Xác đ nh côngượ ẫ ấ ồ ủ ấ ướ ị
th c c u t o c a X, Y, Z. ứ ấ ạ ủ
2. Hòa tan h t 10,52 gam h n h p X g m Mg, Fe, Fe(NOế ỗ ợ ồ
3
)
2
b ng dung d ch ch a 0,42 mol HCl và aằ ị ứ
mol NaNO
3
thu đ c dung d ch Y ch ch a 22,12 gam h n h p mu i clorua và 1,34 gam h n h p Z g mượ ị ỉ ứ ỗ ợ ố ỗ ợ ồ
4 khí không màu (trong đó 3 khí có s mol b ng nhau). Dung d ch Y ph n ng t i đa v i 0,41 mol KOHố ằ ị ả ứ ố ớ
thu đ c 13,6 gam k t t a. Tính ph n trăm th tích c a khí có phân t kh i nh nh t trong Z.ượ ế ủ ầ ể ủ ử ố ỏ ấ
-------------- H t --------------ế
Cán b coi thi không gi i thích gì thêmộ ả
H tên thí sinhọ : ………………………………….………..
Ch kí c a cán b coi thi s 1:ữ ủ ộ ố
S báo danh: ……………………………… ố
Ch kí c a cán b coi thi s 2:ữ ủ ộ ố
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
S GIÁO D C VÀ ĐÀO T OỞ Ụ Ạ
HÀ N IỘ
KÌ THI CH N H C SINH GI I THÀNH PHỌ Ọ Ỏ Ố
L P 12 THPT NĂMỚ H C 2022 - 2023Ọ
Môn thi: HÓA H CỌ
Ngày thi: 28 tháng 9 năm 2022
H NG D N CH M Đ CHÍNH TH CƯỚ Ẫ Ấ Ề Ứ
Câu I (3,0 đi mể )
1. Vì sao đ d p t t các đám cháy xăng d u nh ng i ta không đ c dùng n c nh ng có th dùngể ậ ắ ầ ỏ ườ ượ ướ ư ể
chăn chiên (lo i chăn làm t s i cotton v i nguyên li u chính là s i bông) th m n c?ạ ừ ợ ớ ệ ợ ấ ướ
2. Máu trong c th ng i có màu đ vì ch a hemoglobin (là ch t v n chuy n oxi ch a s t). Máu c aơ ể ườ ỏ ứ ấ ậ ể ứ ắ ủ
m t s loài đ ng v t chân kh p và thân m m l i có màu xanh vì ch a hemocyanin (là ch t v n chuy nộ ố ộ ậ ớ ề ạ ứ ấ ậ ể
oxi ch a kim lo i M). M t n t i trong t nhiên v i 2 lo i đ ng v X và Y trong đó Y chi m 27,3% sứ ạ ồ ạ ự ớ ạ ồ ị ế ố
nguyên t . Nguyên t X có t ng s h t proton, n tron, electron là 92 trong đó s h t mang đi n nhi uử ử ổ ố ạ ơ ố ạ ệ ề
h n s h t không mang đi n là 24. S n tron trong nguyên t Y nhi u h n trong nguyên t X là 2.ơ ố ạ ệ ố ơ ử ề ơ ử
a) Tính nguyên t kh i trung bình c a kim lo i M.ử ố ủ ạ
b) Vi t c u hình electron và cho bi t v trí c a M trong b ng tu n hoàn các nguyên t hóa h c.ế ấ ế ị ủ ả ầ ố ọ
c) T bào đ n v (ô m ng c s ) c a M có d ng l p ph ng tâm di n. Kh i l ng riêng c a tinh thế ơ ị ạ ơ ở ủ ạ ậ ươ ệ ố ượ ủ ể
M là 8,92 g/cm
3
. Tính bán kính nguyên t M và ph n trăm th tích b chi m b i các nguyên t trong ôử ầ ể ị ế ở ử
m ng c s .ạ ơ ở
3. Trong công nghi p cũng nh trong phòng thí nghi m, Brệ ư ệ
2
đ u có th đ c đi u ch b ng ph ngề ể ượ ề ế ằ ươ
pháp dùng Cl
2
oxi hóa ion
-
Br
trong dung d ch mu i. Công nghi p hóa h c đi u ch Brị ố ệ ọ ề ế
2
t n c bi nừ ướ ể
(ch a brom d ng NaBr) theo quy trình sau: s c khí Clứ ở ạ ụ
2
vào n c bi n đã đ c axit hóa b ng dung d chướ ể ượ ằ ị
H
2
SO
4
, sau đó ch ng c t thu đ c Brư ấ ượ
2
s ch.ạ
a) Vi t ph ng trình hóa h c c a ph n ng đi u ch Brế ươ ọ ủ ả ứ ề ế
2
.
b) Nêu vai trò c a Hủ
2
SO
4
.
c) Br
2
l ng hay h i đ u r t đ c. Khi làm thí nghi m, do s su t m t h c sinh làm đ m t l ng Brỏ ơ ề ấ ộ ệ ơ ấ ộ ọ ổ ộ ượ
2
l ng. Đ xu t m t hóa ch t thông d ng đ x lý Brỏ ề ấ ộ ấ ụ ể ử
2
b đ ra, vi t ph ng trình hóa h c gi i thích.ị ổ ế ươ ọ ả
Câu
Đáp án Điể
m
I.1
(0,75)
- Xăng d u không tan trong n c, nh h n n c nên n c làm xăng d u n i lên trên ầ ướ ẹ ơ ướ ướ ầ ổ
khi nế đám cháy càng lan r ng. ộ
0,25
- Khi chăn th m n c, các s i cotton n ra, làm kín b m t chăn, giúp cách li đám cháyấ ướ ợ ở ề ặ
v i ngu n oxi môi tr ng bên ngoài. ớ ồ ở ườ
- Chăn th m n c còn làm gi m nhi t đ c a đám cháy (ngu n nhi t). ấ ướ ả ệ ộ ủ ồ ệ
0,5
I.2
(1,5)
a) Tính nguyên t kh i trung bìnhử ố
- G i s h t proton, electron, n tron trong nguyên t X l n l t là Z, Z, N (Z, N ọ ố ạ ơ ử ầ ượ
N*).
- Có:
X
2Z + N = 92 Z = 29
A = 29 + 34 = 63
2Z - N = 24 N = 34
0,25
- Nguyên t Y: ử
Y X
A = A + 2 = 65
- Nguyên t kh i trung bình c a M: ử ố ủ
M
63.(100 27,3) 65.27,3
A 63,546
100
.
0,25
b) Vi t c u hình electron, xác đ nh v trí:ế ấ ị ị
- C u hình electron: 1sấ
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
1
.
- V trí: ô s 29; chu kì 4; nhóm IB.ị ố
0,25
c) Tính bán kính nguyên t Cuử
- Xét m ng l p ph ng tâm di n:ạ ậ ươ ệ
0,25
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ
Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
+ M t ô m ng c s có 4 nguyên t Cu (3 nguyên t n m tâm c a 6 m t và 1ộ ạ ơ ở ử ử ằ ở ủ ặ
nguyên t n m 8 đ nh).ử ằ ở ỉ
+ Đ dài c nh t bào (a) liên h v i bán kính nguyên t (r) c a Cu: (4r)ộ ạ ế ệ ớ ử ủ
2
= 2a
2
a = 2
2
.r
- Kh i l ng riêng c a tinh th : ố ượ ủ ể
D =
M M
3
3
A
A
4.A 4.A
N .a
N .(2 2.r)
=
3
A
63,546.4
N .16 2.r
= 8,92 r = 1,28.10
-8
cm
0,25
- Đ đ c khít c a tinh th : ộ ặ ủ ể
4 nguyeân töû
1 teá baøo
V
.100%
V
3
3
4
4. . .r
3
.100%
a
=
3
3
16
. .r
3
.100%
(2 2.r)
= 74,05%
0,25
I.3
(0,75)
a) Ph ng trình đi u ch Brươ ề ế
2
:
Cl
2
+ 2NaBr
→
2NaCl + Br
2
0,25
b) Vai trò c a Hủ
2
SO
4
: T o môi tr ng axit, h n ch Clạ ườ ạ ế
2
, Br
2
ph n ng v i Hả ứ ớ
2
O và làm
gi m đ tan c a Clả ộ ủ
2,
Br
2
trong n c.ướ
Cl
2
+ H
2
O
HCl + HClO
Br
2
+ H
2
O
HBr + HbrO
0,25
c) Kh đ c Brử ộ
2
: Dùng dung d ch ki m (NaOH, Ca(OH)ị ề
2
...)
Br
2
+ 2NaOH
→
NaBr + NaBrO + H
2
O
0,25
Câu II (3,0 đi mể )
1. Cân b ng các ph ng trình hóa h c sau b ng ph ngằ ươ ọ ằ ươ
pháp thăng b ng electron, xác đ nh ch t kh và ch t oxi hóa:ằ ị ấ ử ấ
2. Gi n đ hình bên mô t s bi n đ i đ tan trong n cả ồ ả ự ế ổ ộ ướ
c a m t s ch t theo nhi t đ .ủ ộ ố ấ ệ ộ
a) nhi t đ phòng, ch t nào tan ít nh t, ch t nào tanỞ ệ ộ ấ ấ ấ
nhi u nh t?ề ấ
b) Khi nhi t đ tăng, đ tan c a ch t nào gi m? Gi iệ ộ ộ ủ ấ ả ả
thích.
c) Ch t nào có đ tan ít ph thu c vào nhi t đ nh t, ch tấ ộ ụ ộ ệ ộ ấ ấ
nào có đ tan thay đ i nhi u nh t theo nhi t đ ?ộ ổ ề ấ ệ ộ
d) Ng i ta d a vào s khác nhau v đ tan trong n cườ ự ự ề ộ ướ
theo nhi t đ c a NaCl và KCl đ tách riêng t ng ch t ra kh i qu ng xinvinit (NaCl.KCl). Nêu cách làm.ệ ộ ủ ể ừ ấ ỏ ặ
3. D n h n h p khí g m COẫ ỗ ợ ồ
2
, C
2
H
4
, C
2
H
2
vào dung d ch ch a l ng d m t ch t tan X th y thoát raị ứ ượ ư ộ ấ ấ
h n h p khí Y g m hai ch t. Đ xu t hai ch t X (khác lo i) th a mãn đi u ki n trên và vi t ph ngỗ ợ ồ ấ ề ấ ấ ạ ỏ ề ệ ế ươ
trình hóa h c c a các ph n ng x y ra.ọ ủ ả ứ ả
Câu
Đáp án Điể
m
II.1
(1,5)
a) Cu + KNO
3
+ H
2
SO
4
→
CuSO
4
+ NO + K
2
SO
4
+ H
2
O
3x Cu
→
Cu
+2
+ 2e
2x N
+5
+ 3e
→
N
+2
3Cu + 2KNO
3
+ 4H
2
SO
4
→
3CuSO
4
+ 2NO + K
2
SO
4
+ 4H
2
O
0,25
Cu: ch t kh ; Nấ ử
+5
(trong KNO
3
): ch t oxi hóaấ 0,25
b) P + NH
4
ClO
4
→
H
3
PO
4
+ N
2
+ Cl
2
+ H
2
O
0,25
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ
Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
8x P
→
P
+5
+ 5e
5x 2N
-3
+ 2Cl
+7
+ 8e
→
N
2
+ Cl
2
8P + 10NH
4
ClO
4
→
8H
3
PO
4
+ 5N
2
+ 5Cl
2
+ 8H
2
O
P và N
-3
(trong NH
4
ClO
4
): ch t kh ; Clấ ử
+7
(trong NH
4
ClO
4
): ch t oxi hóaấ 0,25
c) K
2
SO
3
+ KMnO
4
+ KHSO
4
→
K
2
SO
4
+ MnSO
4
+ H
2
O
5x S
+4
→
S
+6
+ 2e
2x Mn
+7
+ 5e
→
Mn
+2
5K
2
SO
3
+ 2KMnO
4
+ 6KHSO
4
→
9K
2
SO
4
+ 2MnSO
4
+ 3H
2
O
0,25
S
+4
(trong K
2
SO
3
): ch t kh ; Mnấ ử
+7
(trong KMnO
4
): ch t oxi hóa.ấ 0,25
II.2
(1,0)
a) nhi t đ phòng: Ở ệ ộ
- Ch t ít tan nh t là KClOấ ấ
3
.
- Ch t tan nhi u nh t là KI.ấ ề ấ
0,25
b) Khi nhi t đ tăng, đ tan c a NHệ ộ ộ ủ
3
gi m vì:ả NH
3
là ch t khí đi u ki n th ng. ấ ở ề ệ ườ
Khi nhi t đ tăng, đ ng năng c a ch t tan th khí tăng lên, các phân t c a nó có ệ ộ ộ ủ ấ ở ể ử ủ
xu h ng thoát kh i l c hút c a các phân t dung môi và quay tr l i pha khí.ướ ỏ ự ủ ử ở ạ
0,25
c) Ch t có đ tan ít ph thu c vào nhi t đ nh t là NaCl. ấ ộ ụ ộ ệ ộ ấ
Ch t có đ tan thay đ i theo nhi t đ nhi u nh t là KNOấ ộ ổ ệ ộ ề ấ
3
.
0,25
d) Cách tách NaCl và KCl ra kh i qu ng xinvinit:ỏ ặ
- Hòa tan qu ng xinvinit vào dung d ch NaCl nóng, bão hòa: KCl tan, NaCl không tan.ặ ị
- Đ ngu i thu đ c KCl k t tinh.ể ộ ượ ế
- Th c hi n nhi u l n nh v y đ tách riêng NaCl và KCl.ự ệ ề ầ ư ậ ể
0,25
II.3
(0,5)
- X là dung d ch ki m ị ề CO
2
b gi l i. Khí Y thoát ra là Cị ữ ạ
2
H
4
và C
2
H
2
:
CO
2
+ 2NaOH
→
Na
2
CO
3
+ H
2
O
0,25
- X là dung d ch mu i (cacbonat, phenolat, hipoclorit…) ị ố CO
2
b gi l i. Khí Y thoát ị ữ ạ
ra là C
2
H
2
và C
2
H
4
:
CO
2
+ Na
2
CO
3
+ H
2
O
→
2NaHCO
3
0,25
Câu III (3,5 đi mể )
1. Đ xác đ nh s có m t c a ion ể ị ự ặ ủ
2-
3
SO
trong rau qu khô, m t h c sinh ngâm m t ít qu đ u trongả ộ ọ ộ ả ậ
n c. Sau m t th i gian, l c l y dung d ch r i cho tác d ng v i dung d ch Hướ ộ ờ ọ ấ ị ồ ụ ớ ị
2
O
2
, sau đó cho tác d ng ti pụ ế
v i dung d ch BaClớ ị
2
. Vi t ph ng trình ion rút g n c a các ph n ng x y ra.ế ươ ọ ủ ả ứ ả
2. Axit X là ch t r n, trong su t, không màu, d tan trong n c. Khi thêm canxi oxit t i d vào dungấ ắ ố ễ ướ ớ ư
d ch X thì t o thành h p ch t Y màu tr ng, không tan trong n c. Khi nung Y nhi t đ cao v i cát vàị ạ ợ ấ ắ ướ ở ệ ộ ớ
than thì t o thành đ n ch t photpho có trong thành ph n c a X. Trong phòng thí nghi m, có th đi u chạ ơ ấ ầ ủ ệ ể ề ế
X t ph n ng c a photpho v i axit Z. Cho bi t X, Y, Z là nh ng ch t gì? Vi t ph ng trình hóa h c c aừ ả ứ ủ ớ ế ữ ấ ế ươ ọ ủ
các ph n ng x y ra.ả ứ ả
3. Xác đ nh các ch t h u c X, Y, Z, T, M, N, K (có hai ch t thu c lo i anđehit, Mị ấ ữ ơ ấ ộ ạ
Z
+ M
N
= 123) và vi tế
ph ng trình hóa h c th c hi n dãy chuy n hóa sau (ghi rõ đi u ki n, n u có):ươ ọ ự ệ ể ề ệ ế
Câu
Đáp án Điể
m
III.1
(0,5)
2-
3
SO
+ H
2
O
2
→
2-
4
SO
+ H
2
O
2-
4
SO
+ Ba
2+
→
BaSO
4
0,5
III.2
(1,0)
X: H
3
PO
4
; Y: Ca
3
(PO
4
)
2
; Z: HNO
3
đ c.ặ 0,25
2H
3
PO
4
+ 3CaO
→
Ca
3
(PO
4
)
2
+ 3H
2
O
0,75
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ