Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có l i ờ gi i ả ) UBND T NH Ỉ HÒA BÌNH KỲ THI CH N Ọ H C Ọ SINH GI I Ỏ C P Â T N Ỉ H THPT S Ở GIÁO D C Ụ VÀ ĐÀO T O Ạ NĂM H C Ọ 2022 - 2023 MÔN THI: HÓA H C Ọ - B N Ả G A Đ Ề THI CHÍNH TH C Ứ Ngày thi: 15/12/2022 (Đ t ề hi gồm 03 trang) Th i
ơ gian: 180 phut (Không k t ê h i ơ gian phat đ ) ề Cho bi t
ế : (Na=23; Ba=137; Fe=56; Cu=64;Br=80; Cl=35,5; O=16; S=32; P=31; N=14; C=12, H=1) Câu 1 (3,5 điểm)
1.1. Cho ion X2- có cấu hình electron l p ớ ngoài cùng là 3s23p6. a. Vi t ế cấu hình electron c a
ủ nguyên tử X và xác đ nh ị vị trí c a ủ nguyên tố X trong bảng tuần hoàn. b. Vi t ế các phư ng ơ trình hóa h c ọ x y ả ra khi cho H2X (h p ợ ch t ấ c a ủ X v i ớ hiđro) tác d ng ụ v i ớ các dung d c
ị h sau: NaOH, Pb(NO3)2, FeCl3.
1.2. Hoàn thành các phư ng ơ trình hóa h c ọ sau (d ng ạ phư ng ơ trình phân t ử và ion thu g n) ọ :
a. Dung dịch Ba(HCO3)2 + dung dịch NaOH. b. Dung d c
ị h NaHCO3 + dung dịch HNO3. c. Dung d c ị h HCl + dung dịch NaF. d. Dung d c ị h HCl + AgNO3.
1.3. Cân bằng các phư ng ơ trình hóa h c ọ sau phư ng ơ pháp thăng b ng ằ electron
a. Al + HNO3 → Al(NO3)3 + N2 + H2O.
b. FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + K2SO4 + MnSO4 + H2O. Câu 2 (4,5 điểm) 2.1. Cho s ơ đồ các ph n ả ng ứ sau: Ñieän phaân dung dòch
X H O X X H (1) 1 2 Coù maøng ngaên 2 3 2
(2) X X CaCO Na CO H O 2 4 3 2 3 2 0 t thöôø ng X X X X H O (3) 2 3 1 5 2
(4) X X CaSO Na SO CO H O 4 6 4 2 4 2 2 Xác đ nh ị các ch t
ấ X1, X2, X3, X4, X5, X6 th a ỏ mãn s ơ đ ồ trên và vi t ế các phư ng ơ trình hóa h c ọ của các ph n ả ng ứ theo s ơ đ ồ trên. 2.2. Th c ự nghi m ệ cho bi t ế năng lư n ợ g liên k t ế , kí hi u ệ là E, (theo kJ.mol-1) c a ủ m t ộ s ố liên k t ế nh ư sau: Liên k t ế O-H (ancol) C=O (R-CHO) C-H (ankan) C-C (ankan) E 437,6 705,2 412,6 331,5 Liên k t ế C-O (ancol) C-C (R-CHO) C-H (R-CHO) H-H E 332,8 350,3 415,5 430,5 M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có l i ờ gi i ả ) a. Tính nhi t ệ phản ng ứ (H0pư) c a ủ phư ng ơ trình hóa h c ọ sau: CH 3CH2CHO + H2 CH3CH2CH2OH (1)
b. H0pư tính đư c
ợ ở trên liên hệ như thế nào v i ớ độ b n ề c a ủ liên k t ế hóa h c ọ trong chất tham gia và s n ả ph m ẩ c a ủ ph n ả ng ứ (1). 2 2.3. Tính n n ồ g đ ộ c a ủ các ion H HCO C 3 O 3O+, 3 và trong dung d c ị h H2CO3 0,50 M. Cho bi t ế : K K
1(H2CO3 ) = 4,2 107 ; 2(H2C 3 O ) = 4,8 1011 Câu 3 (4,0 điểm)
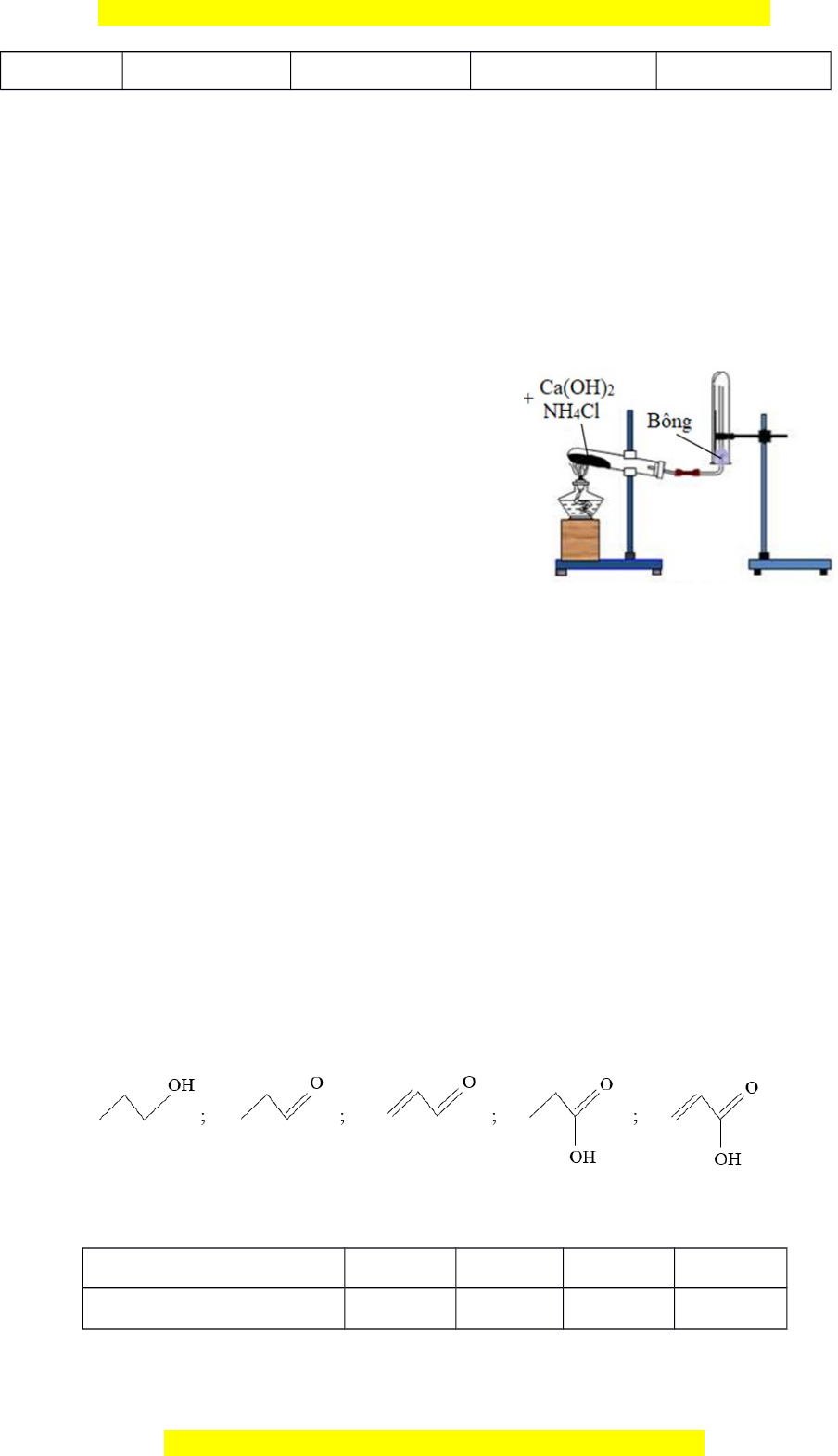
3.1. Thí nghiệm điều chế khí NH3 được mô
tả như hình bên (Hình 01).
+ Viết phương trình hóa học của phản ứng điều chế NH3.
+ Giải thích tại sao người ta dùng Ca(OH)2 và
NH4Cl ở thể rắn mà không phải ở dạng dung dịch?
+ Tại sao ống nghệm chứa hỗn hợp phản ứng
được lắp miệng hơi dốc xuống?
+ Ở miệng ống nghiệm thu NH3 được nút bằng Hình 01
bông tẩm dung dịch chất X. Xác định chất X và cho
biết vai trò của bông tẩm tẩm chất X. 3.2. Chia hỗn h p ợ X g m
ồ Fe, Fe3O4, Fe(OH)3 và FeCO3 thành hai ph n ầ b ng ằ nhau. Hòa tan hoàn toàn m t ộ ph n ầ trong dung d c ị h HCl d , ư thu đư c ợ 0,1 mol h n ỗ h p ợ hai khí có tỉ kh i ố so v i ớ H2 bằng 9,4 và dung d c ị h Y. Cho ph n ầ hai tác d ng ụ v i ớ lư ng ợ dư dung d c
ị h H2SO4 đặc, nóng. Sau khi các phản ng ứ x y ả ra hoàn toàn, thu đư c ợ dung dịch Z và 0,2075 mol h n ỗ h p ợ khí T g m ồ CO +6 2 và SO2 (sản phẩm kh ử duy nh t ấ c a ủ S ). Tính khối lư ng ợ của FeCl2 có trong dung d c ị h Y. 3.3. Cho 1,72 gam h n ỗ h p ợ X g m ồ C, S, P tác d ng ụ v i ớ lư ng ợ d ư 20 gam dung
dịch H2SO4 98%, đun nóng, thu đư c ợ 4,48 lít h n ỗ h p ợ khí Y ở (đktc) và dung d c ị h Z. Y phản ứng v a ừ đủ dung d c ị h ch a
ứ 28 gam Br2. Cho Z tác d ng ụ v i ớ dung d c ị h NaOH dư thu đư c ợ m gam mu i. ố Tính giá tr ịc a ủ m. Câu 4 (4,0 điểm) 4.1. Bằng phư ng ơ pháp hóa h c ọ nh n ậ bi t ế các ch t ấ sau:
4.2. Cho X, Y, Z, T là các ch t
ấ khác nhau trong các ch t: ấ C6H5NH2 (anilin),
C2H5NH2, NH3, C2H5OH và tính ch t ấ đư c ợ ghi trong b ng ả sau: Chất X Y Z T Ch n ọ Nhi t ệ độ sôi (°C) 184,1 78,3 16,6 33, 4 các
chất X, Y, Z, T sao cho phù h p ợ v i ớ các ch t ấ trên? Gi i ả thích? M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có l i ờ gi i ả ) 4.3. Xem xét h p ợ ch t ấ h u ữ c ơ dư i ớ đây: a. Xác đ nh ị công th c ứ phân t ử c a ủ h p ợ chất trên. b. H p ợ ch t ấ h u ữ cơ trên có bao nhiêu đồng phân quang h c ọ . Bi u ể di n ễ theo công th c ứ Fisher c a ủ t ng ừ đ ng ồ phân trên. c. Chỉ ra các lo i ạ liên k t ế hiđro n i
ộ phân tử có thể có c a ủ h p ợ ch t ấ trên, đ ng ồ th i ờ chỉ ra liên k t ế b n ề nh t, ấ kém b n ề nh t. ấ Câu 5 (4,0 đi m ể ): 5.1. H p ợ ch t ấ h u ữ c ơ A có công th c ứ phân t ử là C3H6O2, trong phân t ử A không có liên k t
ế pi nào. Ngoài ra, 1 mol A có th ể phản ng ứ đư c ợ v i ớ 2 mol kim lo i ạ Na. a. Tìm công th c ứ c u ấ t o ạ c a ủ A. b. Ve các đ ng ồ phân hình h c ọ c a ủ A. c. Trong các đ ng ồ phân trên, đ ng ồ phân nào c a ủ A có momen lư ng ơ c c ự l n ớ h n?
ơ Đồng phân nào có nhi t ệ đ ộ sôi cao h n? ơ Gi i ả thích? 5.2. M t ộ bình kín chỉ ch a ứ các ch t
ấ sau: vinylaxetilen (20,8 gam), axetilen (13,0 gam), hidro (1,3 gam) và m t ộ ít b t
ộ niken. Nung nóng bình m t ộ th i ờ gian, thu đư c ợ h n ỗ h p
ợ khí X có tỉ kh i ố so v i
ớ H2 bằng 19,5. Khí X phản ng ứ v a ừ đủ v i ớ 0,7 mol AgNO3 trong dung d c ị h NH3, thu đư c ợ m gam k t ế t a ủ và 10,08 lít h n ỗ h p
ợ khí Y (ở đktc). Khí Y phản ng ứ tối đa v i
ớ 88,0 gam Br2 trong dung dịch. Tính giá tr ịc a ủ m. 5.3. Hỗn h p ợ E g m ồ ba este X, Y, Z đ u ề đa ch c ứ , no, m c
ạ h hở (MXĐốt cháy hoàn toàn 6,84 gam E c n ầ v a
ừ đủ 9,408 gam O2, thu đư c ợ 4,104 gam H2O. M t
ặ khác, đun nóng 6,84 gam E v i ớ dung d c ị h NaOH (v a ừ đ ) ủ , cô c n ạ dung d c ị h sau phản ứng, thu đư c ợ m t ộ mu i ố T (có m c
ạ h cacbon không phân nhánh) và h n ỗ h p ợ hai ancol (đ n ơ ch c ứ , kế ti p ế trong dãy đ ng ồ đ ng) ẳ
. Đốt cháy hoàn toàn T, thu đư c ợ
Na2CO3, CO2 và 0,864 gam H2O. Tìm công th c ứ c u ấ tạo các ch t ấ X, Y, Z. ------------------------H T Ế ------------------------- Thí sinh không đư c ợ s ử d n ụ g b t ấ kì tài ti u ệ nào, cán b ộ coi thi không gi i ả thích gì thêm. H
ọ tên thí sinh:…..…………………………………………
Số báo danh:…………............ Phòng thi:…………………… M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có l i ờ gi i ả ) UBND T NH Ỉ HÒA BÌNH HƯ NG Ớ D N Ẫ CH M Â SỞ GIÁO D C Ụ VÀ ĐÀO Đ Ề THI CH N Ọ H C Ọ SINH GI I Ỏ C P Â T N Ỉ H B N Ả G A TẠO NĂM H C Ọ 2022 - 2023 MÔN THI: HÓA H C Ọ HƯ NG Ớ DẪN CH M Â Ngày thi: 15/12/2022 Đ Ề CHÍNH TH C Ứ (Hư ng ớ
dẫn chấm gồm có 08 trang) Câu 1 (3,5 điểm)
1.1. Cho ion X2- có cấu hình electron l p ớ ngoài cùng là 3s23p6. a. Vi t ế cấu hình electron c a
ủ nguyên tử X và xác đ nh ị vị trí c a ủ nguyên tố X trong bảng tuần hoàn. b. Vi t ế các phư ng ơ trình hóa h c ọ x y ả ra khi cho H2X (h p ợ ch t ấ c a ủ X v i ớ hiđro) tác d ng ụ v i ớ các dung d c
ị h sau: NaOH, Pb(NO3)2, FeCl3.
1.2. Hoàn thành các phư n ơ g trình hóa h c ọ sau (d n ạ g phư n ơ g trình phân t ử và ion thu g n ọ ):
a. Dung dịch Ba(HCO3)2 + dung dịch NaOH. b. Dung d c
ị h NaHCO3 + dung dịch HNO3. c. Dung d c ị h HCl + dung dịch NaF. d. Dung d c ị h HCl + AgNO3.
1.3. Cân bằng các phư ng ơ trình hóa h c ọ sau phư ng ơ pháp thăng b ng ằ electron
a. Al + HNO3 → Al(NO3)3 + N2 + H2O.
b. FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + K2SO4 + MnSO4 + H2O. Câu 1 Biểu Hướng d n ẫ ch m ấ (3,5đ) điểm a) Cấu hình e c a ủ X:1s22s22p63s23p4 Vị trí c a
ủ X: Chu kì 3, nhóm VIA, ô s ố 16 0,5
b) Tổng 0,25x4 = 1,0 đi m ể 1.1 H p ợ chất khí v i ớ hiđro là: H ể (1,5) 2S (0,25 đi m)
H2S + NaOH → NaHS + H2O (H2S + 2NaOH → Na2S + 2H2O) 1,0 H2S + Pb(NO3)2 → PbS + 2HNO3
H2S + 2FeCl3 → 2FeCl2 + 2HCl + S 1.2
a) Ca(HCO3)2 + 2NaOH → CaCO3 + Na2CO3 + H2O (1,0)
(Hoặc Ca(HCO3)2 + NaOH → CaCO3 + NaHCO3 + H2O) 0,25
Ca2+ + HCO -3 + OH- → CaCO3 + H2O
b) NaHCO3 + HNO3 → NaNO3 + CO2 + H2O M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đề HSG Hóa 12 Hòa Bình năm 2023 có đáp án
1.1 K
555 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Tài liệu được cập nhật liên tục trong gói này từ nay đến hết tháng 3/2024. Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu Đề HSG Hóa 12 Hòa Bình năm 2023 có đáp án.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(1109 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 12
Xem thêmTài liệu bộ mới nhất

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
UBND T NH HÒA BÌNH
S GIÁO D C VÀ ĐÀO T OỞ Ụ Ạ
Đ THI CHÍNH TH CỀ Ứ
ề ồ
KỲ THI CH N HỌ C SINH GI I Ọ Ỏ C P T NH THPT Â Ỉ
NĂM H C 2022 - 2023Ọ
MÔN THI: HÓA H C - Ọ B NG AẢ
Ngày thi: 15/12/2022
ơ ê ơ ề
Cho bi t: !"#$%#& $'"(")#* +
&$(,
Câu 1 (3,5 đi m)ể
1.1. Cho ion X
2-
có c u hình electron l p ngoài cùng là 3s
2
3p
6
.
a. Vi t c u hình electron c a nguyên t X và xác đ nh v trí c a nguyên t X
trong b ng tu n hoàn.
b. Vi t các ph ng trình hóa h c x y ra khi cho H
2
X (h p ch t c a X v i hiđro)
tác d ng v i các dung d ch sau: NaOH, Pb (NO
3
)
2
, FeCl
3
.
1.2. Hoàn thành các ph ng trình hóa h c sau (d ng ph ng trình phân t và ion
thu g n):
a. Dung d ch Ba(HCO
3
)
2
+ dung d ch NaOH.
b. Dung d ch Na HCO
3
+ dung d ch HNO
3
.
c. Dung d ch HCl + dung d ch NaF.
d. Dung d ch HCl + AgNO
3
.
1.3. Cân b ng các ph ng trình hóa h c sau ph ng pháp thăng b ng electron
a. Al + HNO
3
→ Al(NO
3
)
3
+ N
2
+ H
2
O.
b. FeSO
4
+ KMnO
4
+ H
2
SO
4
→ Fe
2
(SO
4
)
3
+ K
2
SO
4
+ MnSO
4
+ H
2
O.
Câu 2 (4,5 đi m)ể
2.1. Cho s đ các ph n ng sau:
(1)
1 2 2 3 2
Ñieän phaân dung dòch
Coù maøng ngaên
X H O X X H
(2)
2 4 3 2 3 2
X X CaCO Na CO H O
(3)
0
2 3 1 5 2
t thöôøng
X O X X X H
(4)
4 6 4 2 4 2 2
X X CaSO Na SO CO H O
Xác đ nh các ch t X
1
, X
2
, X
3
, X
4
, X
5
, X
6
th a mãn s đ trên và vi t các ph ng
trình hóa h c c a các ph n ng theo s đ trên.
2.2. Th c nghi m cho bi t năng l ng liên k t, kí hi u là E, (theo kJ.mol
-1
) c a
m t s liên k t nh sau:
Liên k t O-H (ancol) C=O (R-CHO) C-H (ankan) C-C (ankan)
E 437,6 705,2 412,6 331,5
Liên k t C-O (ancol) C-C (R-CHO) C-H (R-CHO) H-H
E 332,8 350,3 415,5 430,5
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ
Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
a. Tính nhi t ph n ng ( H
0
p
) c a ph ng trình hóa h c sau:
CH
3
CH
2
CHO
+ H
2
CH
3
CH
2
CH
2
OH
(1)
b. H
0
p
tính đ c trên liên h nh th nào v i đ b n c a liên k t hóa h c
trong ch t tham gia và s n ph m c a ph n ng (1).
2.3. Tính n ng đ c a các ion H
3
O
+
,
3
HCO
và
2
3
CO
trong dung d ch H
2
CO
3
0,50 M.
Cho bi t :
2 3
1(H CO )
K
= 4,2 10
7
;
2 3
2(H CO )
K
= 4,8 10
11
Câu 3 (4,0 đi m)ể
3.1. Thí nghiệm điều chế khí NH3 được mô
tả như hình bên (
Hình 01)
.
+ Viết phương trình hóa học của phản ứng điều chế
NH3.
+ Giải thích tại sao người ta dùng Ca(OH)2 và
NH4Cl ở thể rắn mà không phải ở dạng dung dịch?
+ Tại sao ống nghệm chứa hỗn hợp phản ứng
được lắp miệng hơi dốc xuống?
+ Ở miệng ống nghiệm thu NH3 được nút bằng
bông tẩm dung dịch chất X. Xác định chất X
và cho
biết vai trò của bông tẩm tẩm chất X.
Hình 01
3.2. Chia h n h p X g m Fe, Fe
3
O
4
, Fe(OH)
3
và FeCO
3
thành hai ph n b ng
nhau. Hòa tan hoàn toàn m t ph n trong dung d ch HCl d , thu đ c 0,1 mol h n h p
hai khí có t kh i so v i H
2
b ng 9,4 và dung d ch Y. Cho ph n hai tác d ng v i l ng
d dung d ch H
2
SO
4
đ c, nóng. Sau khi các
ph n ng x y ra hoàn toàn, thu đ c dung
d ch Z và 0,2075 mol h n h p khí T g m CO
2
và SO
2
(s n
ph m kh duy nh t c a S
+6
).
Tính kh i l ng c a FeCl
2
có trong dung d ch Y.
3.3. Cho 1,72 gam h n h p X g m C, S, P tác d ng v i l ng d 20 gam dung
d ch H
2
SO
4
98%, đun nóng, thu đ c 4,48 lít h n h p khí Y (đktc) và dung d ch Z. Y
ph n ng v a đ dung d ch ch a 28 gam Br
2
. Cho Z tác d ng v i dung d ch NaOH d
thu đ c m gam mu i. Tính giá tr c a m.
Câu 4 (4,0 đi m)ể
4.1. B ng ph ng pháp hóa h c nh n bi t các ch t sau:
4.2. Cho X, Y, Z, T là các ch t khác nhau trong các ch t: C
6
H
5
NH
2
(anilin),
C
2
H
5
NH
2
, NH
3
, C
2
H
5
OH và tính ch t đ c ghi trong b ng sau:
Ch n các
ch t X, Y, Z, T sao cho phù h p v i các ch t trên? Gi i thích?
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ
Ch t X Y Z T
Nhi t đ sôi (°C) 184,1 78,3 16,6
33, 4

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
4.3. Xem xét h p ch t h u c d i đây:
a. Xác đ nh công th c phân t c a h p ch t trên.
b. H p ch t h u c trên có bao nhiêu đ ng phân quang h c.
Bi u di n theo công th c Fisher c a t ng đ ng phân trên.! "
c. Ch ra các lo i liên k t hiđro n i phân t có th có c a h p ch t trên, đ ng !
th i ch ra liên k t b n nh t, kém b n nh t.#
Câu 5 (4,0 đi m):ể
5.1. H p ch t h u c A có công th c phân t là C
3
H
6
O
2
, trong phân t A không
có liên k t pi nào. Ngoài ra, 1 mol A có th ph n ng đ c v i 2 mol kim lo i Na.!
a. Tìm công th c c u t o c a A.
b. V các đ ng phân hình h c c a $ A.
c. Trong các đ ng phân trên, đ ng phân nào c a A có momen l ng c c l n%
h n? Đ ng phân nào có nhi t đ sôi cao h n? Gi i thích?
5.2. M t bình kín ch ch a các ch t sau: vinylaxetilen (20,8 gam), axetilen (13,0
gam), hidro (1,3 gam) và m t ít b t niken. Nung nóng bình m t th i gian, thu đ c h n #
h p khí X có t kh i so v i H
2
b ng 19,5. Khí X ph n ng v a đ v i 0,7 mol AgNO
3
trong dung d ch NH
3
, thu đ c m gam k t t a và 10,08 lít h n h p khí Y ( đktc). Khí
Y ph n ng t i đa v i 88,0 gam Br
2
trong dung d ch. Tính giá tr c a m.
5.3. H n h p E g m ba este X, Y, Z đ u đa ch c, no, m ch h (M
X
<M
Y
<M
Z
).
Đ t cháy hoàn toàn 6,84 gam E c n v a đ 9,408 gam O
2
, thu đ c 4,104 gam H
2
O.
M t khác, đun nóng 6,84 gam E v i dung d ch NaOH (v a đ ), cô c n dung d ch sau
ph n ng, thu đ c m t mu i T (có m ch cacbon không phân nhánh) và h n h p hai
ancol (đ n ch c, k ti p trong dãy đ ng đ ng). & Đ t cháy hoàn toàn T, thu đ c
Na
2
CO
3
, CO
2
và 0,864 gam H
2
O. Tìm công th c c u t o các ch t X, Y, Z.
------------------------H T-------------------------'
Thí sinh không đ c s d ng b t kì tài ti u nào, cán b coi thi không gi i thích gì thêm.
H tên thí sinh:…..…………………………………………
S báo danh:…………............ Phòng thi:……………………
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
UBND T NH HÒA BÌNH
S GIÁO D C VÀ ĐÀOỞ Ụ
T OẠ
H NG D N CH MƯỚ Ẫ Â
Đ CHÍNH TH CỀ Ứ
H NG D N CH MƯỚ Ẫ Â
Đ THI CH N HỀ Ọ C SINH GI IỌ Ỏ C P T NH B NG AÂ Ỉ Ả
NĂM H C 2022 - 2023Ọ
MÔN THI: HÓA H CỌ
Ngày thi: 15/12/2022
, - . ./ướ ẫ ấ ồ
Câu 1 (3,5 đi m)ể
1.1. Cho ion X
2-
có c u hình electron l p ngoài cùng là 3s
2
3p
6
.
a. Vi t c u hình electron c a nguyên t X và xác đ nh v trí c a nguyên t X
trong b ng tu n hoàn.
b. Vi t các ph ng trình hóa h c x y ra khi cho H
2
X (h p ch t c a X v i hiđro)
tác d ng v i các dung d ch sau: NaOH, Pb (NO
3
)
2
, FeCl
3
.
1.2. Hoàn thành các ph ng trình hóa h c sau (d ng ph ng trình phân t và ion thu
g n):
a. Dung d ch Ba(HCO
3
)
2
+ dung d ch NaOH.
b. Dung d ch Na HCO
3
+ dung d ch HNO
3
.
c. Dung d ch HCl + dung d ch NaF.
d. Dung d ch HCl + AgNO
3
.
1.3. Cân b ng các ph ng trình hóa h c sau ph ng pháp thăng b ng electron
a. Al + HNO
3
→ Al(NO
3
)
3
+ N
2
+ H
2
O.
b. FeSO
4
+ KMnO
4
+ H
2
SO
4
→ Fe
2
(SO
4
)
3
+ K
2
SO
4
+ MnSO
4
+ H
2
O.
Câu 1
(3,5đ)
H ng d n ch mướ ẫ ấ
Bi uể
đi mể
1.1
(1,5)
a) C u hình e c a X:1s
2
2s
2
2p
6
3s
2
3p
4
V trí c a X: Chu kì 3, nhóm VIA, ô s 16 0,5
b) T ng ổ 0,25x4 = 1,0 đi mể
H p ch t khí v i hiđro là: H
2
S (0,25 đi m)ể
H
2
S + NaOH
→ NaHS + H
2
O (H
2
S + 2NaOH
→ Na
2
S + 2H
2
O)
H
2
S + Pb(NO
3
)
2
→ PbS + 2HNO
3
H
2
S + 2FeCl
3
→ 2FeCl
2
+ 2HCl + S
1,0
1.2
(1,0)
a) Ca(HCO
3
)
2
+ 2NaOH → CaCO
3
+ Na
2
CO
3
+ H
2
O
(Ho c Ca(HCO
3
)
2
+ NaOH → CaCO
3
+ NaHCO
3
+ H
2
O)
Ca
2+
+ HCO
3
-
+ OH
-
→ CaCO
3
+ H
2
O
0,25
b) NaHCO
3
+ HNO
3
→ NaNO
3
+ CO
2
+ H
2
O
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ
Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
HCO
3
-
+ H
+
→ CO
2
+ H
2
O 0,25
c) HCl + NaF → NaCl + HF
H
+
+ F
-
→ HF 0,25
d) HCl + AgNO
3
→ AgCl + HNO
3
Ag
+
+ Cl
-
→ AgCl 0,25
1.3
(1,0)
a) 10Al + 36HNO
3
→ 10Al(NO
3
)
3
+ 3N
2
+ 18H
2
O 0,5
b) 10FeSO
4
+2KMnO
4
+8H
2
SO
4
→ 5Fe
2
(SO
4
)
3
+ K
2
SO
4
+2MnSO
4
+ 8H
2
O 0,5
Câu 2 (4,5 đi m)ể
2.1. Cho s đ các ph n ng sau:
(1)
1 2 2 3 2
Ñieän phaân dung dòch
Coù maøng ngaên
X H O X X H
(2)
2 4 3 2 3 2
X X CaCO Na CO H O
(3)
0
2 3 1 5 2
t thöôøng
X O X X X H
(4)
4 6 4 2 4 2 2
X X CaSO Na SO CO H O
Xác đ nh các ch t X
1
, X
2
, X
3
, X
4
, X
5
, X
6
th a mãn s đ trên và vi t các ph ng trình
hóa h c c a các ph n ng theo s đ trên.
2.2. Th c nghi m cho bi t năng l ng liên k t, kí hi u là E, (theo kJ.mol
-1
) c a
m t s liên k t nh sau:
Liên k t O-H (ancol) C=O (R-CHO) C-H (ankan) C-C (ankan)
E 437,6 705,2 412,6 331,5
Liên k t C-O (ancol) C-C (R-CHO) C-H (R-CHO) H-H
E 332,8 350,3 415,5 430,5
a. Tính nhi t ph n ng ( H
0
p
) c a ph ng trình hóa h c sau:
CH
3
CH
2
CHO
+ H
2
CH
3
CH
2
CH
2
OH
(1)
b. H
0
p
tính đ c trên liên h nh th nào v i đ b n c a liên k t hóa h c
trong ch t tham gia và s n ph m c a ph n ng (1).
2.3. Tính n ng đ c a các ion H
3
O
+
,
3
HCO
và
2
3
CO
trong dung d ch H
2
CO
3
0,50 M.
Cho bi t :
2 3
1(H CO )
K
= 4,2 10
7
;
2 3
2(H CO )
K
= 4,8 10
11
Câu 2
(4,5đ)
H ng d n ch mướ ẫ ấ
Bi uể
đi mể
2.1
(1,5)
Tìm đ c ch t : 0,5 đi mượ ấ ể
Hoàn thành 4pt: 1,0 đi mể
X
1
: NaCl X
2
: NaOH X
3
: Cl
2
X
4
: Ca(HCO
3
)
2
X
5
: NaClO X
6
: NaHSO
4
0,5
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ