KHUNG MA TRẬN, ĐẶC TẢ VÀ ĐỀ KIỂM TRA CUỐI HỌC KÌ I
MÔN: HÓA HỌC, LỚP 11
Bộ sách: Kết nối tri thức với cuộc sống I. KHUNG MA TRẬN
- Thời điểm kiểm tra: Kiểm tra cuối học kì 1 khi kết thúc nội dung: Cấu tạo hoá
học hợp chất hữu cơ.
- Thời gian làm bài: 45 phút.
- Hình thức kiểm tra: Kết hợp giữa trắc nghiệm và tự luận (tỉ lệ 70% trắc nghiệm, 30% tự luận). - Cấu trúc:
+ Mức độ đề: 40% Nhận biết; 30% Thông hiểu; 20% Vận dụng; 10% Vận dụng cao.
+ Phần trắc nghiệm (7,0 điểm): 28 câu, mỗi câu 0,25 điểm.
(16 câu ở mức độ nhận biết × 0,75 phút/câu = 12 phút; 12 câu ở mức độ thông hiểu ×
1 phút/câu = 12 phút; tổng thời gian làm phần trắc nghiệm khoảng 24 phút).
+ Phần tự luận: 3,0 điểm (Vận dụng: 02 câu, 2,0 điểm; Vận dụng cao: 1-2 câu, 1,0 điểm).
+ Nội dung nửa đầu học kì 1: khoảng 30% (3,0 điểm)
+ Nội dung nửa học kì sau: khoảng 70% (7,0 điểm).
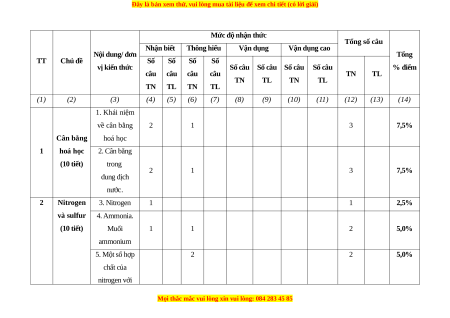
Mức độ nhận thức Tổng số câu Nhận biết Thông hiểu Vận dụng Vận dụng cao Nội dung/ đơn Tổng TT Chủ đề Số Số Số Số vị kiến thức
Số câu Số câu Số câu Số câu % điểm câu câu câu câu TN TL TN TL TN TL TN TL TN TL (1) (2) (3) (4) (5) (6) (7) (8) (9) (10) (11) (12) (13) (14) 1. Khái niệm về cân bằng 2 1 3 7,5% Cân bằng hoá học 1 hoá học 2. Cân bằng (10 tiết) trong 2 1 3 7,5% dung dịch nước. 2 Nitrogen 3. Nitrogen 1 1 2,5% và sulfur 4. Ammonia. (10 tiết) Muối 1 1 2 5,0% ammonium 5. Một số hợp 2 2 5,0% chất của nitrogen với
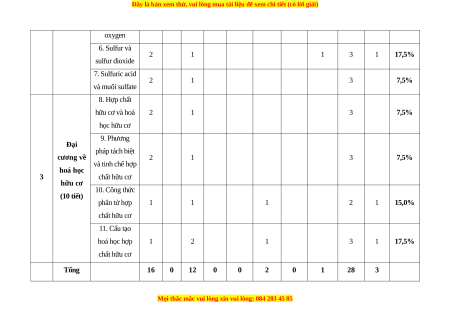
oxygen 6. Sulfur và 2 1 1 3 1 17,5% sulfur dioxide 7. Sulfuric acid 2 1 3 7,5% và muối sulfate 8. Hợp chất hữu cơ và hoá 2 1 3 7,5% học hữu cơ 9. Phương Đại pháp tách biệt cương về 2 1 3 7,5% và tinh chế hợp hoá học 3 chất hữu cơ hữu cơ 10. Công thức (10 tiết) phân tử hợp 1 1 1 2 1 15,0% chất hữu cơ 11. Cấu tạo hoá học hợp 1 2 1 3 1 17,5% chất hữu cơ Tổng 16 0 12 0 0 2 0 1 28 3
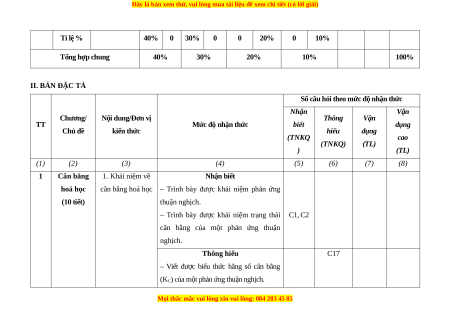
Tỉ lệ % 40% 0 30% 0 0 20% 0 10% Tổng hợp chung 40% 30% 20% 10% 100% II. BẢN ĐẶC TẢ
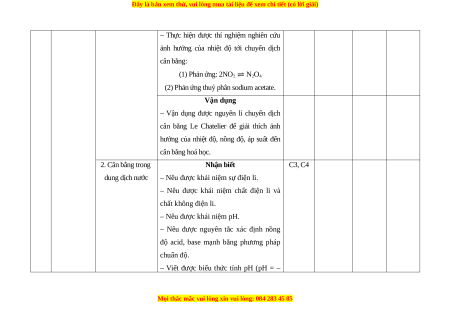
Số câu hỏi theo mức độ nhận thức Nhận Vận Chương/ Nội dung/Đơn vị Thông Vận TT
Mức độ nhận thức biết dụng Chủ đề kiến thức hiểu dụng (TNKQ cao (TNKQ) (TL) ) (TL) (1) (2) (3) (4) (5) (6) (7) (8) 1 Cân bằng 1. Khái niệm về Nhận biết hoá học
cân bằng hoá học – Trình bày được khái niệm phản ứng (10 tiết) thuận nghịch.
– Trình bày được khái niệm trạng thái C1, C2
cân bằng của một phản ứng thuận nghịch. Thông hiểu C17
– Viết được biểu thức hằng số cân bằng
(KC) của một phản ứng thuận nghịch.
Đề thi cuối kì 1 Hóa Học 11 Kết nối tri thức - Đề 1
1 K
514 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu bộ 3 đề cuối kì 1 gồm đầy đủ ma trận và lời giải chi tiết môn Hóa học 11 Kết nối tri thức mới nhất năm 2023 - 2024 nhằm giúp Giáo viên có thêm tài liệu tham khảo ra đề thi Hóa học lớp 11.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(1028 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 11
Xem thêmTài liệu bộ mới nhất

!"#$%&'()#*+',-./ 01%'(&+"20!3+ 40
%5#6!7&!3+89:;;
<=>?6 @ABC=>@
0D !"#$%&'()#
E'FA6Kiểm tra cuối học kì 1 khi kết thúc nội dung: +GHII?
JKLGMND
E'6 45 phút.
E!OBFA6Kết hợp giữa trắc nghiệm và tự luận (tỉ lệ 70% trắc nghiệm,
30% tự luận).
E+GAP6
40% Nhận biết; 30% Thông hiểu; 20% Vận dụng; 10% Vận dụng cao.
QR
!"#$%&'()*+!(),!#-'
!()*+!(),./012(3456()
71$8 (Vận dụng: 02 câu, 2,0 điểm; Vận dụng cao: 1-2 câu, 1,0
điểm).
9:;0<3=!khoảng 30% (3,0 điểm)
9:;0<3=>0khoảng 70% (7,0 điểm).
%JSS6TRUQRVUWRW
'' +XY
#=Z[N
\FB
%B=]B
'^>@
'^
_
#] '` -]Za -]ZaI
b@
'#
b@
'8
b@
'#
b@
'8
b@
'#
b@
'8
b@
'#
b@
'8
'# '8
(1) (2) (3) (4) (5) (6) (7) (8) (9) (10) (11) (12) (13) (14)
;
+c
I?J
;T
! ?@
A%B
4@<
! 8 dW_
C%B
4
::D
EF
! 8 dW_
Q #AI
>eA
;T
8 94G ! ! QW_
6 H40
I
04
! ! WT_
>IJ(
KL0
4GAF
WT_
%JSS6TRUQRVUWRW

4MNG
" O1PA2
>1P:4M:G
! ! 8 ! ;dW_
O1P0:
A2I>1P0G
! 8 dW_
V
H
fNY
I?J
MN
;T
Q RJ(K
STA24@
<ST
! 8 dW_
U ET
(@(@%
A2&J(
KST
! 8 dW_
! C-
(;J(
KST
! ! ! ! ;WT_
!! CKV4
4@<J(
KST
! ! 8 ! ;dW_
'^ ;g T ;Q T T Q T ; QR V
%JSS6TRUQRVUWRW

'h_ UT_ T VT_ T T QT_ T ;T_
'^KL UT_ VT_ QT_ ;T_ ;TT_
00D<,#*+',
''
+fN[
+XY
#=Z[N\
FB
%B=]B
b@iIB=]B
Nhn
bit
(TNKQ
)
Thông
hiu
(TNKQ)
Vn
dng
(TL)
Vn
dng
cao
(TL)
(1) (2) (3) (4) (5) (6) (7) (8)
; +c
I?J
;T
! ?@A
%B4@<
#]
WX=%2NEJ3@(5
$D
WX=%2NEJ3@V@
%B L0 (5 $
D
C!C
'`
WY&EJ%B>I%B
?
C
L0(5$D
C!
%JSS6TRUQRVUWRW

WX7EJZ[
5E#L0FN:D
%B
!59\
⇌9
\
6
5](>4:0G0G
-]Za
WY$:^EJN[1ZN:D
%B_GC0G1G5Z5
E#L0`@(>K&
%B4@<
C%B4
::DEF
#]
W9[EJ3@>71
W9[EJ3@K1A2
K3-1
W9[EJ3@(R
W9[EJN[M@D`
0:%0>GV%B(ET(@(
a
WY&EJ%Z(R(R+W
C8C6
%JSS6TRUQRVUWRW