Chương I. CÂN BẰNG HÓA HỌC
CHỦ ĐỀ 1: KHÁI NIỆM VỀ CÂN BẰNG HÓA HỌC
I. Phản ứng một chiều và phản ứng thuận nghịch
Phản ứng một chiều
Phản ứng thuận nghịch
- Phản ứng một chiều là phản ứng chỉ xảy ra - Phản ứng thuận nghịch là phản ứng xảy ra
theo một chiều từ chất tham gia tạo thành sản theo hai chiều ngược nhau trong cùng điều kiện. phẩm.
- PTHH dùng mũi tên 2 chiều: “ ”
- PTHH dùng mũi tên 1 chiều: “→” VD: NaOH + HCl → NaCl + H2O Chú ý: p thuËn(tr¸i ph¶i) Fe + 2HCl → FeCl p nghÞch(ph¶i tr¸ i ) 2 + H2 VD: Cl2 + H2O HCl + HClO
II. Cân bằng hóa học
♦ Trạng thái cân bằng
- Trạng thái cân bằng của phản ứng thuận nghịch là trạng thái tại đó tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
- Cân bằng hóa học là một cân bằng động: Tại trạng thái cân bằng phản ứng thuận và phản ứng
nghịch vẫn xảy ra với tốc độ bằng nhau. Nồng độ các chất tại trạng thái cân bằng không đổi. ♦ Hằng số cân bằng
- Xét phản ứng thuận nghịch tổng quát: aA + bB cC + dD c d
Ở trạng thái cân bằng, hằng số cân bằng (K [C] .[D]
C) tính theo công thức: KC = a b [A] .[B]
Trong đó: ● [A], [B], [C], [D] là nồng độ các chất ở trạng thái cân bằng.
● a, b, c, d là hệ số tỉ lượng trong phương trình.
● Đối với phản ứng có chất rắn tham gia, không biểu diễn nồng độ chất rắn trong biểu
thức tính hằng số cân bằng.
- Hằng số cân bằng (KC) chỉ phụ thuộc vào nhiệt độ và bản chất của phản ứng.
- KC càng lớn thì phản ứng thuận càng chiếm ưu thế hơn và ngược lại.
III. Các yếu tố ảnh hưởng đến cân bằng hóa học
♦ Sự chuyển dịch cân bằng hóa học là sự dịch chuyển từ trạng thái cân bằng này sang trạng thái cân bằng khác.
♦ Nguyên lí chuyển dịch cân bằng Le Chatelier: Một phản ứng thuận nghịch đang ở trạng thái cân
bằng khi chịu tác động từ bên ngoài như biến đổi nồng độ, áp suất, nhiệt độ thì cân bằng sẽ chuyển
dịch theo chiều làm giảm tác động bên ngoài đó.
♦ Các yếu tố ảnh hưởng đến cân bằng hóa học Nhiệt độ Nồng độ Áp suất
- Khi tăng nhiệt độ, cân bằng - Khi tăng nồng độ của một - Khi tăng áp suất chung của
chuyển dịch theo chiều thu chất trong phản ứng thì cân hệ thì cân bằng chuyển dịch
nhiệt (giảm nhiệt độ).
bằng chuyển dịch theo chiều theo chiều làm giảm áp suất
- Khi giảm nhiệt độ, cân bằng làm giảm nồng độ của chất (giảm số mol khí) và ngược
chuyển dịch theo chiều tỏa đó và ngược lại. lại. nhiệt (tăng nhiệt độ).
- Áp suất không ảnh hưởng TĂNG THU – GIẢM TỎA
đến phản ứng có tổng hệ số tỉ
lượng các chất khí hai vế bằng nhau.
- Chất xúc tác làm tăng tốc độ phản ứng thuận và phản ứng nghịch với số lần như nhau nên làm cho
phản ứng nhanh đạt tới trạng thái cân bằng mà không làm chuyển dịch cân bằng.
❖ BÀI TẬP TỰ LUẬN ♦ VÍ DỤ MINH HỌA
Câu 1. Điền các từ hoặc cụm từ thích hợp vào chỗ trống: bằng tốc độ làm giảm cân bằng động nhanh thuận nhiệt độ thuận nghịch cân bằng chuyển dịch
(a) Phản ứng (1) ……………… là phản ứng xảy ra theo hai chiều ngược nhau trong cùng điều kiện.
(b) Trạng thái cân bằng của phản ứng thuận nghịch là trạng thái tại đó tốc độ phản ứng thuận
(2) …………. tốc độ phản ứng nghịch.
- Tại trạng thái cân bằng phản ứng thuận và phản ứng nghịch vẫn xảy ra với (3) ………… bằng nhau
nên cân bằng hóa học được gọi là (4) ……………….
(c) Hằng số cân bằng (KC) chỉ phụ thuộc vào (5) ……………. và bản chất của phản ứng.
- KC càng lớn thì phản ứng (6) …………… càng chiếm ưu thế hơn và ngược lại.
(d) Một phản ứng thuận nghịch đang ở trạng thái (7) ……………. khi chịu tác động từ bên ngoài
như biến đổi nồng độ, áp suất, nhiệt độ thì cân bằng sẽ chuyển dịch theo chiều (8) ……………. tác động bên ngoài đó.
- Chất xúc tác làm tăng tốc độ phản ứng thuận và phản ứng nghịch với số lần như nhau nên làm cho
phản ứng (9) ……………. đạt tới trạng thái cân bằng mà không làm (10) ………………. cân bằng. Hướng dẫn giải (1) thuận nghịch (5) nhiệt độ (8) làm giảm (2) bằng (6) thuận (9) nhanh (3) tốc độ (7) cân bằng (10) chuyển dịch (4) cân bằng động
Câu 2. Viết phương trình hóa học của các phản ứng thuận nghịch trong các trường hợp sau và xác
định phản ứng thuận, phản ứng nghịch trong các phản ứng đó:
(a) Phản ứng tổng hợp amonia (NH3) từ nitrogen và hydrogen.
(b) Phản ứng xảy ra khi cho khí chlorine tác dụng với nước.
(c) Quá trình hình thành hang động, thạch nhũ trong tự nhiên: Nước có
chứa CO2 chảy qua đá vôi, bào mòn đá tạo thành Ca(HCO3)2 (phản ứng
thuận) góp phần hình thành các hang động. Hợp chất Ca(HCO3)2 trong
nước lại bị phân hủy tạo ra CO2 và CaCO3 (phản ứng nghịch), hình thành
thạch nhũ, măng đá, cột đá. Hướng dẫn giải
Phương trình hóa học
Phản ứng thuận – phản ứng nghịch (a) N2(g) + H2(g) NH3(g)
Pư thuận: N2(g) + H2(g) → NH3(g)
Pư nghịch: NH3(g) → N2(g) + H2(g) (b) Cl2(g) + H2O(l) HCl(aq) + HClO(aq)
PƯ thuận: Cl2(g) + H2O(l) → HCl(aq) + HClO(aq)
PƯ nghịch: HCl(aq) + HClO(aq) → Cl2(g) + H2O(l) 2 (c) CaCO
PƯ thuận: CaCO3(s) + CO2(aq) + H2O(l) → Ca(HCO3)2(aq) 3(s) + CO2(aq) + H2O(l) Ca(HCO
PƯ nghịch: Ca(HCO3)2(aq) → CaCO3(s) + CO2(aq) + H2O(l) 3)2(aq)
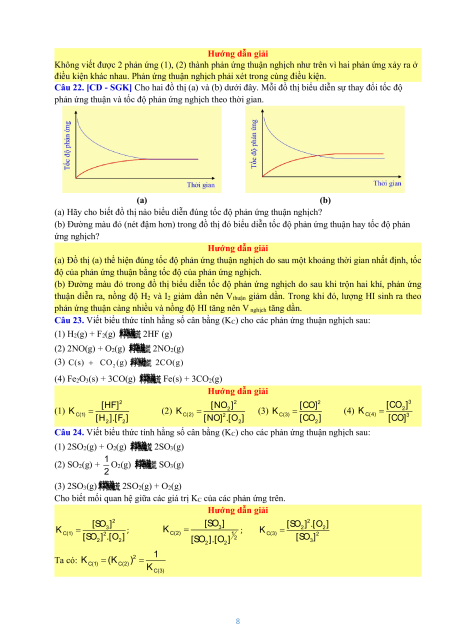
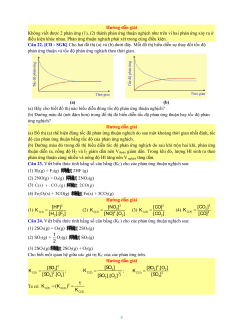
Câu 3. [KNTT - SGK] Cho phản ứng: 2HI(g) H (g) I (g) 2 2
(a) Vẽ dạng đồ thị biểu diễn tốc độ của phản ứng thuận và phản ứng nghịch theo thời gian.
(b) Xác định trên đồ thị thời điểm phản ứng bắt đầu đạt trạng thái cân bằng. Hướng dẫn giải
(a) Đồ thị biểu diễn tốc độ của phản ứng thuận và phản ứng nghịch theo thời gian
(b) Phản ứng bắt đầu đạt trạng thái cân bằng được biểu biễn tại điểm A trên đồ thị.
Câu 4. Viết biểu thức tính hằng số cân bằng (KC) cho các phản ứng thuận nghịch sau:
(a) Phản ứng tổng hợp ammonia: N (g) 3H (g) 2 NH (g) 2 2 3
(b) Phản ứng tổng hợp sulfur trioxide: SO2(g) + 1 O 2 2(g) SO3(g)
(c) Phản ứng nung vôi: CaCO (s) C aO(s) + CO (g) 3 2
(d) Phản ứng đốt cháy copper (I) oxide: 1 Cu O(s) O (g) 2CuO(s) 2 2 2 Hướng dẫn giải NH32 (a) K = (b) [SO ] 1 3 K (c) K = CO (d) C 2 K = C N .H 3 C 1 C 1 2 2 2 2 [SO ].[O ] [O ] 2 2 2
Câu 5. [CD - SGK] Methanol (CH3OH) là nguyên liệu quan trọng trong công
nghiệp hoá học. Dựa vào hằng số cân bằng của các phản ứng ở 25°C, hãy lựa
chọn phản ứng thích hợp để điều chế CH3OH. Giải thích? (1) CO(g) +2H2(g) CH3OH(g) KC = 2,26.104 (2) CO2(g) + 3H2(g) CH3OH(g) + H2O(g) KC = 8,27.10−1 Hướng dẫn giải
Phản ứng (1) là phản ứng thuận nghịch có KC = 2,26.104 rất lớn so với 1 nên phản ứng thuận diễn ra
thuận lợi hơn rất nhiều so với phản ứng nghịch các chất ở trạng thái cân bằng chủ yếu là chất sản
phẩm Phản ứng (1) thích hợp để điều chế CH3OH trong công nghiệp.
Câu 6. [KNTT - SBT] Các kết quả trong bảng sau đây được ghi lại từ hai thí nghiệm giữa khí sulfur
dioxide và khí oxygen để tạo thành khí sulfur trioxide ở 600 oC. Tính giá trị KC ở hai thí nghiệm và
nhận xét kết quả thu được.
Nồng độ các chất ở thời điểm ban đầu (M)
Nồng độ các chất ở thời điểm cân bằng (M) SO2 O2 SO3 SO2 O2 SO3 Thí nghiệm 1 2,000 1,500 3,000 1,500 1,250 3,500 Thí nghiệm 2 0,500 0 0,350 0,590 0,045 0,260 3 Hướng dẫn giải SO 2 3 K
Thí nghiệm 1: K 4,355 ; Thí nghiệm 2: K 4,315 . C SO 2 O C C 2 2
Nhận xét: Giá trị K ở hai thí nghiệm gần bằng nhau, mặc dù nồng độ các chất khác nhau. C
Câu 7. [KNTT - SGK] Cho các cân bằng sau: CaCO (s) C aO(s) + CO (g) o 3 2 V H =176kJ r 298
2SO (g) O (g) 2 SO (g) o 2 2 3 V H =-198kJ r 298
Nếu tăng nhiệt độ các cân bằng trên dịch chuyển theo chiều nào? Giải thích. Hướng dẫn giải ♦ PTHH: CaCO (s) C aO(s) + CO (g) o 3 2 V H =176kJ r 298 Phản ứng trên có o
V H > 0 chiều thuận thu nhiệt, chiều nghịch tỏa nhiệt. r 298
+ Nếu tăng nhiệt độ thì cân bằng chuyển dịch theo chiều giảm nhiệt độ, tức là chiều phản ứng thu nhiệt chiều thuận.
♦ PTHH: 2SO (g) O (g) 2 SO (g) o 2 2 3 V H =-198kJ r 298 Phản ứng trên có o
V H < 0 chiều thuận tỏa nhiệt, chiều nghịch thu nhiệt. r 298
+ Nếu tăng nhiệt độ, cân bằng chuyển dịch theo chiều giảm nhiệt độ, tức là chiều phản ứng thu nhiệt chiều nghịch
Câu 8. [KNTT - SGK] Ester là hợp chất hữu cơ dễ bay hơi, một số ester được sử dụng làm chất tạo
mùi thơm cho các loại bánh, thực phẩm. Phản ứng điều chế ester là một phản ứng thuận nghịch: CH COOH(l) C H OH(l) C H COOC H (l) + H O(g) 3 2 5 3 2 5 2
Hãy cho biết cân bằng trên dịch chuyển theo chiều nào nếu:
(a) Tăng nồng đô của C H OH 2 5
(b) Giảm nồng độ của CH COOC H 3 2 5 Hướng dẫn giải
PTHH: CH COOH(l) C H OH(l) C
H COOC H (l) + H O(g) 3 2 5 3 2 5 2
(a) C H OH là chất phản ứng, khi tăng nồng độ C H OH cân bằng hóa học chuyển dịch theo chiều 2 5 2 5
làm giảm nồng độ C2H5OH chiều thuận
(b) CH COOC H là chất sản phẩm, khi giảm CH COOC H cân bằng hóa học chuyển dịch theo 3 2 5 3 2 5
chiều làm tăng nồng đồ CH COOC H chiều thuận. 3 2 5
Câu 9. [CTST - SGK] Xét các hệ cân bằng sau trong một bình kín: (1) o C(s) H O(g) CO(g) H (g) V H 131 kJ 2 2 r 298 (2) o CO(g) H O(g) CO (g) H (g) V H 4 1 kJ 2 2 2 r 298
Các cân bằng trên chuyển dịch như thế nào (chiều thuận, chiều nghịch, không chuyển dịch) khi biến
đổi các điều kiện sau:
Yếu tố biến đổi Cân bằng (1) Cân bằng (2) Tăng nhiệt độ
Thêm một lượng hơi nước Thêm khí H2 4
Chuyên đề dạy thêm Hóa 11 (cấu trúc mới)
13.2 K
6.6 K lượt tải
200.000 ₫
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
- Tailieugiaovien.com.vn giới thiệu Chuyên đề dạy thêm Hóa học lớp 11 dành cho cả 3 sách mới nhằm giúp Giáo viên có thêm tài liệu tham khảo tài liệu môn Hóa học lớp 11.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(13205 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)