Sở GD - ĐT …
ĐỀ KIỂM TRA GIỮA HỌC KÌ I TRƯỜNG THPT … Năm học: …. Môn: Hóa học 11 Mã đề thi: 003
Bộ: Kết nối tri thức với cuộc sống
Thời gian làm bài: 45 phút;
(28 câu trắc nghiệm – 3 câu tự luận)
(Học sinh không được sử dụng tài liệu)
Họ, tên học sinh:..................................................................... Lớp: ............................. Đề bài:
Phần I: Trắc nghiệm (7 điểm)
* Mức độ nhận biết
Câu 1. Biểu thức tính hằng số cân bằng (KC) của phản ứng tổng quát: aA + bB cC + dD là [A].[B] a b [A] .[B] A. K B. K C [C].[D] C c d [C] .[D] c d [C] .[D] [C].[D] C. K D. K C a b [A] .[B] C [A].[B]
Câu 2. Yếu tố nào sau đây luôn luôn không làm dịch chuyển cân bằng của hệ phản ứng?
A. Nhiệt độ. B. Áp suất.
C. Nồng độ. D. Chất xúc tác.
Câu 3. Các dung dịch acid, base, muối dẫn điện được là do trong dung dịch của chúng có các
A. ion trái dấu.
B. anion (ion âm).
C. cation (ion dương). D. chất.
Câu 4. Chất nào sau đây thuộc loại chất điện li mạnh? A. NaHCO3. B. C2H5OH. C. H2O. D. NH3.
Câu 5. Chất nào sau đây thuộc loại chất điện li yếu? A. NaHCO3. B. C2H5OH. C. H2S. D. NH4Cl.
Câu 6. Dung dịch nào sau đây có pH < 7? A. BaCl2. B. KOH. C. HNO . D. Na SO . 3 2 4
Câu 7. Theo thuyết acid – base của Bronsted – Lowry, base là
A. chất cho electron.
B. chất nhận electron. C. chất cho proton.
D. chất nhận proton.
Câu 8. Ở dạng hợp chất, nitrogen tồn tại nhiều trong các mỏ khoáng dưới dạng A. NaNO3. B. KNO3. C. HNO3. D. Ba(NO3)2.
Câu 9. Ở nhiệt độ thường, nitrogen khá trơ về mặt hoạt động hóa học là do
A. nitrogen có bán kính nguyên tử nhỏ.
B. nitrogen có độ âm điện lớn.
C. phân tử nitrogen có liên kết ba bền vững.
D. phân tử nitrogen không phân cực.
Câu 10. Liên kết hoá học trong phần tử NH3 là liên kết
A. cộng hoá trị có cực. B. ion.
C. cộng hoá trị không cực. D. kim loại.
Câu 11. Tính chất hóa học của NH3 là
A. tính base, tính khử.
B. tính base, tính oxi hóa.
C. tính acid, tính base.
D. tính acid, tính khử.
Câu 12. Có thể nhận biết muối ammonium bằng cách cho muối tác dụng với dung
dịch kiềm thấy thoát ra một chất khí. Chất khí đó là
A. NH3. B. H2. C. NO2 D. NO.
Câu 13. Phương trình hóa học nào sau đây sai? A. NH HNO NH NO . 3 3 4 3 o B. t 4NH 5O 4N O 6H O. 3 2 2 2 o C. t 2NH 3CuO N 3Cu 3H O. 3 2 2
D. 3NH AlCl 3H O Al(OH) 3 NH Cl. 3 3 2 3 4
Câu 14. Nitrogen dioxide là tên gọi của oxide nào sau đây? A. NO. B. NO2. C. N2O. D. N2O4.
Câu 15. Mưa acid là hiện tượng tượng nước mưa có pH như thế nào? A. > 5,6. B. < 7. C. > 7. D. < 5,6.
Câu 16. Kim loại iron không phản ứng được với dung dịch nào sau đây?
A. HNO3 đặc, nguội. B. H2SO4 đặc, nóng. C. HNO3 loãng. D. H2SO4 loãng.
* Mức độ thông hiểu
Câu 17. Cân bằng hoá học nào sau đây không bị chuyển dịch khi thay đổi áp suất? A. 2SO ( g) O ( g) 2SO ( g) 2 2 3 B. C(s) H O(g) CO(g) H ( g) 2 2 C. PCl ( g) Cl ( g) PCl ( g) 3 2 5 D. 3Fe(s) 4H O(g) Fe O ( s) 4H ( g) 2 3 4 2
Câu 18. Cho cân bằng hoá học: 2SO2 (g) + O2 (g)
2SO3 (g); phản ứng thuận
là phản ứng toả nhiệt. Phát biểu đúng là
A. Cân bằng chuyển dịch theo chiều thuận khi tăng nhiệt độ.
B. Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ O2.
C. Cân bằng chuyển dịch theo chiều thuận khi giảm áp suất hệ phản ứng.
D. Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ SO3.
Câu 19. Cho các cân bằng sau: (1) H2(g) + I2(g) 2HI(g) (4) 2HI(g) H2(g) + I2(g) 1 1 (2) H2(g) + I2(g) HI(g) (5) H2(g) + I2(s) 2HI(g) 2 2 1 1 (3) HI(g) H2(g) + I2(g) 2 2
Ở nhiệt độ xác định, nếu KC của cân bằng (1) bằng 64 thì KC bằng 0,125 là của cân bằng A. (5). B. (2). C. (3). D. (4).
Câu 20. Theo thuyết Bronsted – Lowry chất nào sau đây lưỡng tính? A. Mg2+. B. NH − 3. C. HCO3 . D. 2 SO . 3
Câu 21. Cho dãy các chất: K2SO4.Al2(SO4)3.24H2O, C2H5OH, C12H22O11
(saccharose), CH3COOH, Ca(OH)2, CH3COONH4. Số chất điện li là A. 3. B. 4. C. 5. D. 2.
Câu 22. Một dung dịch có pH = 11,7. Nồng độ ion hydrogen (H+) của dung dịch là A. 2,3M. B. 11,7M. C. 5,0.10-3M. D. 2,0.10- 12M. o 3000 C
Câu 23. Trong phản ứng: N2(g) + O2(g)
2NO(g). N2 thể hiện A. tính khử.
B. tính oxi hóa. C. tính base. D. tính acid.
Câu 24. Khí nitrogen ít tan trong nước là do
A. nitrogen có bán kính nguyên tử nhỏ.
B. nitrogen có độ âm điện lớn.
C. phân tử nitrogen có liên kết ba bền vững.
D. phân tử nitrogen không phân cực.
Câu 25. Tìm các tính chất không thuộc về khí nitrogen?
(a) Hóa lỏng ở nhiệt độ rất thấp (-196oC).
Đề thi giữa kì 1 Hóa Học 11 Kết nối tri thức (đề 3)
1.9 K
0.9 K lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu bộ 3 đề giữa kì 1 gồm đầy đủ ma trận và lời giải chi tiết môn Hóa học 11 Kết nối tri thức mới nhất năm 2023 - 2024 nhằm giúp Giáo viên có thêm tài liệu tham khảo ra đề thi Hóa học lớp 11.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(1859 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 11
Xem thêmTài liệu bộ mới nhất

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin vui lòng: 084 283 45 85
Sở GD - ĐT …
TRƯỜNG THPT …
Mã đề thi: 003
ĐỀ KIỂM TRA GIỮA HỌC KÌ I
Năm học: ….
Môn: Hóa học 11
Bộ: Kết nối tri thức với cuộc sống
Thời gian làm bài: 45 phút;
(28 câu trắc nghiệm – 3 câu tự luận)
(Học sinh không được sử dụng tài liệu)
Họ, tên học sinh:..................................................................... Lớp:
.............................
Đề bài:
Phần I: Trắc nghiệm (7 điểm)
* Mức độ nhận biết
Câu 1. Biểu thức tính hằng số cân bằng (K
C
) của phản ứng tổng quát: aA + bB
cC + dD là
A.
C
[A].[B]
K
[C].[D]
B.
ab
C
cd
[A] .[B]
K
[C] .[D]
C.
cd
C
ab
[C] .[D]
K
[A] .[B]
D.
C
[C].[D]
K
[A].[B]
Câu 2. Yếu tố nào sau đây luôn luôn không làm dịch chuyển cân bằng của hệ phản
ứng?
A. Nhiệt độ. B. Áp suất. C. Nồng độ. D. Chất xúc
tác.
Câu 3. Các dung dịch acid, base, muối dẫn điện được là do trong dung dịch của
chúng có các
A. ion trái dấu. B. anion (ion âm).

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin vui lòng: 084 283 45 85
C. cation (ion dương). D. chất.
Câu 4. Chất nào sau đây thuộc loại chất điện li mạnh?
A. NaHCO
3
. B. C
2
H
5
OH. C. H
2
O. D. NH
3
.
Câu 5. Chất nào sau đây thuộc loại chất điện li yếu?
A. NaHCO
3
. B. C
2
H
5
OH. C. H
2
S. D. NH
4
Cl.
Câu 6. Dung dịch nào sau đây có pH < 7?
A. BaCl
2
. B. KOH. C. HNO
3
. D. Na
2
SO
4
.
Câu 7. Theo thuyết acid – base của Bronsted – Lowry, base là
A. chất cho electron. B. chất nhận electron.
C. chất cho proton. D. chất nhận proton.
Câu 8. Ở dạng hợp chất, nitrogen tồn tại nhiều trong các mỏ khoáng dưới dạng
A. NaNO
3
. B. KNO
3
. C. HNO
3
. D.
Ba(NO
3
)
2
.
Câu 9. Ở nhiệt độ thường, nitrogen khá trơ về mặt hoạt động hóa học là do
A. nitrogen có bán kính nguyên tử nhỏ.
B. nitrogen có độ âm điện lớn.
C. phân tử nitrogen có liên kết ba bền vững.
D. phân tử nitrogen không phân cực.
Câu 10. Liên kết hoá học trong phần tử NH
3
là liên kết
A. cộng hoá trị có cực. B. ion.
C. cộng hoá trị không cực. D. kim loại.
Câu 11. Tính chất hóa học của NH
3
là
A. tính base, tính khử. B. tính base, tính oxi hóa.
C. tính acid, tính base. D. tính acid, tính khử.
Câu 12. Có thể nhận biết muối ammonium bằng cách cho muối tác dụng với dung
dịch kiềm thấy thoát ra một chất khí. Chất khí đó là

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin vui lòng: 084 283 45 85
A. NH
3
. B. H
2
. C. NO
2
D. NO.
Câu 13. Phương trình hóa học nào sau đây sai?
A.
3 3 4 3
NH HNO NH NO .
B.
o
t
3 2 2 2
4NH 5O 4N O 6H O.
C.
o
t
3 2 2
2NH 3CuO N 3Cu 3H O.
D.
3 3 2 3 4
3NH AlCl 3H O Al(OH) 3NH Cl.
Câu 14. Nitrogen dioxide là tên gọi của oxide nào sau đây?
A. NO. B. NO
2
. C. N
2
O. D. N
2
O
4
.
Câu 15. Mưa acid là hiện tượng tượng nước mưa có pH như thế nào?
A. > 5,6. B. < 7. C. > 7. D. < 5,6.
Câu 16. Kim loại iron không phản ứng được với dung dịch nào sau đây?
A. HNO
3
đặc, nguội. B. H
2
SO
4
đặc, nóng. C. HNO
3
loãng. D. H
2
SO
4
loãng.
* Mức độ thông hiểu
Câu 17. Cân bằng hoá học nào sau đây không bị chuyển dịch khi thay đổi áp suất?
A.
2 2 3
2SO ( g) O ( g) 2SO ( g)
B.
22
C(s) H O(g) CO(g) H ( g)
C.
3 2 5
PCl ( g) Cl ( g) PCl ( g)
D.
2 3 4 2
3Fe(s) 4H O(g) Fe O ( s) 4H ( g)
Câu 18. Cho cân bằng hoá học: 2SO
2
(g) + O
2
(g) 2SO
3
(g); phản ứng thuận
là phản ứng toả nhiệt. Phát biểu đúng là
A. Cân bằng chuyển dịch theo chiều thuận khi tăng nhiệt độ.
B. Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ O
2
.
C. Cân bằng chuyển dịch theo chiều thuận khi giảm áp suất hệ phản ứng.
D. Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ SO
3
.

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin vui lòng: 084 283 45 85
Câu 19. Cho các cân bằng sau:
(1) H
2
(g) + I
2
(g) 2HI(g) (4) 2HI(g) H
2
(g) + I
2
(g)
(2)
1
2
H
2
(g) +
1
2
I
2
(g) HI(g) (5) H
2
(g) + I
2
(s) 2HI(g)
(3) HI(g)
1
2
H
2
(g) +
1
2
I
2
(g)
Ở nhiệt độ xác định, nếu K
C
của cân bằng (1) bằng 64 thì K
C
bằng 0,125 là của cân
bằng
A. (5). B. (2). C. (3). D. (4).
Câu 20. Theo thuyết Bronsted – Lowry chất nào sau đây lưỡng tính?
A. Mg
2+
. B. NH
3
. C. HCO
3
−
. D.
2
3
SO .
Câu 21. Cho dãy các chất: K
2
SO
4
.Al
2
(SO
4
)
3
.24H
2
O, C
2
H
5
OH, C
12
H
22
O
11
(saccharose), CH
3
COOH, Ca(OH)
2
, CH
3
COONH
4
. Số chất điện li là
A. 3. B. 4. C. 5. D. 2.
Câu 22. Một dung dịch có pH = 11,7. Nồng độ ion hydrogen (H
+
) của dung dịch là
A. 2,3M. B. 11,7M. C. 5,0.10
-3
M. D. 2,0.10
-
12
M.
Câu 23. Trong phản ứng: N
2
(g) + O
2
(g)
o
3000 C
2NO(g). N
2
thể hiện
A. tính khử. B. tính oxi hóa. C. tính base. D. tính acid.
Câu 24. Khí nitrogen ít tan trong nước là do
A. nitrogen có bán kính nguyên tử nhỏ.
B. nitrogen có độ âm điện lớn.
C. phân tử nitrogen có liên kết ba bền vững.
D. phân tử nitrogen không phân cực.
Câu 25. Tìm các tính chất không thuộc về khí nitrogen?
(a) Hóa lỏng ở nhiệt độ rất thấp (-196
o
C).
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin vui lòng: 084 283 45 85
(b) Cấu tạo phân tử nitrogen là
NN
.
(c) Tan nhiều trong nước.
(d) Nặng hơn oxygen.
(e) Kém bền, dễ bị phân hủy thành nitrogen nguyên tử.
A. (a), (c), (d). B. (a), (b). C. (c), (d), (e). D. (b), (c),
(e).
Câu 26. Dãy các muối ammonium nào khi bị nhiệt phân tạo thành khí NH
3
?
A. NH
4
Cl, NH
4
HCO
3
, (NH
4
)
2
CO
3
. B. NH
4
Cl, NH
4
NO
3
, NH
4
HCO
3
.
C. NH
4
Cl, NH
4
NO
3
, (NH
4
)
2
CO
3
. D. NH
4
NO
3
, NH
4
HCO
3
,
(NH
4
)
2
CO
3
.
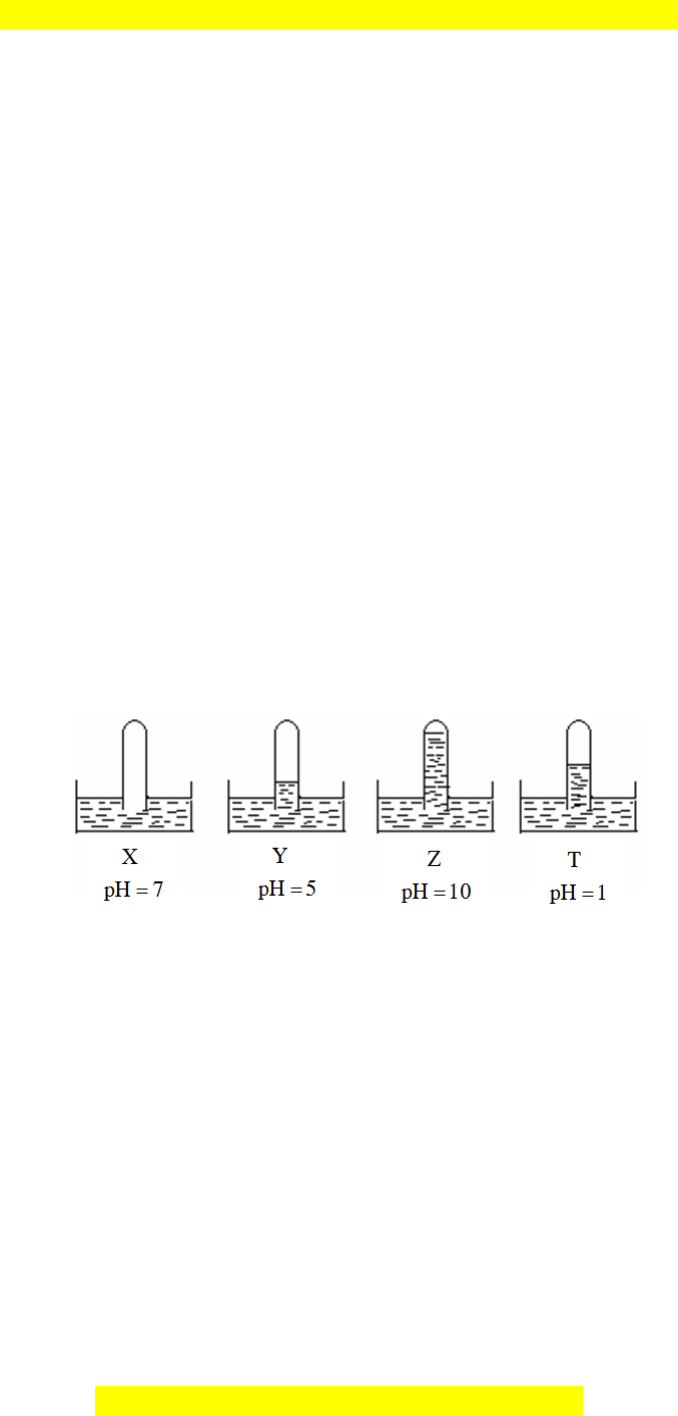
Câu 27. Có 4 ống nghiệm, mỗi ống đựng một chất khí khác nhau, chúng được úp
ngược trong các chậu nước X, Y, Z, T. Kết quả thí nghiệm được mô tả bằng hình
vẽ sau:
Các khí X, Y, Z, T lần lượt là:
A. NH
3
, HCl, O
2
, SO
2
. B. O
2
, SO
2
, NH
3
, HCl.
C. SO
2
, O
2
, NH
3
, HCl. D. O
2
, HCl, NH
3
, SO
2
.
Câu 28. Tổng hệ số (các số nguyên, tối giản) của tất cả các chất trong phương
trình phản ứng giữa Cu với dung dịch HNO
3
đặc, nóng là
A. 10. B. 11. C. 8. D. 9.
* Mức độ vận dụng - vận dụng cao
Phần II: Tự luận (3 điểm)
Câu 29. (1 điểm) Trong công nghiệp, halogen được sản xuất từ phản ứng:

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin vui lòng: 084 283 45 85
CH
4
(g) + H
2
O(g) ⇌ 3H
2
(g) + CO(g)
a) Tính hằng số cân bằng K
C
của phản ứng trên ở 760
o
C.
Biết ở nhiệt độ này, tất cả các chất đều ở thể khí và nồng độ mol của CH
4
, H
2
O, H
2
và CO ở trạng thái cân bằng lần lượt là 0,126 M; 0,242 M; 1,150 M và 0,126 M.
b) Ở 760
o
C, giả sử ban đầu chỉ có CH
4
và H
2
O có nồng độ bằng nhau và bằng x
M. Xác định x, biết nồng độ của H
2
ở trạng thái cân bằng là 0,6 M.
Câu 30. (1 điểm) Tại sao khi bảo quản các dung dịch muối M
3+
(Fe
3+
, Al
3+
…)
trong phòng thí nghiệm, người ta thường nhỏ vài giọt acid vào trong lọ đựng dung
dịch muối?
Câu 31. (1 điểm) Việc sản xuất ammonia trong công nghiệp dựa trên phản ứng
thuận nghịch sau đây:
N
2
(g) + 3H
2
(g)
o
xt,t ,p
2NH
3
(g)
o
r 298
H
= -92 kJ
Khi hỗn hợp phản ứng đang ở trạng thái cân bằng, những thay đổi dưới đây sẽ làm
cân bằng chuyển dịch như thế nào? Giải thích.
(a) Tăng nhiệt độ. (d) Giảm nhiệt độ.
(b) Tăng áp suất. (e) Lấy NH
3
ra khỏi hệ.
(c) Thêm chất xúc tác.
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI ĐỀ 003
Phần I. Trắc nghiệm
1 - C
2 - D
3 - A
4 - A
5 - C
6 - C
7 - D
8 - A
9 - C
10 - A
11 - A
12 - A
13 - B
14 - B
15 - D
16 - A
17 - D
18 - B
19 - C
20 - C
21 - B
22 - D
23 - A
24 - D
25 - C
26 - A
27 - B
28 - A
Phần II. Tự luận
Câu 29.

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin vui lòng: 084 283 45 85
a) Hằng số cân bằng K
C
của phản ứng ở 760
o
C là:
4
C
2
33
2
1,15 .0,126
K
[H ] .[CO]
[CH ]
.6,285
0,126.0,242.[H O]
b) Ta có: CH
4
(g) + H
2
O(g) ⇌ 3H
2
(g) + CO(g)
Ban đầu: x x 0 0 M
Phản ứng: 0,2 0,2 0,6 0,2 M
Cân bằng: (x – 0,2) (x – 0,2) 0,6 0,2 M
Do giá trị K
C
chỉ phụ thuộc vào bản chất của các chất trong cân bằng và nhiệt độ.
Nên:
3
2
4
3
2
C
0,6 .0,2
K 6,285
(xC 0,
]
2).
[H ] .[
] (x
CO
[ H .[H O] 0,2)
0,0432 = 6,285x
2
– 2,514x + 0,2514
6,285x
2
– 2,514x + 0,2082 = 0
x = 0,283 (thoả mãn); x = 0,12 (loại do 0,12 < 0,2).
Câu 30.
Phản ứng thủy phân muối:
3
23
M 3H O M(OH) 3H .
Khi thêm vài giọt acid tức là thêm H
+
thì cân bằng trên chuyển dịch theo chiều
nghịch nên hạn chế được sự thủy phân của muối M
3+
.
Câu 31.
Phản ứng trên có
o
r 298
H
< 0 nên chiều thuận tỏa nhiệt, chiều nghịch thu nhiệt.
(a) Khi tăng nhiệt độ thì cân bằng chuyển dịch theo chiều làm giảm nhiệt độ (chiều
phản ứng thu nhiệt) tức chiều nghịch.
(b) Khi tăng áp suất thì cân bằng chuyển dịch theo chiều làm giảm số mol khí tức
chiều thuận.
(c) Khi thêm chất xúc tác cân bằng không chuyển dịch vì chất xúc tác không ảnh
hưởng đến cân bằng.

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin vui lòng: 084 283 45 85
(d) Khi giảm nhiệt độ cân bằng chuyển dịch theo chiều làm tăng nhiệt độ (chiều
phản ứng tỏa nhiệt) tức chiều thuận.
(e) Khi lấy NH
3
ra khỏi hệ thì cân bằng chuyển dịch theo chiều làm tăng NH
3
tức
chiều thuận.























