Đề số 2 Sở GD- ĐT …
ĐỀ KIỂM TRA GIỮA HỌC KÌ II TRƯỜNG THPT … Môn: Hóa học 10
Bộ: Chân trời sáng tạo Mã đề thi: 002
Thời gian làm bài: 45 phút;
(28 câu trắc nghiệm – 4 câu tự luận)
(Học sinh không được sử dụng tài liệu)
Họ, tên học sinh:.....................................................................
Lớp: ............................. Đề bài:
Phần I: Trắc nghiệm (7 điểm)
Mức độ nhận biết:
Câu 1: Số oxi hoá của kim loại kiềm thổ (nhóm IIA) trong hợp chất là A. -2. B. +2. C. 0. D. -1.
Câu 2. Số oxi hoá của oxygen trong H2O là A. -2. B. +2. C. +1. D. -1.
Câu 3: Phát biểu nào sau đây không đúng?
A. Trong một phân tử, tổng số oxi hoá của các nguyên tử bằng 0.
B. Trong hợp chất, oxygen có số oxi hóa bằng -2, trừ một số trường hợp ngoại lệ.
C. Số oxi hóa của hydrogen trong các hydride kim loại bằng +1.
D. Các nguyên tố phi kim có số oxi hóa thay đổi tùy thuộc vào hợp chất chứa chúng.
Câu 4: Phản ứng oxi hóa – khử là phản ứng có sự chuyển dịch
A. electron giữa các chất.
B. neutron giữa các chất.
C. proton của nguyên tử. D. cation.
Câu 5: Chất oxi hoá là
A. chất nhường electron.
B. chất nhận electron.
C. chất nhường proton.
D. chất nhận proton.
Câu 6: Chất nào sau đây có tính khử mạnh? A. KMnO4. B. F2. C. H2S. D. CrO3.
Câu 7: Cho phản ứng: SO2 + Br2 + 2H2O → 2HBr + H2SO4. Trong phản ứng trên, vai trò của SO2 là A. chất khử. B. chất oxi hóa.
C. vừa là chất oxi hóa, vừa là chất tạo môi trường.
D. vừa là chất khử, vừa là chất tạo môi trường.
Câu 8: Cho các phản ứng hóa học sau:
(a) (b) (c) (d)
Số phản ứng oxi hóa – khử là A. 4. B. 2. C. 3. D. 1.
Câu 9: Enthalpy tạo thành chuẩn (hay nhiệt tạo thành chuẩn) của một chất, kí hiệu là A. B. C. D.
Câu 10: Phát biểu nào sau đây không đúng?
A. Các phản ứng cháy thường là phản ứng tỏa nhiệt.
B. Phản ứng càng tỏa ra nhiều nhiệt càng dễ tự xảy ra.
C. Các phản ứng phân hủy thường là phản ứng thu nhiệt.
D. Các phản ứng khi đun nóng đều dễ xảy ra hơn.
Câu 11: Cho phản ứng sau:
C(s) + O2(g) → CO2(g)
Nhiệt tạo thành chuẩn của CO2(g) là A. 393,5 kJ/ mol. B. – 393,5 kJ/ mol. C. 39,35 kJ/ mol. D. – 39,35 kJ/ mol.
Câu 12: Cho các phản ứng sau:
(1) H2(g) + Cl2(g) 2HCl (g)
(2) CH4(g) + H2O(l) → CO(g) + 3H2(g) Phát biểu đúng là
A. Cả hai phản ứng đều toả nhiệt.
B. Cả hai phản ứng đều thu nhiệt.
C. Phản ứng (1) toả nhiệt, phản ứng (2) thu nhiệt.
D. Phản ứng (2) thu nhiệt, phản ứng (1) toả nhiệt.
Câu 13: Cho các phát biểu sau:
(a). Trong phòng thí nghiệm, có thể nhận biết một phản ứng thu nhiệt hoặc toả
nhiệt bằng cách đo nhiệt độ của phản ứng bằng một nhiệt kế.
(b). Nhiệt độ của hệ phản ứng sẽ tăng lên nếu phản ứng thu nhiệt.
(c). Nhiệt độ của hệ phản ứng sẽ tăng lên nếu phản ứng toả nhiệt.
(d). Nhiệt độ của hệ phản ứng sẽ giảm đi nếu phản ứng toả nhiệt.
(e). Nhiệt độ của hệ phản ứng sẽ giảm đi nếu phản ứng thu nhiệt.
Đề thi giữa kì 2 Hóa học 10 Chân trời sáng tạo - Đề 2
674
337 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu 3 đề thi giữa kì 2 gồm đầy đủ ma trận và lời giải chi tiết môn Hóa học 10 Chân trời sáng tạo mới nhất năm 2023 - 2024 nhằm giúp Giáo viên có thêm tài liệu tham khảo ra đề thi Hóa học lớp 10.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(674 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 10
Xem thêmTài liệu bộ mới nhất

Đây là bản xem thử, vui lòng mua tài liệu để xem chi ết (có lời giải)
Đề số 2
Sở GD- ĐT …
TRƯỜNG THPT …
Mã đề thi: 002
ĐỀ KIỂM TRA GIỮA HỌC KÌ II
Môn: Hóa học 10
Bộ: Chân trời sáng tạo
Thời gian làm bài: 45 phút;
(28 câu trắc nghiệm – 4 câu tự luận)
(Học sinh không được sử dụng tài liệu)
Họ, tên học sinh:.....................................................................
Lớp: .............................
Đề bài:
Phần I: Trắc nghiệm (7 điểm)
Mức độ nhận biết:
Câu 1: Số oxi hoá của kim loại kiềm thổ (nhóm IIA) trong hợp chất là
A. -2. B. +2. C. 0. D. -1.
Câu 2. Số oxi hoá của oxygen trong H
2
O là
A. -2. B. +2. C. +1. D. -1.
Câu 3: Phát biểu nào sau đây không đúng?
A. Trong một phân tử, tổng số oxi hoá của các nguyên tử bằng 0.
B. Trong hợp chất, oxygen có số oxi hóa bằng -2, trừ một số trường hợp ngoại lệ.
C. Số oxi hóa của hydrogen trong các hydride kim loại bằng +1.
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi ết (có lời giải)
D. Các nguyên tố phi kim có số oxi hóa thay đổi tùy thuộc vào hợp chất chứa
chúng.
Câu 4: Phản ứng oxi hóa – khử là phản ứng có sự chuyển dịch
A. electron giữa các chất.
B. neutron giữa các chất.
C. proton của nguyên tử.
D. cation.
Câu 5: Chất oxi hoá là
A. chất nhường electron.
B. chất nhận electron.
C. chất nhường proton.
D. chất nhận proton.
Câu 6: Chất nào sau đây có tính khử mạnh?
A. KMnO
4
. B. F
2
.
C. H
2
S. D. CrO
3
.
Câu 7: Cho phản ứng: SO
2
+ Br
2
+ 2H
2
O → 2HBr + H
2
SO
4
. Trong phản ứng trên,
vai trò của SO
2
là
A. chất khử.
B. chất oxi hóa.
C. vừa là chất oxi hóa, vừa là chất tạo môi trường.
D. vừa là chất khử, vừa là chất tạo môi trường.
Câu 8: Cho các phản ứng hóa học sau:
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
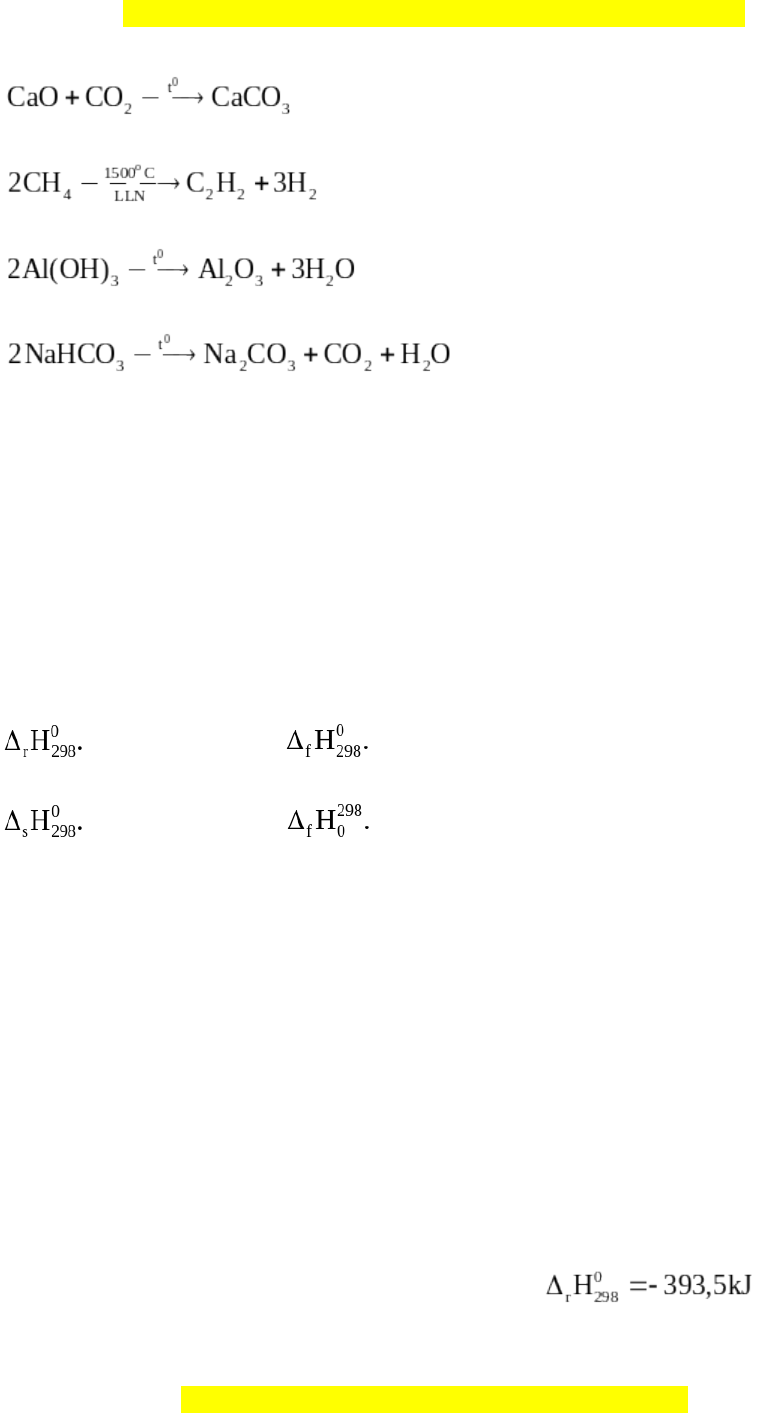
Đây là bản xem thử, vui lòng mua tài liệu để xem chi ết (có lời giải)
(a)
(b)
(c)
(d)
Số phản ứng oxi hóa – khử là
A. 4. B. 2.
C. 3. D. 1.
Câu 9: Enthalpy tạo thành chuẩn (hay nhiệt tạo thành chuẩn) của một chất, kí hiệu
là
A. B.
C. D.
Câu 10: Phát biểu nào sau đây không đúng?
A. Các phản ứng cháy thường là phản ứng tỏa nhiệt.
B. Phản ứng càng tỏa ra nhiều nhiệt càng dễ tự xảy ra.
C. Các phản ứng phân hủy thường là phản ứng thu nhiệt.
D. Các phản ứng khi đun nóng đều dễ xảy ra hơn.
Câu 11: Cho phản ứng sau:
C(s) + O
2
(g) → CO
2
(g)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi ết (có lời giải)
Nhiệt tạo thành chuẩn của CO
2
(g) là
A. 393,5 kJ/ mol.
B. – 393,5 kJ/ mol.
C. 39,35 kJ/ mol.
D. – 39,35 kJ/ mol.
Câu 12: Cho các phản ứng sau:
(1) H
2
(g) + Cl
2
(g) 2HCl (g)
(2) CH
4
(g) + H
2
O(l) → CO(g) + 3H
2
(g)
Phát biểu đúng là
A. Cả hai phản ứng đều toả nhiệt.
B. Cả hai phản ứng đều thu nhiệt.
C. Phản ứng (1) toả nhiệt, phản ứng (2) thu nhiệt.
D. Phản ứng (2) thu nhiệt, phản ứng (1) toả nhiệt.
Câu 13: Cho các phát biểu sau:
(a). Trong phòng thí nghiệm, có thể nhận biết một phản ứng thu nhiệt hoặc toả
nhiệt bằng cách đo nhiệt độ của phản ứng bằng một nhiệt kế.
(b). Nhiệt độ của hệ phản ứng sẽ tăng lên nếu phản ứng thu nhiệt.
(c). Nhiệt độ của hệ phản ứng sẽ tăng lên nếu phản ứng toả nhiệt.
(d). Nhiệt độ của hệ phản ứng sẽ giảm đi nếu phản ứng toả nhiệt.
(e). Nhiệt độ của hệ phản ứng sẽ giảm đi nếu phản ứng thu nhiệt.
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi ết (có lời giải)
Số phát biểu không đúng là
A. 1. B. 2.
C. 3. D. 4.
Câu 14: Khẳng định sai là
A. Nếu biến thiên enthalpy có giá trị âm thì phản ứng tỏa nhiệt.
B. Nếu biến thiên enthalpy có giá trị dương thì phản ứng thu nhiệt.
C. Biến thiên enthalpy càng âm thì phản ứng tỏa nhiệt càng ít.
D. Biến thiên enthalpy càng dương thì phản ứng thu nhiệt càng nhiều.
Câu 15: Phát biểu nào sau đây không đúng?
A. Để so sánh biến thiên enthalpy của các phản ứng khác nhau thì cần xác định
chúng ở cùng một điều kiện.
B. Phản ứng hóa học là quá trình phá vỡ các liên kết trong chất đầu và hình thành
các liên kết mới để tạo thành sản phẩm.
C. Sự phá vỡ liên kết giải phóng năng lượng, trong khi sự hình thành liên kết lại
cần cung cấp năng lượng.
D. Khi than, củi cháy, không khí xung quanh ấm hơn do phản ứng tỏa nhiệt.
Câu 16: Biến thiên enthalpy chuẩn của một phản ứng được mô tả ở sơ đồ dưới
đây:
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85























