TRƯỜNG LIÊN CẤP THCS,
ĐỀ KIỂM TRA HỌC KÌ I
TIỂU HỌC NGÔI SAO HÀ NỘI MÔN: Hóa – Lớp 8
Thời gian làm bài: 45 phút; không kể thời gian phát đề
A. PHẦN TRẮC NGHIỆM
Câu 1 (NB): Định luật (định lý) nào sau đây được ứng dụng nhiều trong bộ môn hoá học lớp 8:
A. Định luật bảo toàn năng lượng. B. Định lý Pytago.
C. Định luật bảo toàn động lượng.
D. Định luật bảo toàn khối lượng.
Câu 2 (TH): Kí hiệu hoá học của sắt là: A. Al. B. Ba. C. Ca. D. Fe.
Câu 3 (TH): Hợp chất được cấu tạo từ nitơ (N) hoá trị II và oxi (O) hoá trị II là: A. N2O. B. NO. C. NO2. D. N2O5.
Câu 4 (TH): Tổng hệ số tối giản của phương trình: Al + Cl2 AlCl3 là: A. 5. B. 6. C. 7. D. 8.
Câu 5 (TH): Phân tử khối của CaCO3 là: A. 100. B. 166. C. 1606. D. 222.
Câu 6 (TH): Cho 5,6 gam Fe phản ứng với 0,15 mol HCl theo phương trình: Fe + HCl → FeCl2 + H2.
Kết luận nào sau đây là chính xác:
A. Fe là chất hết.
B. HCl là chất hết.
C. Cả 2 chất cùng hết. D. Cả 2 chất cùng dư.
Câu 7 (TH): Khối lượng của 0,1 mol nhôm (Al) là: A. 2,7 gam. B. 5,4 gam. C. 27 gam. D. 54 gam.
Câu 8 (TH): Số nguyên tử ứng với 0,5 mol Al là:
A. 6.1023 nguyên tử.
B. 3.1023 nguyên tử.
C. 6.1022 nguyên tử.
D. 3.1022 nguyên tử.
Câu 9 (VD): Trong tự nhiên, sắt chủ yếu tồn tại dưới dạng hợp chất và nằm trong 4 loại quặng chính:
hematit (Fe2O3), manhetit (Fe3O4), xiderit (FeCO3) và pirit (FeS2). Quặng chứa hàm lượng sắt cao nhất là: A. Hematit. B. Manhetit. C. Xiderit. D. Pirit.
Câu 10 (VD): Đốt cháy hoàn toàn 13,4 gam hỗn hợp X gồm: Fe, Al và Cu trong 2,24 lít khí O2 (đktc),
sau phản ứng thu được m gam chất rắn. Giá trị của m là: (biết oxi phản ứng hết) A. 16,6 gam. B. 13,4 gam. C. 22,2 gam. D. 14,8 gam.
Câu 11 (TH): Cân bằng các phương trình phản ứng hoá học sau: a. Cu + O2 CuO. b. Zn + HCl → ZnCl2 + H2.
c. MgCl2 + NaOH → Mg(OH)2 + NaCl.
d. Fe2O3 + HCl → FeCl3 + H2O.
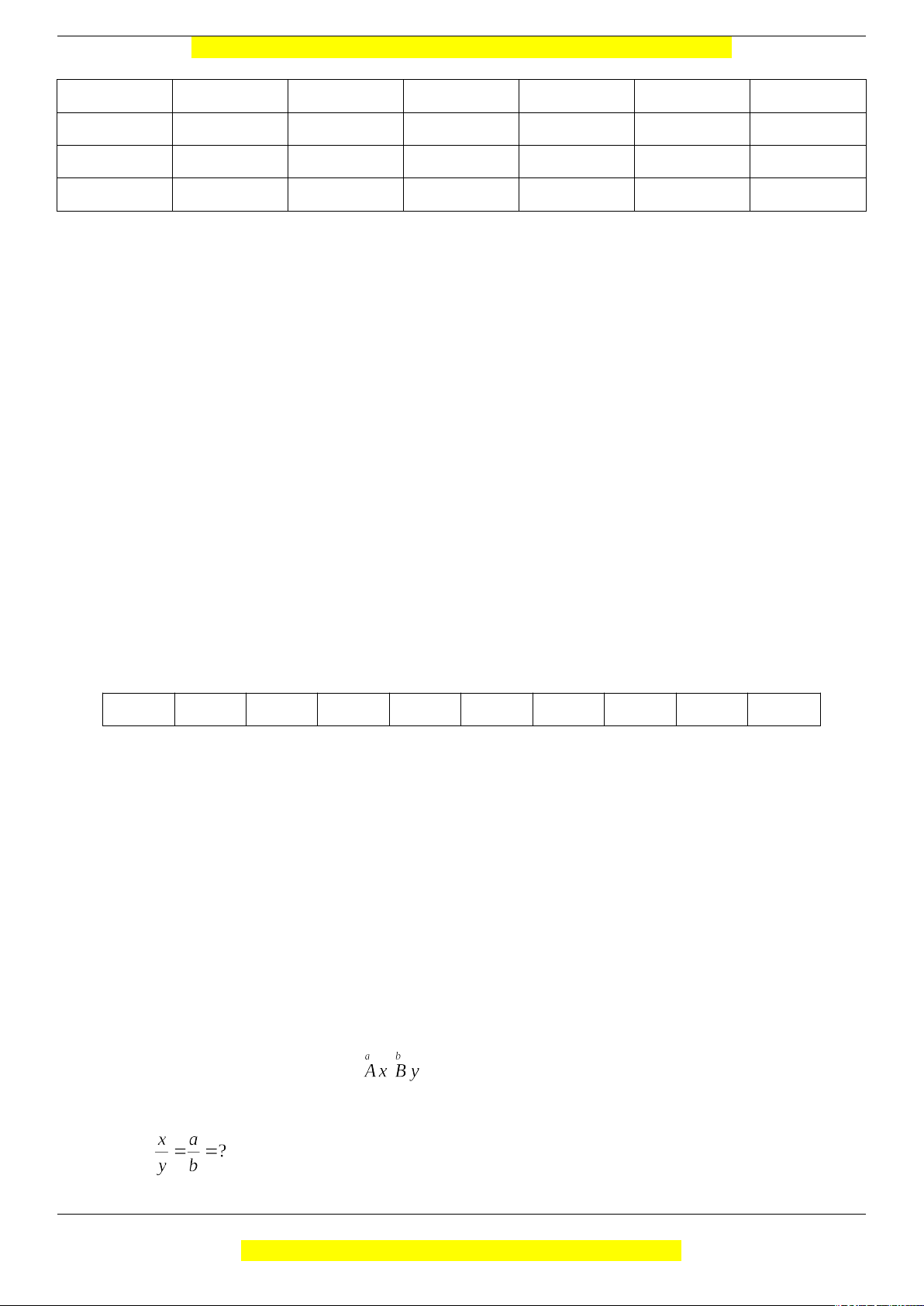
Câu 12 (TH): Hoàn thành bảng sau: Trang 1
Al NH3 MgSO4 N2 CO M (g/mol) d/H2 n (mol) 0,1 0,2 n(mol) 0,15 m (gam) 1,7 V(lít) 2,24
Câu 13 (VD): Khí X được gọi là “khí nhà kính” bởi khí X là nguyên nhân chính gây ra hiệu ứng nhà
kính. Khí X được cấu tạo từ 2 nguyên tố, trong đó có một nguyên tố là cacbon (C). Biết rằng cacbon (C)
chiếm 27,27% về khối lượng. Và khí X có tỉ khối hơi so với hidro (H2) là 22. Xác định công thức hoá học của khí X.
Câu 14 (VD): Hoà tan hoàn toàn 5,6 gam Fe trong dung dịch HCl, sau phản ứng thu được FeCl2 và khí H2.
a. Tính khối lượng FeCl2 thu được sau phản ứng.
b. Tính số mol HCl đã tham gia phản ứng.
Câu 15 (VDC): Phân huỷ C4H10 ở điều kiện thích hợp, sau một thời gian thu được hỗn hợp T gồm 5 chất:
CH4, C3H6, C2H4, C2H6 và C4H10 dư. Biết tỉ khối của hỗn hợp T so với hidro là 16,11. Xác định hiệu suất
phản ứng. Biết rằng phản ứng phân hủy C4H10 xảy ra theo 2 phương trình sau: C4H10 →CH4 + C3H6 C4H10 → C2H6 + C2H4 Đáp án 1-C 2-D 3-B 4-C 5-A 6-A 7-A 8-B 9-B 10-A LỜI GIẢI CHI TIẾT
Câu 1: Đáp án C
Câu 2: Đáp án D
A. Al là kí hiệu của nguyên tố nhôm
B. Ba là kí hiệu của nguyên tố bari
C. Ca là kí hiệu của nguyên tố canxi
D. Fe là kí hiệu của nguyên tố sắt
Câu 3: Đáp án B Phương pháp giải:
Dùng quy tắc hóa trị để lập công thức:
Theo quy tắc hóa trị thì: a× x = b× y => lập tỉ lệ
=> từ đó tìm được công thức Trang 2
Giải chi tiết: Gọi công thức là:
Theo quy tắc hóa trị ta có: II× x = II× y =>
=> chọn x = 1 và y = 1 => công thức cấu tạo là NO
Câu 4: Đáp án C Phương pháp giải:
Có thể cân bằng phương trình hóa học theo 1 trong những phương pháp sau:
Phương pháp kim loại – phi kim Phương pháp chẵn – lẻ
Phương pháp nguyên tử nguyên tố
Phương pháp dùng hệ số phân số Phương pháp hóa trị
=> sau đó cộng tổng hệ số các chất của phương trình lại. Giải chi tiết: 2Al + 3Cl2 2AlCl3
=> tổng hệ số = 2+ 3 + 2 = 7
Câu 5: Đáp án A Phương pháp giải:
Học thuộc nguyên tử khối của các chất ở bảng 1 trang 42- sách giáo khoa hóa học 8 Giải chi tiết:
Phân tử khối của CaCO3 = 40 + 12 + 16.3 = 100 (đvC)
Câu 6: Đáp án A Phương pháp giải:
Tính số mol Fe : nFe = mFe : MFe = ? (mol)
Dựa vào phương trình so sánh xem Fe và HCl chất nào phản ứng hết. Giải chi tiết: nFe = 5,6 : 56 = 0,1 (mol) Fe + HCl → FeCl2 + H2 Theo phương trình 1 1 (mol)
Theo đề bài: 0,1 0,15 (mol) Ta thấy :
. Do vậy Fe là chất phản ứng hết, HCl là chất còn dư.
Câu 7: Đáp án A Trang 3
Phương pháp giải:
Công thức: mAl = nAl.27 = ? (g) Giải chi tiết:
Khối lượng của 0,1 mol Al là: mAl = 0,1.27 = 2,7 (g)
Câu 8: Đáp án B Phương pháp giải:
Công thức: NAl = nAl . × 6,023.1023 = ? (nguyên tử) Giải chi tiết:
Số nguyên tử ứng với 0,5 mol Al là: 0,5× 6,023.1023= 3.1023 (nguyên tử)
Câu 9: Đáp án B Phương pháp giải:
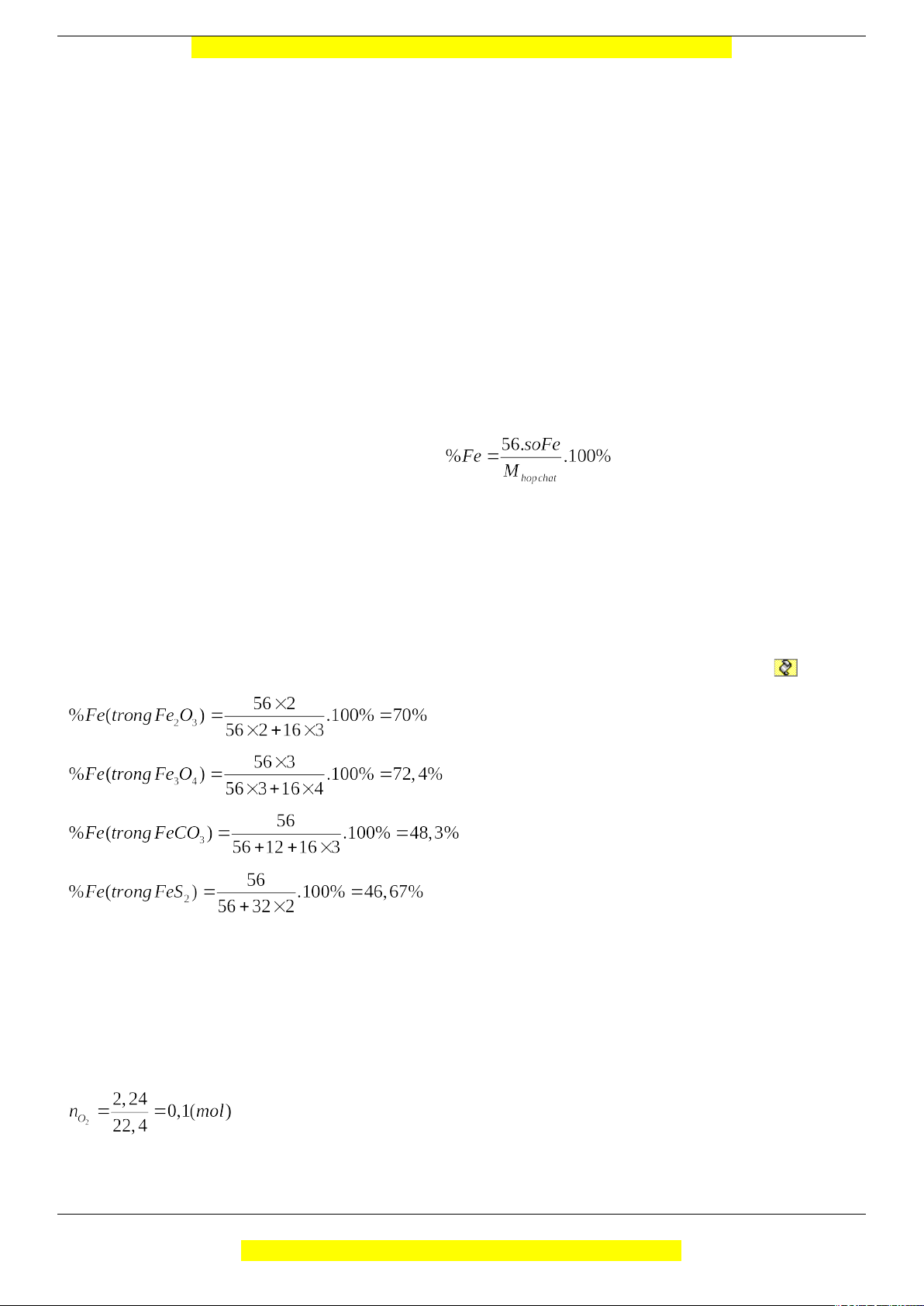
Tính % Fe có trong từng hợp chất theo công thức:
=> phần trăm trong chất nào cao nhất thì chọn Giải chi tiết:
%Fe(trongFe2O3)=56×256×2+16×3.100%=70%%Fe(trongFe3O4)=56×356×3+16×4.100%=72,4%
%Fe(trongFeCO3)=5656+12+16×3.100%=48,3%%Fe(trongFeS2)=5656+32×2.100%=46,67%
%Fe(trongFe2O3)=56×256×2+16×3.100%=70%%Fe(trongFe3O4)=56×356×3+16×4.100%=72,4%
%Fe(trongFeCO3)=5656+12+16×3.100%=48,3%%Fe(trongFeS2)=5656+32×2.100%=46,67%
=> phần trăm sắt trong Fe3O4 là cao nhất
Câu 10: Đáp án A Phương pháp giải:
Áp dụng định luật bảo toàn khối lượng: mRắn = m hh X + mO2 = ? (gam) Giải chi tiết: => mO2 = 0,1.32 = 3,2 (g)
Hỗn hợp X + O2 → hỗn hợp oxit
Áp dụng định luật bảo toàn khối lượng ta có: Trang 4
Đề thi học kì 1 Hóa lớp 8 năm 2023 trường Liên cấp THCS, Tiểu học Ngôi Sao - Hà Nội
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Đề thi được cập nhật liên tục trong gói này từ nay đến hết tháng 6/2023. Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Bộ 21 Đề thi học kì 1 Hóa học năm 2023 chọn lọc từ các trường bản word có lời giải chi tiết:
+ Đề thi học kì 1 Hóa học năm 2023 trường THCS Thái Bình;
+Đề thi học kì 1 Hóa học năm 2023 trường THCS Trưng Nhị;
+Đề thi học kì 1 Hóa học năm 2023 trường THCS Tô Hoàng;
+Đề thi học kì 1 Hóa học năm 2023 trường THCS Thủy Châu - Thị Xã Hương Thủy;
+Đề thi học kì 1 Hóa học năm 2023 Sở GD_ĐT Thanh Hóa.
…..……………………
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(657 )Trọng Bình
Giúp ích cho tôi rất nhiều
Duy Trần
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 8
Xem thêmTài liệu bộ mới nhất