Trường THPT chuyên Lam Sơn
Đề kiến nghị môn Hóa học (Lớp 10)
Câu 1: (2,5 điểm) Cấu tạo nguyên tử. Phản ứng hạt nhân. Định luật tuần hoàn
1. Năng lượng En (J) của electron trong X (là hạt một electron) được tính bằng biểu thức: −m E = e . Z 2 e4 n
8 ε2 n2h2 0
Trong đó, e là điện tích nguyên tố; Z là điện tích hạt nhân; là hằng số điện; h là hằng
số Planck; n là số lượng tử chính (n = 1, 2, 3…).
a) Nếu X là nguyên tử hidrogen. Tính bước sóng λmax (nm) của dãy phổ Lyman khi electron chuyển từ
n = 3 về n = 1.
b) Sự chuyển electron từ các trạng thái năng lượng cao hơn về năng lượng E3 (n=3) chỉ
cho một vạch ở vùng nhìn thấy trong số các tín hiệu quang phổ của X. Xác định Z và
bước sóng (theo nm) của vạch phổ đó. Biết ánh sáng nhìn thấy có bước sóng trong
khoảng từ 380 nm đến 800 nm.
2. Trong sự phân hạch do dùng neutron bắn phá
, cuối cùng thường thu được hai sản phẩm bển là và .
a) Những hạt cơ bản nào được phát ra.
b) Tính năng lượng được giải phóng ra trong mỗi phân hạch theo MeV và theo Joules (J).
c) Tính năng lượng được giải phóng khi mỗi gam
bị phân hạch theo đơn vị kW/giờ. Cho: 1u = 931,5 MeV/c2 235U 136Xe 98Mo
Nguyên tử khối 235,04393 135,90722 97,90551 1,00867
Câu 2: (2,5 điểm) Cấu tạo phân tử. Tinh thể
1. Cho phân tử nào sau: NH3, SiHCl3, SF2, O3, BF3, SiF4. Những phân tử nào có momen
lưỡng cực lớn hơn 0? Giải thích?
2. Từ nhiệt độ phòng đến 1185K sắt (iron) tồn tại ở dạng với cấu trúc lập
phương tâm khối, từ 1185K đến 1667K ở dạng
, với cấu trúc lập phương tâm diện.
Ở 293K sắt có khối lượng riêng d = 7,874g/cm3.
a) Tính bán kính của nguyên tử Fe.
b) Tính khối lượng riêng của Fe ở 1250K (bỏ qua ảnh hưởng không đáng kể do sự dãn nở nhiệt).
c) Thép là hợp kim của iron và carbon, trong đó một số khoảng trống giữa các nguyên
tử sắt bị chiếm bởi nguyên tử carbon. Trong lò luyện thép (lò thổi) sắt dễ nóng chảy khi
chứa 4,3% cacbon về khối lượng. Nếu được làm lạnh nhanh thì các nguyên tử carbon
vẫn được phân tán trong mạng lưới lập phương tâm khối, hợp kim được gọi là
martensite cứng và giòn. Kích thước của tế bào sơ đẳng của không đổi. Tính số
nguyên tử carbon trung bình trong mỗi tế bào sơ đẳng của
với phần trăm khối lượng của C là 4,3%.
d) Tính khối lượng riêng của martensite.
(Cho Fe = 55,847; C = 12,011; số Avogadro )
Câu 3: (2,5 điểm) Nhiệt hóa học
1. Năng lượng liên kết có thể được tính dựa vào biến thiên entanpi của quá trình chuyển
các nguyên tử tự do thành phân tử (tính cho 1 mol). Đại lượng này thường gọi là sinh
nhiệt nguyên tử. Năng lượng liên kết của các liên kết có trong một chất được định nghĩa
là biến thiên entanpi của quá trình biến đổi một số Avogadro phân tử của chất đã cho
thành các nguyên tử tự do. Như vậy, năng lượng liên kết ngược dấu với sinh nhiệt nguyên tử.
Ở điều kiện tiêu chuẩn, cho biến thiên entanpi của phản ứng phân li các phân tử
H2, Br2, của sự thăng hoa than chì (Ctc) như sau:
H2(k) 2H(k) H1 = 432,2 kJ/mol
Br2(l) 2Br(h) H2 = 190 kJ/mol
Ctc(r) C(k) H3 = 710,6 kJ/mol
và biến thiên entanpi hình thành của CH4 và CH3Br lần lượt là: = -74,8 kJ/mol; = -35,6 kJ/mol.
Tính năng lượng liên kết C-Br trong CH3Br.
2. Tính sự biến thiên entropi của quá trình đun nóng 0,5 mol H2O từ –50oC đến 500oC ở
P = 1atm. Biết nhiệt nóng chảy của nước ở 273K là 6004 J.mol1; nhiệt bay hơi của nước
ở 373K là 40660 J.mol1. Nhiệt dung mol đẳng áp
của nước đá và nước lỏng lần lượt
bằng 35,56 và 75,3 J.mol1.K1;
của hơi nước là (30,2 + 102.T) J.mol1. K1.
Câu 4: (3,0 điểm) Động hóa học. Cân bằng hóa học trong pha khí
1. Đường saccharose khi hòa tan trong nước (dưới xúc tác acid) bị thuỷ phân thành
glucose và fructose. Phép đo góc quay cực tại 25°C của dung dịch saccharose phụ thuộc
theo thời gian (phút) cho kết quả như bảng sau: t (phút) 0 10 20 40 80 180 300 α (o) 6,6 6,17 5,79 5 3,71 1,4 -0,24
Biết góc quay cực riêng [α]D (là góc đo được cho dung dịch nồng độ 1 g/mL với quang
lộ l = 10 cm) của đường saccharose, glucose và fructose lần lượt là: 66,53; 52,7 và - 92,4°.mL.g-1.cm-1.
a) Xác định bậc của phản ứng thuỷ phân và hằng số tốc độ tương ứng.
b) Trong dung dịch HCl 0,1 M; tốc độ phản ứng thuỷ phân tăng gấp đôi khi nhiệt độ
tăng từ 25°C lên 30°C. Hãy xác định năng lượng hoạt hoá cho phản ứng thuỷ phân. 2. Cho cân bằng: 2SO2(k) + O2 (k) 2SO3 (k)
a) Tại nhiệt độ T và áp suất p = 1 atm, thành phần của hỗn hợp khí lúc cân bằng là SO2:
2,5 mol; SO3: 4,5 mol; O2: 1,0 mol và N2: 7,0 mol. Xác định hằng số cân bằng của phản
ứng tại nhiệt độ T đó. Tính hiệu suất của phản ứng. Giả thiết ban đầu không có SO3.
b) Giả thiết ban đầu không có N2, số mol của các khí SO2 và O2 có giá trị như ở ý a, áp
suất chung của hệ vẫn bằng 1,0 atm. Tính hiệu suất của phản ứng.
Câu 5: (3,0 điểm) Cân bằng acid-base và cân bằng hợp chất ít tan. Phương án thực hành
1. Dung dịch A gồm KCN 0,120M; NH4Cl 0,150M và KOH 0,155M.
a. Tính pH của dung dịch A.
b. Độ điện li của KCN trong dung dịch A.
c. Thể tích dung dịch HCl 0,210M cần cho vào 50,00 ml dung dịch A để pH của hỗn
hợp thu được bằng 9,24.
Cho biết pKa của HCN là 9,35; của
là 9,24; Kw của H2O là 10-14
2. Quy trình chuẩn độ dung dịch A gồm Na2CO3 0,040 M và NaHCO3 0,040 M như sau:
Lấy 10,0 ml dung dịch trên cho vào bình nón, thêm vài giọt chất chỉ thị X và chuẩn độ
bằng dung dịch HCl 0,040 M đến khi dung dịch đổi màu thì dừng lại. Thêm tiếp vài giọt
chất chỉ thị Y vào dung dịch thu được ở trên. Chuẩn độ tiếp bằng dung dịch HCl 0,040
M đến khi dung dịch đổi màu.
a. Hãy tính pH tại điểm tương đương thứ nhất và thứ hai, từ đó chọn chất chỉ thị X, Y
thích hợp từ những chất chỉ thị cho dưới đây.
Cho biết CO2 tạo thành tan hoàn toàn trong dung dịch; Hỗn hợp H2O + CO2 có pKa1 =
6,62; pKa2 = 10,35. Độ tan của CO2 là = 0,03 M. Chất chỉ thị
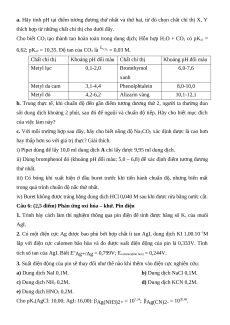
Khoảng pH đổi màu Chất chỉ thị Khoảng pH đổi màu Metyl lục 0,1-2,0 Bromthymol 6,0-7,6 xanh Metyl da cam 3,1-4,4 Phenolphtalein 8,0-10,0 Metyl đỏ 4,2-6,2 Alizarin vàng 10,1-12,1
b. Trong thực tế, khi chuẩn độ đến gần điểm tương đương thứ 2, người ta thường đun
sôi dung dịch khoảng 2 phút, sau đó để nguội và chuẩn độ tiếp. Hãy cho biết mục đích của việc làm này?
c. Với mỗi trường hợp sau đây, hãy cho biết nồng độ Na2CO3 xác định được là cao hơn
hay thấp hơn so với giá trị thực? Giải thích.
i) Pipet dùng để lấy 10,0 ml dung dịch A chỉ lấy được 9,95 ml dung dịch.
ii) Dùng bromphenol đỏ (khoảng pH đổi màu: 5,0 – 6,8) để xác định điểm tương đương thứ nhất.
iii) Có bóng khí xuất hiện ở đầu buret trước khi tiến hành chuẩn độ, nhưng biến mất
trong quá trình chuẩn độ nấc thứ nhất.
iv) Buret không được tráng bằng dung dịch HCl 0,040 M sau khi được rửa bằng nước cất.
Câu 6: (2,5 điểm) Phản ứng oxi hóa – khử. Pin điện
1. Trình bày cách làm thí nghiệm thông qua pin điện để tính được hằng số Ks của muối AgI.
2. Có một điện cực Ag được bao phủ bởi hợp chất ít tan AgI, dung dịch KI 1,00.10 -1M
lắp với điện cực calomen bão hòa và đo được suất điện động của pin là 0,333V. Tính
tích số tan của AgI. Biết EoAg+/Ag = 0,799V; Ecalomen(bão hoà) = 0,244V.
3. Suất điện động của pin sẽ thay đổi như thế nào khi thêm vào điện cực nghiên cứu:
a) Dung dịch NaI 0,1M.
b) Dung dịch NaCl 0,1M.
c) Dung dịch NH3 0,2M.
d) Dung dịch KCN 0,2M.
e) Dung dịch HNO3 0,2M.
Cho pKs(AgCl: 10,00; AgI: 16,00): βAg(NH3)2+ = 107,24; βAg(CN)2- = 1020,48.
Đề thi HSG Hóa học 10 Trường THPT Chuyên Lam Sơn - Thanh Hóa
654
327 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu Tổng hợp đề thi chọn học sinh giỏi Hóa học 10 của các trường THPT Chuyên khu vực Duyên hải và Đồng bằng Bắc Bộ gồm 29 đề đề xuất và 1 đề chính thức có lời giải giúp giáo viên, học sinh có thêm tài liệu tham khảo.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(654 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)