TRƯỜNG THPT CHUYÊN BẮC GIANG
ĐỀ THI ĐỀ XUẤT CHỌN HSG KHU VỰC ĐBDHBB NĂM HỌC 2023- 2024
Môn: Hóa học – Lớp 11
Thời gian làm bài 180 phút (không kể thời gian phát đề)
Câu 1. (2,5 điểm) Động học phản ứng
1. Quá trình phân huỷ hợp chất A2B theo phương trình sau: có phương trình tốc độ phản ứng là
. Dữ kiện động học của phản ứng được cho như bảng dưới đây: Nhiệt độ (K) 967 967 1030 1030
Nồng độ đầu A2B (mmol.dm-3) 156 39 7 49
Thời gian nửa phản ứng của A2B 380 1520 1442 206 (s)
a) Tính năng lượng hoạt hoá Ea và hằng số tốc độ phản ứng k tại 967 K và 1030 K.
b) Khi nồng độ đầu của A2B ở 1030 K là 54 mmol.dm-3, tính thời gian cần thiết để phản ứng chuyển hoá hết 37% A2B.
2. Phản ứng khử phức của Fe3+ ([FeL6]3+) thành phức của Fe2+ ([FeL6]2+) bằng axit ascobic (H2Asc)
xảy ra theo phản ứng: 2[FeL6]3+ + H2Asc 2[FeL6]2+ + Asc + 2H+ (*)
Cơ chế của phản ứng được đề nghị như sau: H2Asc H+ + HAsc- (1) và (-1) [FeL6]3+ + HAsc- [FeL6]2+ + HAsc (2) HAsc H+ + Asc- (3) và (-3) [FeL6]3+ + Asc- [FeL6]2+ + Asc (4)
(1) và (-1) là các phản ứng nhanh so với các phản ứng còn lại.
a) Tìm biểu thức tính hằng số cân bằng K1 (của các phản ứng (1) và (-1)) theo k1 và k-1.
b) Chỉ ra các tiểu phân trung gian phản ứng trong cơ chế trên và cho biết có thể áp dụng
nguyên lí nồng độ dừng cho những tiểu phân nào? Tại sao?
c) Tốc độ phản ứng (*) được định nghĩa là tốc độ tạo thành sản phẩm Asc. Viết biểu thức định
nghĩa tốc độ của phản ứng. Tìm biểu thức của tốc độ phản ứng từ cơ chế và cho biết phản ứng có
bậc động học hay không?
d) Trong một số thí nghiệm người ta thấy tốc độ phản ứng có dạng: .
Hãy cho biết các điều kiện thí nghiệm để thu được biểu thức tốc độ như trên. Cho biết biểu thức của
k và đơn vị của k trong trường hợp này.
Câu 2: (2,5 điểm) Cân bằng phản ứng trong dung dịch. Pin điện-điện phân
1. Dung dịch A là hỗn hợp của H3PO4 và NaHSO4 0.010 M, có pHA = 2.03. a) Tính trong dung dịch A.
b) Tính nồng độ HCOOH phải có trong dung dịch A sao cho độ điện li của H3PO4 giảm 25%
(coi thể tích V không thay đổi). Cho H -
3PO4 có pKa1 = 2,15; pKa2 = 7,21; pKa3 = 12,32 , HSO4 có pKa = 2,0 , HCOOH có pKa = 3,75 , .
2. Một pin điện hóa được xây dựng dựa vào các bán phản ứng:
HSO -4 (aq) + 3H+(aq) + 2e → H2SO3(aq) + H2O E0 = 0,17V 1 Mn2+(aq) + 2e → Mn(r) E0 = -1,18V
a) Viết sơ đồ pin rồi tính Epin tại pH=1.
b) Cho biết Epin thay đổi thế nào (định lượng) nếu cho thêm Ba(NO3)2 vào điện cực chứa HSO -4/H2SO3? Cho BaSO -
3 có pKS = 6,5; BaSO4 có pKS = 9,96; H2SO3 có pKa1 = 1,76 và pKa2 = 7,21; HSO4 có pKa = 2,0.
Câu 3: (2,5 điểm) Nhiệt động học và cân bằng hóa học
1. Cho các giá trị nhiệt động liên quan đến phản ứng trong bảng sau: Ag2CO3 (s) Ag2O (s) CO2 (g) -501,66 -30,58 -393,51 167,4 121,8 213,8 109,6 65,7 37,6
a) Ag2CO3 bị nhiệt phân theo phương trình sau: Ag2CO3 (s) Ag2O (s) + CO2 (g). Tính hằng số cân bằng
(298 K) của phản ứng ở 298 K.
b) Làm khô Ag2CO3 (s) trong dòng khí nóng dưới áp suất 105 Pa và nhiệt độ không đổi 383 K.
Tính áp suất riêng phần tối thiểu của CO2 (g) cần có trong dòng khí để tránh sự phân huỷ Ag2CO3(s). Biết: 2.
a) Quá trình phân huỷ 1 mol PCl5 (g) trong một bình kín, có thể giãn nở dựa theo phương
trình: PCl5 (g) PCl3 (g) + Cl2 (g). Sau khi hệ đạt cân bằng, khối lượng riêng của hỗn hợp khí là
4,80 kg.m-3 tại 105 Pa và 440 K. Giả sử các khí đều là khí lý tưởng, tính của phản ứng ở 440 K.
b) Nếu phản ứng phân huỷ PCl5 (g) được duy trì ở áp suất 105 Pa, và có chứa khí trơ Ar với áp
suất riêng phần là 0,5.105 Pa, tính phần trăm PCl5 (g) bị phân huỷ.
Câu 4: (2,5 điểm) Hóa nguyên tố, phức chất
1. Một nguyên tố X, nguyên tử có ba lớp electron (K, L, M) có các giá trị năng lượng ion hoá I (tính theo kJ/mol) như sau: I1 I2 I3 I4 I5 I6 1012 1903 2910 4956 6278 22230
a) Viết cấu hình electron của X.
b) Xác định công thức phân tử , viết tên gọi các chất trong sơ đồ và viết PTHH thực hiện
mỗi chuyển hóa theo sơ đồ sau:
Biết: Trong các hợp chất A, B, C, D, E, F, G, H thì X có mức oxi hóa cao nhất. B, D, E tạo
dung dịch làm đỏ quỳ tím. Dung dịch F, G phản ứng với axit mạnh và bazơ mạnh. Các chất F, G, H
khi đốt cho ngọn lửa màu tím. 2
2. Phức đa phối tử của Cobalt (II) với phối tử L và axit axetic hấp thụ cực đại ở bước sóng 580 nm,
được tạo thành theo phương trình sau:
Co2+ + xL + yCH3COOH
Co(L)x(CH3COO−)y + yH+ (bỏ qua điện tích); KC
Chỉ số x được xác định bằng cách pha các dung dịch với nồng độ Co2+ và CH3COOH cố định
(tương ứng 2.10−5 M và 1.10−1M), nồng độ phối tử L thay đổi. Mật độ quang A (đo ở l =580 nm, bề
dày cuvet l (cm), phức có hệ số hấp thụ mol ε (L.mol−1.cm−1), chỉ có phức chất hấp thụ bức xạ điện
từ được đo ở điều kiện tối ưu khảo sát và đối chứng với mẫu trắng thích hợp, khi đó xác định được giá trị x.
Trong điều kiện pha cố định nồng độ của Co2+, phối tử L (tương ứng 2.10−5 M và 1M), pH duy trì
cố định và các điều kiện khác, chỉ có nồng độ CH3COOH biến đổi ta có bảng sau 0,5 1 2 3 5 (M) A 0,390 0,502 0,510 0,538 0,542
Biết rằng trong các quá trình khảo sát như trên, khi mật độ quang đo được là 0,280 ứng với nồng độ
phức bằng 1.10−5 M; KC là hằng số cân bằng của phản ứng, trong dung dịch chỉ có quá trình tạo
phức, bỏ qua các quá trình phụ. Dựa vào số liệu trên xác định chỉ số y.
Câu 5: (2,5 điểm) Đại cương hữu cơ
1. So sánh các tính chất của mỗi cặp chất sau và giải thích ngắn gọn:
a) Độ tan trong nước của THF (tetrahydrofuran) và diethyl ether. O O THF (tetrahydrofuran) diethyl ether
b) Giải thích cân bằng sau
2. Biểu diễn các cấu dạng ghế có thể có của chất 1 và 2, chỉ ra cấu dạng bền nhất và giải thích: O O Ph N NMe CH3 CH3 O 1 2
3. Đề xuất công thức cấu tạo và quy kết tín hiệu tương ứng cho mỗi hợp chất sau: Hợp chất J Hợp chất K Phổ khối lượng (MS)
peak ion phân tử: m/z = 72 peak ion phân tử: m/z = 88 Phổ hồng ngoại (IR) peak ở 1710 cm-1 peak ở 3200 – 3600 cm-1
Phổ cộng hưởng từ hạt 1,0 ppm – vân ba – 3H 0,9 ppm – vân ba – 3H nhân (1H NMR) 2,1 ppm – vân đơn – 3H 1,2 ppm – vân đơn – 6H 2,4 ppm – vân bốn – 2H 1,5 ppm – vân bốn – 2H 1,6 ppm – vân đơn – 1H
4. Sắp xếp các chất sau đây theo mức độ tăng dần độ bền của este trong môi trường base và giải thích ngắn gọn. 3 O O O O O O O Cl O F O O O O O Cl F O Cl O F Cl
Câu 6: (2,5 điểm) Sơ đồ tổng hợp hữu cơ. Cơ chế phản ứng hữu cơ
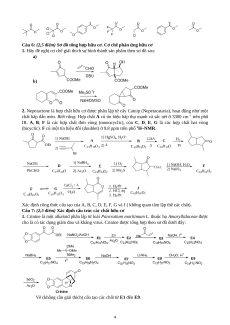
1. Hãy đề nghị cơ chế giải thích sự hình thành sản phẩm theo sơ đồ sau: a) b)
2. Nepetactone là hợp chất hữu cơ được phân lập từ cây Catnip (Nepetacataria), hoạt động như một
chất hấp dẫn mèo. Biết rằng: Hợp chất A có tín hiệu hấp thụ mạnh và sắc nét ở 3300 cm−1 trên phổ
IR. A, B, F là các hợp chất đơn vòng (monocyclic), còn C, D, E, G là các hợp chất hai vòng
(bicyclic). F có một tín hiệu đôi (doublet) ở 9.8 ppm trên phổ 1H–NMR.
Xác định công thức cấu tạo của A, B, C, D, E, F, G và J ( không quan tâm lập thể các chất).
Câu 7: (2,5 điểm) Xác định cấu trúc các chất hữu cơ
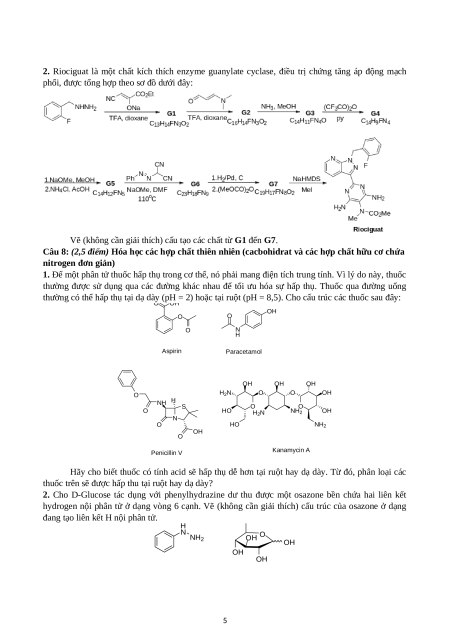
1. Crinine là một alkaloid phân lập từ loài Pancratium maritimum L. thuộc họ Amaryllidaceae được
cho là có tác dụng giảm đau và kháng virus. Crinine được tổng hợp theo sơ đồ dưới đây:
Vẽ (không cần giải thích) cấu tạo các chất từ E1 đến E9. 4
Đề thi HSG Hóa học 11 Trường THPT Chuyên Bắc Giang
530
265 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu Tổng hợp đề thi chọn học sinh giỏi Hóa học 11 của các trường THPT Chuyên khu vực Duyên hải và Đồng bằng Bắc Bộ gồm 27 đề đề xuất và 1 đề chính thức có lời giải giúp giáo viên, học sinh có thêm tài liệu tham khảo.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(530 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)