TRƯỜNG THPT CHUYÊN
KÌ THI CHỌN HỌC SINH GIỎI KHU VỰC
LÊ KHIẾT-QUẢNG NGÃI
DUYÊN HẢI VÀ ĐỒNG BẰNG BẮC BỘ
LẦN THỨ XV- NĂM 2024 ĐỀ THI ĐỀ XUẤT
MÔN THI: HOÁ HỌC LỚP 11
(Đề thi gồm 08 trang)
(Thời gian làm bài 180 phút)
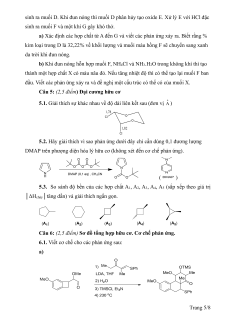
Câu 1 (2,5 điểm) Động học phản ứng
Hydrogen được dự đoán sẽ là nguồn năng lượng của một tương lai không còn
phụ thuộc vào nhiên liệu hoá thạch. Trong bài này, chúng ta sẽ xét đến quá trình lưu
trữ hydrogen trong một kim loại, có liên quan đến công nghệ vận chuyển và lưu trữ
hydrogen. Khí hydrogen được hấp thụ (absorbed) vào một khối kim loại qua bề mặt
của nó, đầu tiên xảy ra quá trình hấp phụ (adsorption) hydrogen được hấp phụ trên bề
mặt kim loại: H2(g) → 2H(ad), trong đó trạng thái khí và trạng thái được hấp phụ của
hydrogen được kí hiệu lần lượt là (g, gas) và (ad, adsorbed). Các nguyên tử hydrogen
được hấp phụ sau đó hoặc sẽ được hấp thụ vào khối kim loại, hoặc sẽ tái tổ hợp và
giải hấp trở lại vào phase khí, như được biểu diễn trong các phản ứng (a) và (b) dưới
đây. H(ab) biểu diễn cho nguyên tử hydrogen được hấp thụ (absorbed) vào khối kim loại. �1 (a) �2 � 2� �� �2 (b) � � �� 3 �(��).
Tốc độ phản ứng trên tâm hoạt động bề mặt cho các quá trình hấp phụ, giải
hấp và hấp thụ lần lượt là:
�1 = �1 . �� 1 − � �−1��−1 2 �2 = �2 �2 �−1 �3 = �3� �−1
Trong đó k1 (s-1 Pa-1), k2 (s-1 ), k3 (s-1 ) là các hằng số tốc độ phản ứng và �� là 2
áp suất khí H2. Trong số các tâm sẵn có trên bề mặt, � (0≤ � ≤ 1) là tỉ lệ phần tâm bị
chiếm bởi các nguyên tử H. Giả thiết rằng các quá trình hấp phụ và giải phụ là nhanh
so với hấp thụ (r1, r2 >> r3) và � là không thay đổi. Trang 1/8
1.1. r3 có thể được biểu diễn theo phương trình: r3 = �3 . Hãy biểu diễn C 1+ 1 ��2� theo k1 và k2.
Đặt một mẫu kim loại với diện tích bề mặt S = 1,0.10-3 m2 vào một bình
chứa( dung tích 1L = 1,0.10-3 m3) với H2 (�� = 1,0. 10−2��). Mật độ của các tâm 2
hấp phụ nguyên tử hydrogen trên bề mặt là N = 1,3.1018 m-2. Nhiệt độ bề mặt được
giữ ở T = 400K. Khi phản ứng (a) và (b) diễn ra, �� giảm với tốc độ không đổi, v = 2
4,0.10-4 Pa.s-1. Giả sử H2 là một khí lí tưởng và thể tích của mẫu kim loại không đáng kể.
1.2. Tính số mol nguyên tử H được hấp thụ trên mỗi đơn vị diện tích bề mặt
trên mỗi đơn vị thời gian, A (theo đơn vị mol.s-1.m-2).
1.3. Ở T = 400 K, C = 1,0. 102 Pa-1. Hãy tính giá trị của k3 ở 400K.
1.4. Ở một nhiệt độ T khác, C = 2,5.103 Pa-1 và k3 = 4,8.10-2 s-1. Từ các phương
án (a) – (h) dưới đây, hãy chọn ra đồ thị hàm số của r3 theo �� .2
Câu 2 (2,5 điểm) Cân bằng và phản ứng trong dung dịch. Pin điện – Điện phân
2.1. Một trong những phương pháp để tinh chế uranium là phương pháp chiết
lỏng – lỏng. Người ta tiến hành chiết dung dịch uranyl nitrate UO2(NO3)2 bằng dung
môi tributyl phosphate được pha trong dầu hỏa. Hệ số phân bố KD trong trường hợp này như sau: ��2 ��3 2 (��) ��2 ��3 K 2 (ℎữ� �ơ) D =10
Hãy đề nghị phương pháp tối ưu nhất ( cách chia dung môi hữu cơ và số lần
chiết) để chiết được 97% UO2(NO3)2 từ 1,00 L dung dịch nước với 500,00 mL dung dịch hữu cơ trên.
2.2. Cho pin điện hóa của Tubandt: Anode AgǀAgIǀCathode Ag Trang 2/8
a) Viết các nửa phản ứng xảy ra tại hai điện cực khi pin hoạt động.
b) Mỗi điện cực Ag đều nặng 0.1 gam và đều tiếp xúc với AgI rắn. Giả thiết
rằng, pin điện hóa như trên có thể phóng ra dòng điện với cường độ không đổi là
35,20 mA. Sau khi pin đã phóng hết điện ( ngừng hoạt động), các điện cực Ag được
lấy ra khỏi tế bào pin và Ag cathode được cho vào bình 1, Ag anode được cho vào
bình 2. Thêm lượng dư HNO3 loãng vào cả hai bình. Sau khi hai điện cực tan hết thì
them tiếp nước cất vào đến khi thu được 100,00 mL dung dịch. Tiến hành lấy 10,00
mL dung dịch trong mỗi bình rồi lần lượt đem chuẩn độ bằng dung dịch NaCl
1,13.10-2 M có chứa một lượng nhỏ K2CrO4. Khi kết tủa màu đỏ gạch bắt đầu xuất
hiện thì cần dùng hết V1 mL ( cho dung dịch trong bình 1) và V2 mL (cho dung dịch
trong bình 2) dung dịch NaCl ở trên. Biết rằng, tỉ lệ V1:V2 = 2,15. Tính thời gian mà
pin có thể phóng điện trong điều kiện đã cho.
Câu 3 (2,5 điểm) Nhiệt động học và cân bằng hóa học
3.1. Sự phụ thuộc của nhiệt độ sôi của methane vào áp suất được mô tả bởi
phương trình kinh nghiệm sau: 433 lg(p/bar) = 3,99 - Ts/K-0,49
a) Xác định nhiệt độ sôi của methane ở áp suất 3 bar.
Chênh lệch về nội năng của methane khí và lỏng ở nhiệt độ sôi 112 K ở áp suất
khí quyển là 7,25 kJ/mol. Một vật được làm lạnh bằng cách làm bay hơi CH4 (l).
b) Tính thể tích CH4(g) (L) ở 1.000 atm phải được tạo thành từ chất lỏng để
loại 32,5 kJ nhiệt khỏi vật.
3.2. Trong công nghiệp, hydrogen có thể được sản xuất bằng cách nhiệt phân
hydrocarbon như methane với hơi nước:
CH4 (k) + H2O (k) ⟶ 3H2 (k) + CO (k) (1)
a) Sử dụng các giá trị nhiệt động học trong bảng sau đây, hãy tính ∆rG0 cho
phản ứng (1) ở 298 K và giá trị hằng số cân bằng Kp. Chất Δ o o fH298K(kJ/mol) S298K (J/mol.K) CH4(k) -74,4 186,3 H2O(k) -241,8 188,8 H2(k) 130,7 Trang 3/8 CO(k) -110,5 197,7
b) Hằng số cân bằng phụ thuộc như thế nào vào nhiệt độ? Quá trình công
nghiệp này được tiến hành ở nhiệt độ cao và áp suất thường mà không cần xúc tác.
Trong hỗn hợp cân bằng lúc này chỉ còn 0,2% thể tích methane.
c) Giả sử phản ứng được tiến hành với một thể tích bằng nhau của methane và
hơi nước. Hãy tính giá trị Kp của quá trình công nghiệp này nếu trong hỗn hợp cân
bằng methane chỉ chiếm 0,2% thể tích.
d) Xác định nhiệt độ mà công nghiệp đã sử dụng để sản xuất hydrogen từ methane.
Câu 4 (2,5 điểm) Hóa nguyên tố. Phức chất
4.1. Các hợp chất vô cơ A-G tham gia sơ đồ phản ứng sau:
Biết rằng: A là khí không màu; E là chất lỏng cực độc, có % (nitrogen) =
97,67% và nhiệt độ sôi khá thấp (37 oC); còn các chất khác đều là chất rắn. Khi hòa
tan C vào nước thu được dung dịch kiềm mạnh và giải phóng khí L (có tỉ khối so với
A là 0,386). L phản ứng với hydrogen chloride tạo thành B. Cho 0,85 gam NaNO3 và
1,17 gam C phản ứng với nhau, thu được 0,65 gam D. Hợp chất D và C đều có chứa
2 nguyên tố phổ biến. Hợp chất E và F phản ứng với nhau theo tỉ lệ mol 1:1. Muối
Christie tạo thành, có %(nitrogen) = 27,03% , rất kém bền và gây nổ khi tiếp xúc với nước.
a) Xác định công thức các hợp chất A, B, C, D, E, F, G, L và viết các phương
trình phản ứng tương ứng trong sơ đồ trên.
b) Dự đoán cấu trúc không gian của các ion trong muối Christie.
c) Viết phương trình phản ứng giữa muối Christie với nước và giải thích tại sao phản ứng gây nổ?
4.2. Hợp chất A là một chất lỏng không màu. Khi đun nóng nó chuyển thành
một khí B có màu nâu nặng hơn không khí 1,59 lần. Phản ứng của B với kim loại C Trang 4/8
Đề thi HSG Hóa học 11 Trường THPT Chuyên Lê Khiết - Quảng Ngãi
0.9 K
465 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu Tổng hợp đề thi chọn học sinh giỏi Hóa học 11 của các trường THPT Chuyên khu vực Duyên hải và Đồng bằng Bắc Bộ gồm 27 đề đề xuất và 1 đề chính thức có lời giải giúp giáo viên, học sinh có thêm tài liệu tham khảo.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(929 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)