THPT CHUYÊN
KỲ THI HỌC SINH GIỎI CÁC TRƯỜNG THPT CHUYÊN NGUYỄN TẤT THÀNH
KHU VỰC DUYÊN HẢI VÀ ĐỒNG BẰNG BẮC BỘ YÊN BÁI
LẦN THỨ XV NĂM 2024 ĐỀ GIỚI THIỆU
ĐỀ THI MÔN: HÓA HỌC-KHỐI 11 Thời gian: 180 phút
Câu 1. Động học phản ứng (2,5 điểm).
Enzyme là chất xúc tác sinh học rất quan trọng đối với sự sống. Hoạt động của enzyme được điều khiển
chặt chẽ bởi các chất ức chế theo nhiều cách khác nhau.
Một phản ứng dạng enzyme-cơ chất không có chất ức chế được mô hình hoá theo sơ đồ sau:
Trong đó: E: enzyme; S: cơ chất; P: sản phẩm.
a) Chứng minh rằng tốc độ tạo thành sản phẩm P tuân theo phương trình động học: k × [E] k + k v = 2 o × [ S ] , vớiK = -1 2 K M M + [ S ] k1
với [E]o là nồng độ đầu của enzyme, KM là hằng số Michaelis-Menten.
b) Tốc độ phản ứng sẽ thay đổi thế nào nếu: i) Nồng độ cơ chất rất nhỏ; ii) Nồng độ cơ chất rất cao?
c) Chất ức chế không cạnh tranh là những chất ức chế liên kết với phức hợp enzyme-cơ chất mà không gắn với enzyme tự do:
Phương trình động học của phản ứng có dạng: k × [E] [ ES][ I] v = 2 o × [ S ] , với K' = K + [S ]× (1 + [I] -1 ) [ ESI ] M 0 × K' I
Với nồng độ cơ chất [S] = 4,5.10-3 M, KM = 9,7.10-3 M và KI” = 9,0.10-4 M. Xác định nồng độ I ban đầu
để tốc độ phản ứng giảm một nửa so với khi không có chất ức chế.
Câu 2. Cân bằng và phản ứng trong dung dịch. Pin điện – Điện phân (2,5 điểm).
1. Trong một thí nghiệm, người ta dự kiến pha 100 mL dung dịch Fe2(SO4)3 có nồng độ 0,10 M. Tuy
nhiên, sau khi pha xong thì thấy xuất hiện vẩn đục màu nâu trong dung dịch.
a) Bằng tính toán, hãy giải thích hiện tượng trên. Khi hệ đã cân bằng, pH của dung dịch là bao nhiêu?
b) Thêm H2SO4 đặc vào dung dịch để loại bỏ hết kết tủa, thu được dung dịch X. Lấy 10,00 mL dung
dịch X, thêm 10,00 mL dung dịch hỗn hợp gồm KI 0,30 M và Na2H2Y (EDTA) 0,30 M thu được dung
dịch Y. Điều chỉnh pH của dung dịch Y cố định bằng 9,00. Tính nồng độ cân bằng các dạng tồn tại của
sắt có mặt trong dung dịch Y.
Cho biết : pKa(HSO4-) = 1,99; pKs(Fe(OH)3) = 37,00; pKw = 14; EDTA (H4Y) có các giá trị hằng số
phân li pKai lần lượt là 2,00; 2,67; 6,16; 10,26; Hằng số tạo phức hydroxo *βFeOH+ = 10-5,92 ; *βFeOH2+ = 10-
2,17 ; Hằng số tạo phức lgβ o
FeY- = 25,1; lgβFeY2- = 14,33; Thế khử chuẩn của các cặp E = 0,5355V; I- / I- 3 Eo = 0,771V. Fe3+ / Fe2+ 1
2. Xét một pin lithium ion có 1 điện cực graphite (than chì) và điện cực còn lại được chế tạo từ lithium
cobalt (III) oxide. Các bán phản ứng sau diễn ra khi pin hoạt động trong quá trình xả và nạp:
(1) LiC6 = Graphite + Li+ + e-; (2) CoO2 + Li+ + e- = LiCoO2
Cobalt (IV) oxide và graphite chứa các lớp mà ở giữa đó có thể tìm thấy các ion Li+. Các lớp CoO2 chứa
3 phân lớp của các nguyên tử oxygen và cobalt, trong đó cobalt phối trí với 6 nguyên tử oxygen.
a) Vẽ các ion Li+ trên các lớp graphite và CoO2.
b) Tính mật độ năng lượng (W · h · kg-1 ) cực đại về mặt lí thuyết của pin, giả sử bỏ qua chất điện li, các
điện cực phản ứng với hiệu suất 100%, không có sự hao hụt năng lượng và điện áp xả trung bình là 3,85 V.
c) Pin lithium ion được nạp lại liên tục ở hai chế độ - dòng không đổi và điện áp không đổi để kéo dài
thời lượng sử dụng. Tính xem cần bao lâu để nạp điện cho 1,00 kg pin lithium ion ở chế độ dòng không
đổi I = 0,80 A, tại điện áp 3,85 V.
d) Đối với pin nhiên liệu, hydrogen được lưu trữ ở dạng khí tại áp suất 7,0.107 Pa, 0oC. Tính mật độ khối
lượng của pin nhiên liệu lí tưởng:
(i) theo khối lượng (W · h · kg-1).
(ii) theo thể tích (W · h · dm-3).
Giả sử bỏ qua khối lượng của nguyên liệu, vỏ và thể tích không gian.
Cho biết: enthalpy tạo thành ΔHf(H2O) = - 241.8 kJ.mol-1.
Câu 3. Nhiệt động học và cân bằng hoá học (2,5 điểm).
1. Một bể chứa isooctane (d = 690kg/m3) có thể tích là 10 dm3 tại 25oC. Áp suất hơi bão hòa của bể chứa
phụ thuộc vào phương trình:
ln(ph)= 10,777 - 4006,04. T-1 (với T theo K và p theo bar)
a) Tính số phân tử isooctane trong phase khí.
b) Tính enthalpy bay hơi của isooctane.
c) Cho 68,52 mg isooctane và không khí vào bình. Toàn bộ isooctane sẽ bay hơi ngay. Coi tất cả đều hệ
khí và tồn tại ở bình có thể tích là 0,9 lít, áp suất 1 bar và ở 298K. Người ta tiến hành nén ngay tức khắc
hệ về thể tích giảm đi 9 lần. Biết rằng Cp/Cv chung của cả 3 khí là 1,24.
Xác định nhiệt độ và áp suất của hệ sau khi nén.
2. Sau khi nén, hệ được đốt cháy.
a) Tính nhiệt lượng tỏa ra của hệ khi đốt cháy isooctane tại nhiệt độ tính được ở câu 1c), biết rằng quá
trình này sinh ra nước hơi.
b) Tính nhiệt độ đạt được của hệ. Biết nhiệt để nâng 1 mol của hỗn hợp (nitrogen, nước hơi và CO2) là
34,643 J. Giả sử rằng nhiệt độ đạt được sau phản ứng chỉ để nâng nhiệt độ các chất sau phản ứng.
Cho biết: Cp(isooctane) = 282,5 J mol-1 K-1; Cp(O2, k) = 21,2 J mol-1 K-1; Cp(N2, k) = 25,9 J mol-1 K-1;
Cp(H2O, h) = 27,3 J mol-1 K-1. Không khí chứa 21% và 79% của O2 và N2 về thể tích.
C8H18 (k) + 25/2 O2 (k) → 8CO2 (k) + 9H2O (l) ; ΔU(298,15 K) = − 5451,3 kJ mol-1
H2O (l) → H2O (h) ; ΔU(298,15 K) = + 41,5 kJ mol-1
Câu 4. Hoá nguyên tố. Phức chất (2,5 điểm).
1. Các hợp chất Z1, Z2, Z3 có công thức tổng quát là ABx, là những chất khí không màu và có tính oxi
hóa mạnh. Chúng được sử dụng rộng rãi trong tổng hợp hóa học. Ngoài ra, khí Z2 là một hóa chất tiềm
năng để làm chất oxi hóa cho nhiên liệu tên lửa và các vũ khí hóa học. Biết tỉ lệ khối lượng mol Z2/Z1
là 1,698, chênh lệch khối lượng mol của Z3 và Z1 là 76 gam/mol và MZ2 + MZ3 bằng 223 g/mol. 2
a) Xác định các nguyên tố A, B và công thức Z1-Z3.
b) Vẽ cấu trúc các hợp chất Z1-Z3 và xác định trạng thái lai hóa của nguyên tử trung tâm.
2. Các chất Z1-Z3 phản ứng mãnh liệt với nước. Đồng thời, từ hợp chất Z1 có tạo thành A (ở dạng đơn
chất), oxygen và acid W1. Từ Z2 tạo oxygen và hỗn hợp các acid W1, W2. Phản ứng với nước của Z3
trong những điều kiện xác định tạo thành các chất W1 và W3 (chứa A, B và 37,02 % oxygen).
a) Xác định các chất W1-W3 và viết các phương trình phản ứng.
b) Vẽ cấu trúc của W3 và xác định số oxi hóa của mỗi nguyên tử.
3. Phổ hấp thụ hồng ngoại thuộc loại phổ dao động, được sử dụng nhiều trong nghiên cứu cấu trúc và cơ
chế phản ứng hóa học. Phổ hấp thụ hồng ngoại được sử dụng dựa trên nguyên tắc:
(i) Sự dao động của mỗi loại liên kết hấp thụ bức xạ hồng ngoại trong một khoảng số sóng (cm–1) đặc trưng;
(ii) Đối với các liên kết cùng loại, liên kết càng bền thì dao động của nó sẽ hấp thụ bức xạ có số sóng càng lớn.
Sắp xếp (có giải thích) theo thứ tự giảm dần độ lớn số sóng ứng với dao động của CO (kí hiệu là vCO)
trong các phức chất ở mỗi dãy sau:
a) [Cr(CO)6], [Mn(CO)6]Cl và Na[V(CO)6].
b) [Ni(CO)3(PF3)], [Ni(CO)3(PMe3)] và [Ni(CO)3(PPh3)].
Cho biết: ZV = 23; ZCr = 24; ZMn = 25 và ZNi = 28.
Câu 5. Đại cương hữu cơ (2,5 điểm). 1. Cho các chất sau:
So sánh tính acid của từng cặp (A1, A2), (A3, A4) và giải thích ngắn gọn.
2. Các hợp chất tự nhiên có bộ khung tropolone rất hay gặp trong một số loại nấm, vi khuẩn. Xét hai hợp
chất có bộ khung tropolone dưới đây:
Cả chất B1 và B2 đều thể hiện đồng thời tính acid và base. Giải thích hiện tượng trên.
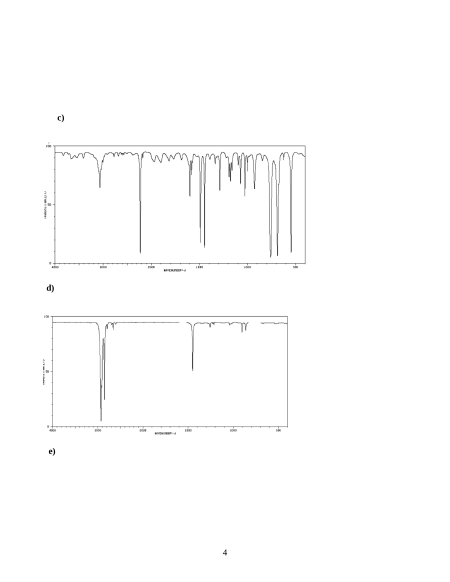
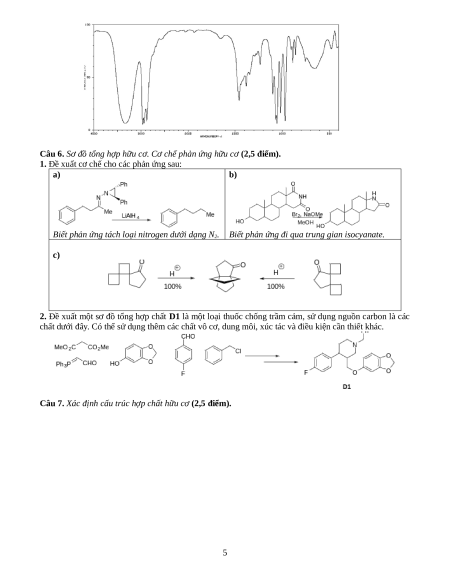
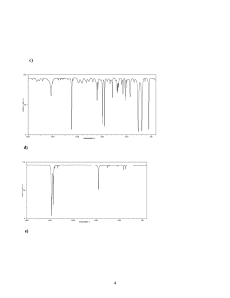
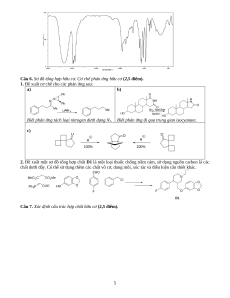
3. Xác định công thức cấu tạo các hợp chất tương ứng với từng phổ IR được cho dưới đây. Giải thích?
Cho 5 phổ đồ (a), (b), (c), (d), (e) sau đây: a) b) 3 c) d) e) 4
Đề thi HSG Hóa học 11 Trường THPT Chuyên Nguyễn Tất Thành - Yên Bái
559
280 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu Tổng hợp đề thi chọn học sinh giỏi Hóa học 11 của các trường THPT Chuyên khu vực Duyên hải và Đồng bằng Bắc Bộ gồm 27 đề đề xuất và 1 đề chính thức có lời giải giúp giáo viên, học sinh có thêm tài liệu tham khảo.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(559 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)