HỘI CÁC TRƯỜNG THPT CHUYÊN
KÌ THI HỌC SINH GIỎI NĂM 2024
VÙNG DUYÊN HẢI VÀ ĐỒNG BẰNG BẮC BỘ
MÔN THI: HOA HỌC LỚP 11
TRƯỜNGPTVÙNGCAO VIỆTBẮC
Thời gian làm bài: 180 phút ---------------------
(Đề thi gồm có 06 trang, gồm 08 câu)
ĐỀ THI ĐỀ XUẤTaa
Câu 1 (2,5 điểm) Tốc độ phản ứng
Sự phân hủy H2O2 được thúc đẩy với sự có mặt của ion Fe2+. Cơ chế phản ứng được đề nghị như sau: Fe2+ + H2O2
k1 Fe3+ + .OH + OH- (1) .OH + H . 2O2 k2 HO2 + H2O (2) HO .2 + H2O2
k3 H2O + O2 + .OH (3) Fe2+ + .OH k4 Fe3+ + OH- (4)
a. Hãy cho biết phản ứng tổng quát trong môi trường axit. Có thể coi Fe2+ là chất xúc
tác được không? Tại sao?
b. Thiết lập biểu thức tốc độ phản ứng phân hủy H2O2. Phản ứng này có bậc động học hay không?
c. Giả sử tại thời điểm ban đầu nồng độ Fe2+, H2O2 tương ứng bằng 0,2 M và 0,15 M.
Sau thời gian t, nồng độ Fe2+ còn 0,12 M. Tính tốc độ phản ứng tại thời điểm ban đầu và tại
thời điểm sau thời gian t (ở nhiệt độ không đổi) theo hằng số tốc độ k1, k2, k3 và k4.
Câu 2. (2,0 điểm) Cân bằng và phản ứng trong dung dịch, pin điện, điện phân
1. Hấp thụ hoàn toàn 0,020 mol khí H2S vào nước cất, thu được 200,0 mL dung dịch A.
a) Trộn 20,0 mL dung dịch A với 20,0 mL dung dịch FeCl2 0,02 M, thu được 40,0 mL
dung dịch B. Có kết tủa xuất hiện từ dung dịch B hay không?
b) Tính giá trị pH của dung dịch B để có thể tách được ion Fe2+ hoàn toàn ra khỏi
dung dịch dưới dạng kết tủa, biết rằng ion Fe2+ được coi là tách hoàn toàn ra khỏi dung dịch
khi tổng nồng độ còn lại của sắt(II) trong dung dịch là 10–6 M.
c) Để điều chỉnh pH của dung dịch B đến khi kết tủa hoàn toàn ion Fe2+ (nồng độ còn
lại của sắt(II) trong dung dịch là 10–6 M) ta có thể dùng dung dịch đệm axetat. Tiến hành như
sau: đầu tiên cho CH3COOH đặc vào 40,0 mL dung dịch B đến nồng độ 0,10 M; sau đó cho
từ từ CH3COONa vào dung dịch thu được đến khi kết tủa hoàn toàn Fe2+ thì hết m (gam).
Tính giá trị của m. Coi thể tích dung dịch không đổi sau khi cho thêm đệm axetat.
Cho biết: pKS(FeS) = 17,2; pKa1(H2S) = 7,02; pKa2(H2S) = 12,90; pKa(CH3COOH) = 4,76; *(FeOH+) = 10-5,92.
2. Cho hai pin điện hóa có sơ đồ:
Pin 1: Pt, H2 (1atm)/HCl (10-3M)/Hg2Cl2, Hg
Pin 2: Pt, H2 (1atm)/NaOH (10-3M), NaCl(10-3M)/Hg2Cl2, Hg
Suất điện động của các pin tương ứng là E1 và E2. Biết o E Hg Cl Hg 0,2682 (V). 2 2 /
a) Viết phương trình hóa học các nửa phản ứng xảy ra trên các điện cực và phản ứng
tổng cộng xảy ra khi các pin làm việc. Trang 1/6
b) Tính E1 và thiết lập mối liên hệ giữa E2 và Kw ở 25oC.
c) Nối hai điện cực hiđro của hai pin với nhau để tạo thành một pin kép. Ở 25oC, suất
điện động của pin này là 0,4726 V. Xác định Kw ở nhiệt độ này.
Câu 3: (2,5 điểm) Nhiệt, cân bằng hóa học
1. 14,224g iốt và 0,112g hiđro được chứa trong bình kín thể tích 1,12 lít ở nhiệt độ 4000C.
Tốc độ ban đầu của phản ứng là V0 = 9.10-5 mol .l-1. phút-1, sau một thời gian (ở thời điểm t)
nồng độ mol của HI là 0,04 mol/lít và khi phản ứng H2 + I2 2HI đạt cân bằng thì
HI= 0,06 mol/lít.
a. Tính hằng số tốc độ của phản ứng thuận và phản ứng nghịch.
b. Tốc độ phản ứng tạo thành HI tại thời điểm t là bao nhiêu?
2. Tính chất nhiệt động của một số phân tử và ion ở trạng thái tiêu chuẩn tại 250C như sau: C3H8 (k) O2(k) CO2(k) H2O (l) CO32-(aq.) OH- (aq.) H0s (kJmol-1) - 103,85 0 -393,51 -285,83 - 677,14 - 229,99 S0(J.K-1mol-1) 269,91 205,138 213,74 69,91 - 56,9 - 10,75
Xét quá trình oxi hoá bất thuận nghịch hoàn toàn 1 mol C3H8 (k) với O2 (k) tạo thành CO2 (k)
và H2O (l), phản ứng được tiến hành ở 250C, điều kiện tiêu chuẩn.
a. Tính H0, U0 ,S0, G0của phản ứng.
b. Tính S của môi trường và S tổng cộng của vũ trụ khi tiến hành quá trình.
Câu 4: (2,5 điểm) Hóa nguyên tố. Phức chất
1. Hợp chất X1 màu vàng, gồm 2 nguyên tố, hòa tan được hoàn toàn trong axit nitric đặc
khi đun nóng, giải phóng ra một chất khí có tỉ khối bằng 1,586 lần so với không khí. Khi
thêm bari clorua dư vào dung dịch thu được ở trên, một chất rắn màu trắng X2 được tách ra.
Lọc kết tủa. Phần nước lọc cho phản ứng với một lượng dư dung dịch bạc sunfat tạo thành
một kết tủa gồm hai chất rắn X2 và X3, chúng cũng được tách ra bằng cách lọc. Thêm từng
giọt dung dịch natri hiđroxit vào phần nước lọc mới thu được sau khi tách hai chất rắn trên
đến khi dung dịch có môi trường gần như trung tính (pH khoảng bằng 7). Tại thời điểm này
một chất bột màu vàng X4 (trong đó Ag chiếm 77,31 % về khối lượng) được tách ra từ dung
dịch. Khối lượng của X4 lớn hơn so với khối lượng của X2 trong phần kết tủa đầu tiên gần
2,4 lần.a.XácđịnhcôngthứchóahọccủacácchấttừX1đếnX4.
b. Xác định công thức hóa học của chất khí thoát ra. Viết và cân bằng các phương
trình hóa học ở dạng ion hoặc dạng phân tử của tất cả các phản ứng xảy ra.
c. Trong một đơn vị cấu trúc của X1, cấu trúc tạo bởi các nguyên tử có tính đối xứng.
Vẽ cấu trúc của X1.
2. Kim loại đồng đã được sử dụng để tạo công cụ lao động từ 8000 năm trước công
nguyên. Đến ngày nay đồng và các hợp chất, đặc biệt phức chất của đồng đã được nghiên
cứu ứng dụng trong rất nhiều lĩnh vực. Trong các phức chất, ion Cu(II) thường tạo số phối trí 4 hoặc 6. Trang 2/6
a. Sử dụng thuyết VB, mô tả các liên kết hình thành trong phức [CuCl4]2– và
[Cu(CN)4]2–. Biết [CuCl4]2– có cấu trúc tử diện, [Cu(CN)4]2– là phức vuông phẳng.
b. Dung dịch CuCl2 đặc có màu xanh lá cây, khi pha loãng,
màu sắc chuyển dần sang xanh nước biển. Hãy sử dụng thuyết
trường tinh thể giải thích hiện tượng trên.
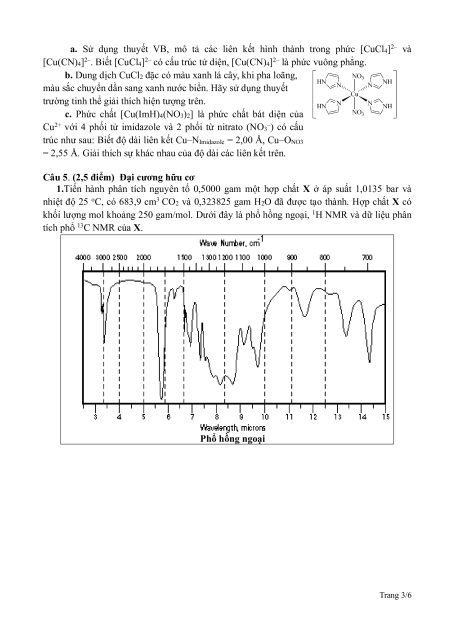
c. Phức chất [Cu(ImH)4(NO3)2] là phức chất bát diện của
Cu2+ với 4 phối tử imidazole và 2 phối từ nitrato (NO3–) có cấu
trúc như sau: Biết độ dài liên kết Cu–NImidazole = 2,00 Å, Cu–ONO3
= 2,55 Å. Giải thích sự khác nhau của độ dài các liên kết trên.
Câu 5. (2,5 điểm) Đại cương hữu cơ
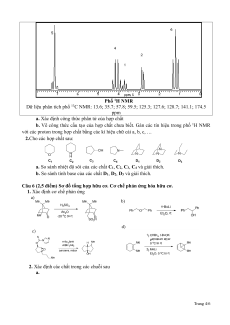
1.Tiến hành phân tích nguyên tố 0,5000 gam một hợp chất X ở áp suất 1,0135 bar và
nhiệt độ 25 oC, có 683,9 cm3 CO2 và 0,323825 gam H2O đã được tạo thành. Hợp chất X có
khối lượng mol khoảng 250 gam/mol. Dưới đây là phổ hồng ngoại, 1H NMR và dữ liệu phân
tích phổ 13C NMR của X. Phổ hồng ngoại Trang 3/6 Phổ 1H NMR
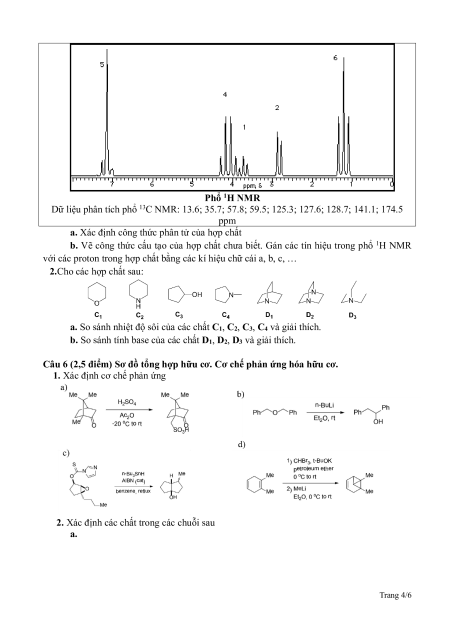
Dữ liệu phân tích phổ 13C NMR: 13.6; 35.7; 57.8; 59.5; 125.3; 127.6; 128.7; 141.1; 174.5 ppm
a. Xác định công thức phân tử của hợp chất
b. Vẽ công thức cấu tạo của hợp chất chưa biết. Gán các tín hiệu trong phổ 1H NMR
với các proton trong hợp chất bằng các kí hiệu chữ cái a, b, c, …
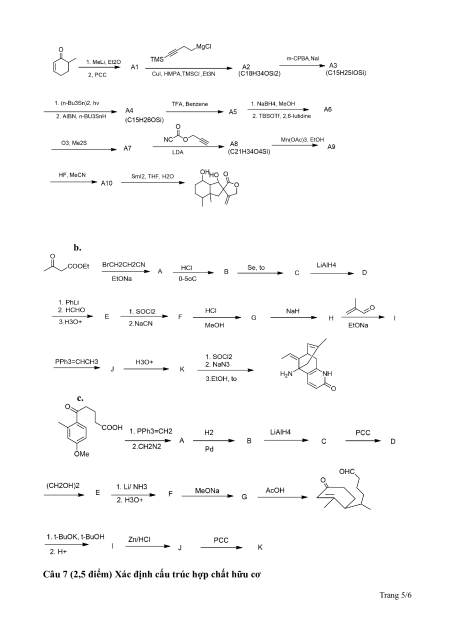
2.Cho các hợp chất sau:
a. So sánh nhiệt độ sôi của các chất C1, C2, C3, C4 và giải thích.
b. So sánh tính base của các chất D1, D2, D3 và giải thích.
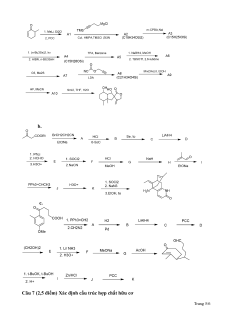
Câu 6 (2,5 điểm) Sơ đồ tổng hợp hữu cơ. Cơ chế phản ứng hóa hữu cơ.
1. Xác định cơ chế phản ứng
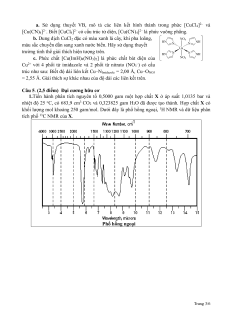
2. Xác định các chất trong các chuỗi sau a. Trang 4/6
Đề thi HSG Hóa học 11 Trường THPT Vùng cao Việt Bắc
415
208 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu Tổng hợp đề thi chọn học sinh giỏi Hóa học 11 của các trường THPT Chuyên khu vực Duyên hải và Đồng bằng Bắc Bộ gồm 27 đề đề xuất và 1 đề chính thức có lời giải giúp giáo viên, học sinh có thêm tài liệu tham khảo.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(415 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)