SỞ GIÁO DỤC VÀ ĐÀO TẠO KÌ THI TUYỂN SINH VÀO LỚP 10 THPT THÀNH PHỐ CẦN THƠ NĂM HỌC 2023 ĐỀ CHÍNH THỨC
MÔN: HÓA HỌC (CHUYÊN)
Thời gian làm bài: 150 phút
Các thể tích khí đều đo ở điều kiện tiêu chuẩn; giả thiết các khí sinh ra không tan trong nước. Câu 1. (2,0 điểm)
1.1. Xác định các chất X1, X2, X3, X4 và viết các phương trình hóa học (ghi rõ điều
kiện xảy ra, nếu có) của các phản ứng theo sơ đồ sau:
1.2. Nêu hiện tượng quan sát được và viết các phương trình hóa học của các phản ứng
xảy ra (nếu có) khi tiến hành các thí nghiệm sau:
a. Cho một ít bột Mg vào dung dịch KHSO4.
b. Cho từ từ đến dư dung dịch Ba(OH)2 vào dung dịch Al2(SO4)3.
c. Đun nóng ống nghiệm chứa nước ép quả nho chín và dung dịch bạc nitrat trong amoniac.
d. Đốt cháy rượu etylic, dùng ống nghiệm úp phía trên ngọn lửa. Sau đó, rót nước vôi
trong vào ống nghiệm, lắc nhẹ. Câu 2. (1,5 điểm)
2.1. Hình vẽ sau mô tả thí nghiệm điều chế và thu khí clo trong phòng thí nghiệm.
a. Nêu vai trò của bình chứa dung dịch H2SO4 đặc và bông tẩm dung dịch NaOH.
Viết các phương trình hóa học của các phản ứng đã xảy ra.
b. Cho 3,95 gam KMnO4 tác dụng với lượng dư dung dịch HCl đặc thu được tối đa V
lít khí Cl2. Tính giá trị của V.
2.2. Giải thích các trường hợp sau và viết phương trình hóa học của các phản ứng xảy ra (nếu có):
a. Than hoạt tính được dùng làm mặt nạ phòng độc, làm chất khử màu, khử mùi, …
b. Khí hiđro được sử dụng làm nhiên liệu thay thế cho than đá, dầu mỏ, khí thiên nhiên, …
c. Cho canxi cacbua vào nước có pha sẵn vài giọt phenolphtalein, thu được dung dịch
màu hồng và thấy sủi bọt khí.
d. Cho bột NaHCO3 vào cốc thủy tinh đựng dung dịch CH3COOH. Nghiêng miệng
cốc về phía ngọn nến nhỏ đang cháy thì ngọn nến bị tắt. Câu 3. (2,5 điểm)
3.1. Đốt nóng m gam bột Fe trong không khí, thu được hỗn hợp A gồm ba oxit. Hòa
tan hoàn toàn A bằng dung dịch HCl, thu được dung dịch D chỉ chứa hai muối. Cho
lượng dư dung dịch AgNO3 vào D, sau khi các phản ứng xảy ra hoàn toàn, thu được
20,46 gam chất rắn E. Mặt khác, dung dịch D có khả năng hòa tan tối đa 0,64 gam Cu. Tính giá trị m.
3.2. Thủy phân 270 gam tinh bột bằng dung dịch H2SO4 loãng, đun nóng (hiệu suất
phản ứng là 72%), thu được dung dịch X. Trung hòa toàn bộ X bằng dung dịch
NaHCO3 vừa đủ, thu được dung dịch Y. Thực hiện phản ứng lên men toàn bộ Y với
hiệu suất 75%, thu được V ml dung dịch rượu etylic 40o. Biết khối lượng riêng của
rượu etylic nguyên chất là 0,8 g/ml. Nếu đem toàn bộ lượng rượu này lên men giấm
với hiệu suất H% thì thu được 1,5 lít dung dịch Z (giả sử chỉ xảy ra phản ứng lên men
giấm). Để trung hòa 10 ml dung dịch Z, cần vừa đủ 14,4 ml dung dịch NaOH 0,5M.
Tính giá trị của V và H. Câu 4. (2,0 điểm)
4.1. Hỗn hợp X gồm metan, etilen và axetilen. Đốt cháy hoàn toàn 9,6 gam X bằng
lượng oxi vừa đủ, thu được hỗn hợp Y. Dẫn toàn bộ Y vào bình đựng dung dịch
NaOH, thu được dung dịch chỉ chứa 74,2 gam Na2CO3. Khi sục từ từ 11,2 lít X vào
dung dịch brom dư thì có tối đa 100 gam brom phản ứng. Tính phần trăm thể tích của các chất trong X.
4.2. Đốt cháy 11,075 gam trieste T trong không khí, rồi hấp thụ toàn bộ sản phẩm
cháy vào bình đựng dung dịch nước vôi trong dư, thu được 71,25 gam kết tủa, đồng
thời khối lượng dung dịch giảm 27,975 gam so với ban đầu. Mặt khác, đun nóng
26,58 gam T với 17,1 ml dung dịch NaOH 20% (có khối lượng riêng bằng 1,2 g/ml),
thu được glixerol và m gam hỗn hợp muối của axit béo. Biết các phản ứng đều xảy ra
hoàn toàn và số mol NaOH dùng dư a% so với lượng phản ứng. Tính giá trị của m và a. Câu 5. (2,0 điểm)
5.1. Nung nóng 20 gam một mẩu quặng malachit có thành phần chính là
Cu(OH)2.CuCO3 (còn lại là tạp chất trơ) trong không khí. Hòa tan toàn bộ lượng CuO
thu được bằng dung dịch H2SO4 20% vừa đủ, sau đó làm lạnh dung dịch đến 10oC thì
có 24,6 gam tinh thể CuSO4.5H2O tách ra. Biết các phản ứng đều xảy ra hoàn toàn và
độ tan của CuSO4 ở 10oC là 17,4 gam. Tính hàm lượng phần trăm của
Cu(OH)2.CuCO3 có trong mẩu quặng.
5.2. Hỗn hợp E gồm Al, FexOy và CuO, trong đó tỉ lệ khối lượng của FexOy và CuO
tương ứng là 29:35. Nung nóng m gam E trong bình kín (không có không khí), thu
được hỗn hợp Z. Cho toàn bộ Z tác dụng với lượng dư dung dịch NaOH, thu được
0,336 lít khí H2 và còn lại 3,92 gam hỗn hợp rắn T. Hòa tan 3,92 gam T bằng lượng
dư dung dịch H2SO4 đặc, nóng, thu được V lít khí SO2 (sản phẩm khử duy nhất). Hấp
thụ toàn bộ V lít khí SO2 vào 120 ml dung dịch Ba(OH)2 0,5M thu được 8,68 gam kết
tủa. Biết các phản ứng xảy ra hoàn toàn. Xác định công thức FexOy và tính phần trăm
khối lượng của Al có trong E. ---------Hết---------
Ghi chú: Thí sinh không được sử dụng tài liệu ngoại trừ Bảng tuần hoàn các
nguyên tố hóa học.
Cán bộ coi thi không giải thích gì thêm.
Họ và tên thí sinh: …………………………….
Số báo danh: ……………………………………
Chữ kí cán bộ coi thi 1: ……………………….
Chữ kí cán bộ coi thi 2: …………………………
Đề thi vào 10 môn Hóa học năm 2023 - Trường THPT Chuyên Cần Thơ
3.1 K
1.5 K lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Đề thi được cập nhật liên tục trong gói này từ nay đến hết tháng 6/2023. Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu bộ 29 đề thi vào 10 chuyên Hóa học có lời giải chi tiết, mới nhất năm 2022 - 2023 nhằm giúp Giáo viên có thêm tài liệu tham khảo ra đề thi môn Hóa học ôn vào 10.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(3065 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Ôn vào 10
Xem thêmTài liệu bộ mới nhất

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
SỞ GIÁO DỤC VÀ ĐÀO TẠO
THÀNH PHỐ CẦN THƠ
KÌ THI TUYỂN SINH VÀO LỚP 10 THPT
NĂM HỌC 2023
ĐỀ CHÍNH THỨC MÔN: HÓA HỌC (CHUYÊN)
Thời gian làm bài: 150 phút
Các thể tích khí đều đo ở điều kiện tiêu chuẩn; giả thiết các khí sinh ra không tan
trong nước.
Câu 1. (2,0 điểm)
1.1. Xác định các chất X
1
, X
2
, X
3
, X
4
và viết các phương trình hóa học (ghi rõ điều
kiện xảy ra, nếu có) của các phản ứng theo sơ đồ sau:
1.2. Nêu hiện tượng quan sát được và viết các phương trình hóa học của các phản ứng
xảy ra (nếu có) khi tiến hành các thí nghiệm sau:
a. Cho một ít bột Mg vào dung dịch KHSO
4
.
b. Cho từ từ đến dư dung dịch Ba(OH)
2
vào dung dịch Al
2
(SO
4
)
3
.
c. Đun nóng ống nghiệm chứa nước ép quả nho chín và dung dịch bạc nitrat trong
amoniac.
d. Đốt cháy rượu etylic, dùng ống nghiệm úp phía trên ngọn lửa. Sau đó, rót nước vôi
trong vào ống nghiệm, lắc nhẹ.
Câu 2. (1,5 điểm)
2.1. Hình vẽ sau mô tả thí nghiệm điều chế và thu khí clo trong phòng thí nghiệm.
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
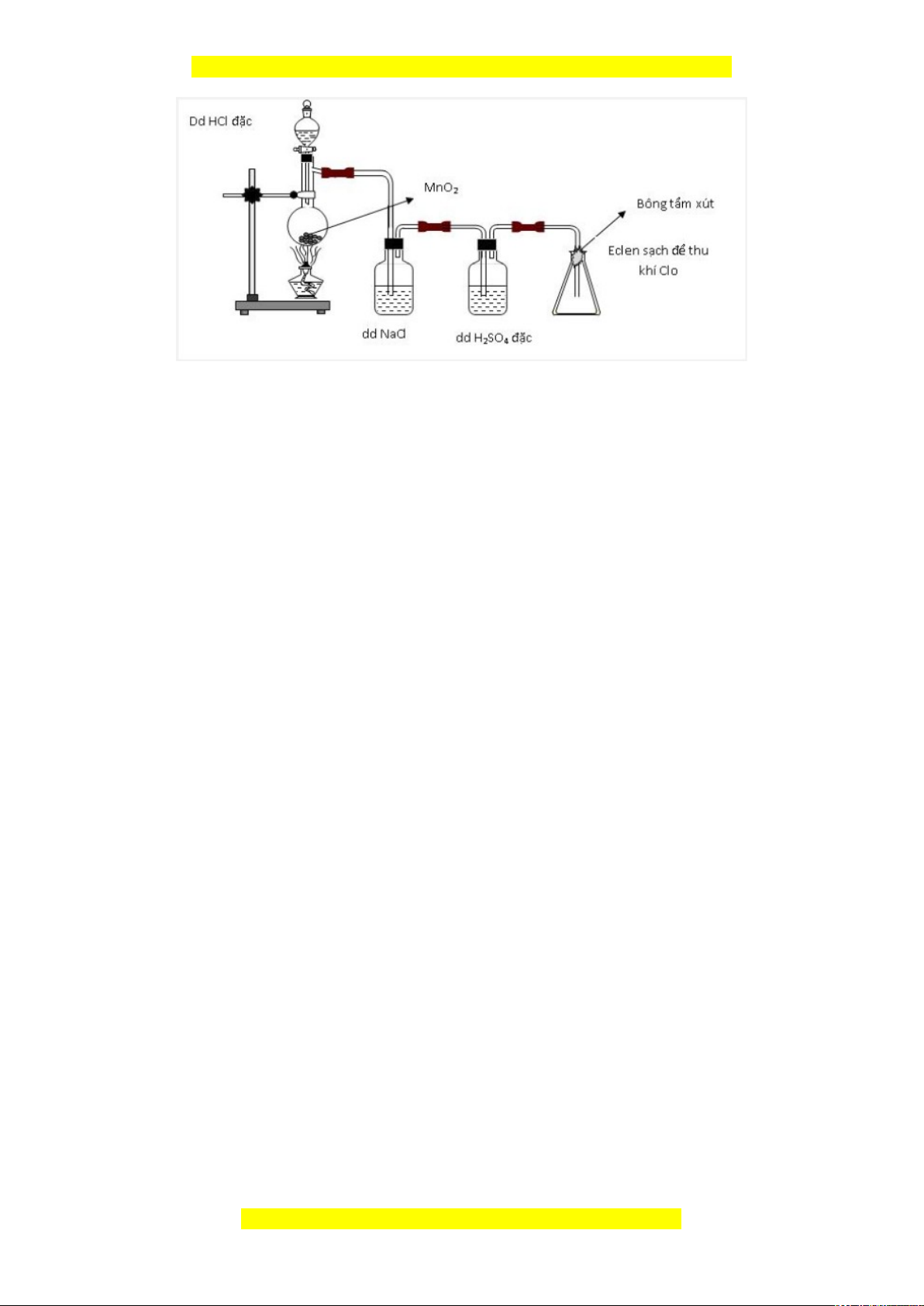
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
a. Nêu vai trò của bình chứa dung dịch H
2
SO
4
đặc và bông tẩm dung dịch NaOH.
Viết các phương trình hóa học của các phản ứng đã xảy ra.
b. Cho 3,95 gam KMnO
4
tác dụng với lượng dư dung dịch HCl đặc thu được tối đa V
lít khí Cl
2
. Tính giá trị của V.
2.2. Giải thích các trường hợp sau và viết phương trình hóa học của các phản ứng xảy
ra (nếu có):
a. Than hoạt tính được dùng làm mặt nạ phòng độc, làm chất khử màu, khử mùi, …
b. Khí hiđro được sử dụng làm nhiên liệu thay thế cho than đá, dầu mỏ, khí thiên
nhiên, …
c. Cho canxi cacbua vào nước có pha sẵn vài giọt phenolphtalein, thu được dung dịch
màu hồng và thấy sủi bọt khí.
d. Cho bột NaHCO
3
vào cốc thủy tinh đựng dung dịch CH
3
COOH. Nghiêng miệng
cốc về phía ngọn nến nhỏ đang cháy thì ngọn nến bị tắt.
Câu 3. (2,5 điểm)
3.1. Đốt nóng m gam bột Fe trong không khí, thu được hỗn hợp A gồm ba oxit. Hòa
tan hoàn toàn A bằng dung dịch HCl, thu được dung dịch D chỉ chứa hai muối. Cho
lượng dư dung dịch AgNO
3
vào D, sau khi các phản ứng xảy ra hoàn toàn, thu được
20,46 gam chất rắn E. Mặt khác, dung dịch D có khả năng hòa tan tối đa 0,64 gam
Cu. Tính giá trị m.
3.2. Thủy phân 270 gam tinh bột bằng dung dịch H
2
SO
4
loãng, đun nóng (hiệu suất
phản ứng là 72%), thu được dung dịch X. Trung hòa toàn bộ X bằng dung dịch
NaHCO
3
vừa đủ, thu được dung dịch Y. Thực hiện phản ứng lên men toàn bộ Y với
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
hiệu suất 75%, thu được V ml dung dịch rượu etylic 40
o
. Biết khối lượng riêng của
rượu etylic nguyên chất là 0,8 g/ml. Nếu đem toàn bộ lượng rượu này lên men giấm
với hiệu suất H% thì thu được 1,5 lít dung dịch Z (giả sử chỉ xảy ra phản ứng lên men
giấm). Để trung hòa 10 ml dung dịch Z, cần vừa đủ 14,4 ml dung dịch NaOH 0,5M.
Tính giá trị của V và H.
Câu 4. (2,0 điểm)
4.1. Hỗn hợp X gồm metan, etilen và axetilen. Đốt cháy hoàn toàn 9,6 gam X bằng
lượng oxi vừa đủ, thu được hỗn hợp Y. Dẫn toàn bộ Y vào bình đựng dung dịch
NaOH, thu được dung dịch chỉ chứa 74,2 gam Na
2
CO
3
. Khi sục từ từ 11,2 lít X vào
dung dịch brom dư thì có tối đa 100 gam brom phản ứng. Tính phần trăm thể tích của
các chất trong X.
4.2. Đốt cháy 11,075 gam trieste T trong không khí, rồi hấp thụ toàn bộ sản phẩm
cháy vào bình đựng dung dịch nước vôi trong dư, thu được 71,25 gam kết tủa, đồng
thời khối lượng dung dịch giảm 27,975 gam so với ban đầu. Mặt khác, đun nóng
26,58 gam T với 17,1 ml dung dịch NaOH 20% (có khối lượng riêng bằng 1,2 g/ml),
thu được glixerol và m gam hỗn hợp muối của axit béo. Biết các phản ứng đều xảy ra
hoàn toàn và số mol NaOH dùng dư a% so với lượng phản ứng. Tính giá trị của m và
a.
Câu 5. (2,0 điểm)
5.1. Nung nóng 20 gam một mẩu quặng malachit có thành phần chính là
Cu(OH)
2
.CuCO
3
(còn lại là tạp chất trơ) trong không khí. Hòa tan toàn bộ lượng CuO
thu được bằng dung dịch H
2
SO
4
20% vừa đủ, sau đó làm lạnh dung dịch đến 10
o
C thì
có 24,6 gam tinh thể CuSO
4
.5H
2
O tách ra. Biết các phản ứng đều xảy ra hoàn toàn và
độ tan của CuSO
4
ở 10
o
C là 17,4 gam. Tính hàm lượng phần trăm của
Cu(OH)
2
.CuCO
3
có trong mẩu quặng.
5.2. Hỗn hợp E gồm Al, Fe
x
O
y
và CuO, trong đó tỉ lệ khối lượng của Fe
x
O
y
và CuO
tương ứng là 29:35. Nung nóng m gam E trong bình kín (không có không khí), thu
được hỗn hợp Z. Cho toàn bộ Z tác dụng với lượng dư dung dịch NaOH, thu được
0,336 lít khí H
2
và còn lại 3,92 gam hỗn hợp rắn T. Hòa tan 3,92 gam T bằng lượng
dư dung dịch H
2
SO
4
đặc, nóng, thu được V lít khí SO
2
(sản phẩm khử duy nhất). Hấp
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
thụ toàn bộ V lít khí SO
2
vào 120 ml dung dịch Ba(OH)
2
0,5M thu được 8,68 gam kết
tủa. Biết các phản ứng xảy ra hoàn toàn. Xác định công thức Fe
x
O
y
và tính phần trăm
khối lượng của Al có trong E.
---------Hết---------
Ghi chú: Thí sinh không được sử dụng tài liệu ngoại trừ Bảng tuần hoàn các
nguyên tố hóa học.
Cán bộ coi thi không giải thích gì thêm.
Họ và tên thí sinh: …………………………….
Số báo danh: ……………………………………
Chữ kí cán bộ coi thi 1: ……………………….
Chữ kí cán bộ coi thi 2: …………………………
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
GIẢI ĐỀ THI TUYỂN SINH VÀO LỚP 10 THPT CHUYÊN
THÀNH PHỐ CẦN THƠ NĂM HỌC 2022 – 2023
MÔN: HÓA HỌC (CHUYÊN)
Câu 1. (2,0 điểm)
1.1. Xác định các chất X
1
, X
2
, X
3
, X
4
và viết các phương trình hóa học (ghi rõ điều
kiện xảy ra, nếu có) của các phản ứng theo sơ đồ sau:
1.2. Nêu hiện tượng quan sát được và viết các phương trình hóa học của các phản ứng
xảy ra (nếu có) khi tiến hành các thí nghiệm sau:
a. Cho một ít bột Mg vào dung dịch KHSO
4
.
b. Cho từ từ đến dư dung dịch Ba(OH)
2
vào dung dịch Al
2
(SO
4
)
3
.
c. Đun nóng ống nghiệm chứa nước ép quả nho chín và dung dịch bạc nitrat trong
amoniac.
d. Đốt cháy rượu etylic, dùng ống nghiệm úp phía trên ngọn lửa. Sau đó, rót nước vôi
trong vào ống nghiệm, lắc nhẹ.
Hướng dẫn giải
1.1
Ta có: X
1
: CH
3
COOH; X
2
: CO; X
3
: CuSO
4
; X
4
: Fe(OH)
3
.
Phương trình hóa học:
C
4
H
10
+ O
2
2CH
3
COOH + H
2
O
CH
3
COOH + C
2
H
5
OH CH
3
COOC
2
H
5
+ H
2
O
CH
3
COOC
2
H
5
+ 5O
2
4CO
2
+ 4H
2
O
CO
2
+ C 2CO
CO + CuO Cu + CO
2
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85






















