SỞ GIÁO DỤC & ĐÀO TẠO
KỲ THI TUYỂN SINH VÀO LỚP 10 GIA LAI
TRƯỜNG THPT CHUYÊN HÙNG VƯƠNG Năm học 2023 ĐỀ CHÍNH THỨC Môn thi: HÓA HỌC
(Đề thi có 02 trang)
Thời gian làm bài: 120 phút (không kể thời gian phát đề)
Câu 1. (2,0 điểm)
1.1. Cho chuỗi phản ứng sau (mỗi mũi tên ứng với một phương trình hóa học): C2H4 C2H5OH CH3COOH CH3COOC2H5 CH3COONa CH4
Viết phương trình hóa học thực hiện chuỗi phản ứng trên (ghi rõ điều kiện nếu có).
1.2. Viết công thức phân tử của các chất ứng với các kí hiệu X1, X2, X3, X4, X5 và
hoàn thành phương trình hoá học của các sơ đồ phản ứng sau: X1 + H2O X2 + X3↑ + H2↑ X2 + X4 BaCO3↓+ Na2CO3 + H2O X2 + X3 X1 + NaClO + H2O X4 + X5 BaSO4↓ + CO2↓ + H2O
Câu 2. (1,5 điểm)
2.1. Hỗn hợp X gồm MgO, Al2O3, Fe3O4, CuO. Cho khí CO dư qua X nung nóng
được chất rắn Y. Hòa tan Y vào dung dịch KOH dư được dung dịch Z và chất rắn T.
Hoà tan chất rắn T vào dung dịch H2SO4 loãng dư. Cho dung dịch HCl đến dư vào
dung dịch Z thấy xuất hiện kết tủa, sau đó kết tủa tan dần đến hết. Viết phương trình
hóa học của các phản ứng xảy ra (ghi rõ điều kiện phản ứng nếu có), biết các phản ứng xảy ra hoàn toàn.
2.2. Hình vẽ bên là thiết bị điều chế khí Y
trong phòng thí nghiệm. Khí Y có thể là khi
nào trong 2 khí sau: metan, axetilen. Biết khí
Y làm mất màu dung dịch brom.
- Xác định công thức cấu tạo của Y.
- Viết phương trình điều chế Y, phản ứng
hóa học Y tác dụng với dung dịch brom dư.
Câu 3. (2,0 điểm)
3.1. Hòa tan hoàn toàn 28,4 gam hỗn hợp X gồm MgCO3 và muối cacbonat của kim
loại M bằng lượng vừa đủ dung dịch HCl 7,3% thu được dung dịch Y và 6,72 lít khí
CO2 (ở điều kiện tiêu chuẩn). Thêm 64,8 gam nước vào dung dịch Y được dung dịch
Z. Nồng độ của MgCl2 trong dung dịch Z là 5%. Xác định công thức muối cacbonat
và tính thành phần phần trăm theo khối lượng của mỗi chất trong hỗn hợp X.
3.2. Hòa tan hoàn toàn m gam hỗn hợp X gồm Al, Al2O3, Al(OH)3 vào dung dịch
H2SO4 loãng 20% (vừa đủ) thu được 140 gam dung dịch Y chỉ chứa muối trung hòa
có nồng độ 21,375% và 2,52 lít H2 (ở điều kiện tiêu chuẩn). Viết phương trình hóa
học của các phản ứng xảy ra và tính giá trị của m.
Câu 4. (1,5 điểm)
Hỗn hợp X gồm hai hiđrocacbon (CnH2n+2 với n 1; CmH2m-2 với m 2). Đốt cháy hoàn
toàn hỗn hợp X cần dùng vừa đủ 12,88 lít khí O2 (ở điều kiện tiêu chuẩn) thì thu được
hỗn hợp Y gồm CO2 và 6,3 gam H2O, biết thể tích khí CO2 bằng thể tích hỗn hợp
X (các khí đều đo cùng điều kiện nhiệt độ và áp suất). Dẫn toàn bộ Y nói trên vào
dung dịch Ca(OH)2 dư thu được m gam kết tủa và thấy khối lượng dung dịch giảm x
gam so với khối lượng dung dịch Ca(OH)2 ban đầu.
a) Xác định công thức phân tử của hai hiđrocacbon. b) Tính m, X.
Câu 5. (3,0 điểm)
5.1. Lên men m gam glucozơ thành rượu etylic với hiệu suất phản ứng 90%. Hấp thụ
toàn bộ khí CO2 sinh ra vào dung dịch Ba(OH)2, thu được 98,5 gam kết tủa và dung
dịch X. Cho từ từ dung dịch NaOH vào dung dịch X, đến khi kết tủa lớn nhất thì cần
ít nhất 100 ml dung dịch NaOH 1M. Tính giá trị của m.
5.2. Hòa tan m gam hỗn hợp X gồm FeO, Fe3O4, Fe(OH)2, FeCO3 (trong đó số mol
Fe3O4 bằng tổng số mol hỗn hợp) vào dung dịch H2SO4 đặc, nóng dư, khi phản
ứng xảy ra hoàn toàn thu được dung dịch Y chứa (m + 104,4) gam muối sunfat và
10,08 lít hỗn hợp khí Z (ở điều kiện tiêu chuẩn) gồm CO2 và SO2 (sản phẩm khử duy
nhất), Z có tỉ khối so với khí hiđro bằng
. Viết phương trình hóa học của các phản
ứng xảy ra và tính giá trị của m.
5.3. Nhúng một thanh sắt nặng 110 gam vào 200 ml dung dịch hỗn hợp gồm
Cu(NO3)2 0,1M và AgNO3 0,1M. Sau một thời gian lấy thanh kim loại ra, rửa sạch
làm khô cân được 111,72 gam (giả thiết các kim loại tạo thành đều bám hết vào thanh
sắt). Tính khối lượng sắt tham gia phản ứng (biết rằng trong dung dịch không xảy ra
phản ứng tạo muối Fe(NO3)3).
Cho nguyên tử khối: C = 12; H = 1; O = 16; N = 14; Na = 23; K = 39; Ba = 137;
Ca = 40; Mg = 24; Si = 28; Al = 27; Fe = 56; Cu = 64; Ag = 108; Cl = 35,5; S = 32.
----------------HẾT-----------------
- Thí sinh không được sử dụng bảng Hệ thống tuần hoàn các nguyên tố hóa học
- Cán bộ coi thi không giải thích gì thêm.
HƯỚNG DẪN GIẢI ĐỀ THI TUYỂN SINH VÀO LỚP 10
TRƯỜNG THPT CHUYÊN HÙNG VƯƠNG – TỈNH GIA LAI Năm học 2022 - 2023 Môn thi: HÓA HỌC
Câu 1. (2,0 điểm)
1.1. Cho chuỗi phản ứng sau (mỗi mũi tên ứng với một phương trình hóa học): C2H4 C2H5OH CH3COOH CH3COOC2H5 CH3COONa CH4
Viết phương trình hóa học thực hiện chuỗi phản ứng trên (ghi rõ điều kiện nếu có).
1.2. Viết công thức phân tử của các chất ứng với các kí hiệu X1, X2, X3, X4, X5 và
hoàn thành phương trình hoá học của các sơ đồ phản ứng sau: X1 + H2O X2 + X3↑ + H2↑ X2 + X4 BaCO3↓+ Na2CO3 + H2O X2 + X3 X1 + NaClO + H2O X4 + X5 BaSO4↓ + CO2↓ + H2O Hướng dẫn giải:
1.1. Phương trình hóa học minh họa chuỗi phản ứng: (1) CH2 = CH2 + H2O CH3CH2OH (2) CH3CH2OH + O2 CH3COOH + H2O (3) CH3COOH + CH3CH2OH CH3COOCH2CH3 + H2O (4) CH3COOCH2CH3 + NaOH CH3COONa + H2O (5) CH3COONa + NaOH CH4↑ + Na2CO3
1.2. Các chất X1: NaCl; X2: NaOH; X3: Cl2; X4: Ba(HCO3)2; X5: H2SO4. (1) 2NaCl (X1) + 2H2O
2NaOH (X2) + Cl2↑ (X3) + H2↑
(2) 2NaOH + Ba(HCO3)2 (X4) → BaCO3↓ + Na2CO3 + 2H2O
Đề thi vào 10 môn Hóa học năm 2023 - Trường THPT Chuyên Hùng Vương
1.6 K
786 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Đề thi được cập nhật liên tục trong gói này từ nay đến hết tháng 6/2023. Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu bộ 29 đề thi vào 10 chuyên Hóa học có lời giải chi tiết, mới nhất năm 2022 - 2023 nhằm giúp Giáo viên có thêm tài liệu tham khảo ra đề thi môn Hóa học ôn vào 10.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(1571 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Ôn vào 10
Xem thêmTài liệu bộ mới nhất

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
SỞ GIÁO DỤC & ĐÀO TẠO
GIA LAI
(Đề thi có 02 trang)
KỲ THI TUYỂN SINH VÀO LỚP 10
TRƯỜNG THPT CHUYÊN HÙNG VƯƠNG
Năm học 2023
Môn thi: HÓA HỌC
Thời gian làm bài: 120 phút (không kể thời gian phát đề)
Câu 1. (2,0 điểm)
1.1. Cho chuỗi phản ứng sau (mỗi mũi tên ứng với một phương trình hóa học):
C
2
H
4
C
2
H
5
OH CH
3
COOH CH
3
COOC
2
H
5
CH
3
COONa
CH
4
Viết phương trình hóa học thực hiện chuỗi phản ứng trên (ghi rõ điều kiện nếu có).
1.2. Viết công thức phân tử của các chất ứng với các kí hiệu X
1
, X
2
, X
3
, X
4
, X
5
và
hoàn thành phương trình hoá học của các sơ đồ phản ứng sau:
X
1
+ H
2
O X
2
+ X
3
↑ + H
2
↑
X
2
+ X
4
BaCO
3
↓+ Na
2
CO
3
+ H
2
O
X
2
+ X
3
X
1
+ NaClO + H
2
O
X
4
+ X
5
BaSO
4
↓ + CO
2
↓ + H
2
O
Câu 2. (1,5 điểm)
2.1. Hỗn hợp X gồm MgO, Al
2
O
3
, Fe
3
O
4
, CuO. Cho khí CO dư qua X nung nóng
được chất rắn Y. Hòa tan Y vào dung dịch KOH dư được dung dịch Z và chất rắn T.
Hoà tan chất rắn T vào dung dịch H
2
SO
4
loãng dư. Cho dung dịch HCl đến dư vào
dung dịch Z thấy xuất hiện kết tủa, sau đó kết tủa tan dần đến hết. Viết phương trình
hóa học của các phản ứng xảy ra (ghi rõ điều kiện phản ứng nếu có), biết các phản
ứng xảy ra hoàn toàn.
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
ĐỀ CHÍNH THỨC
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
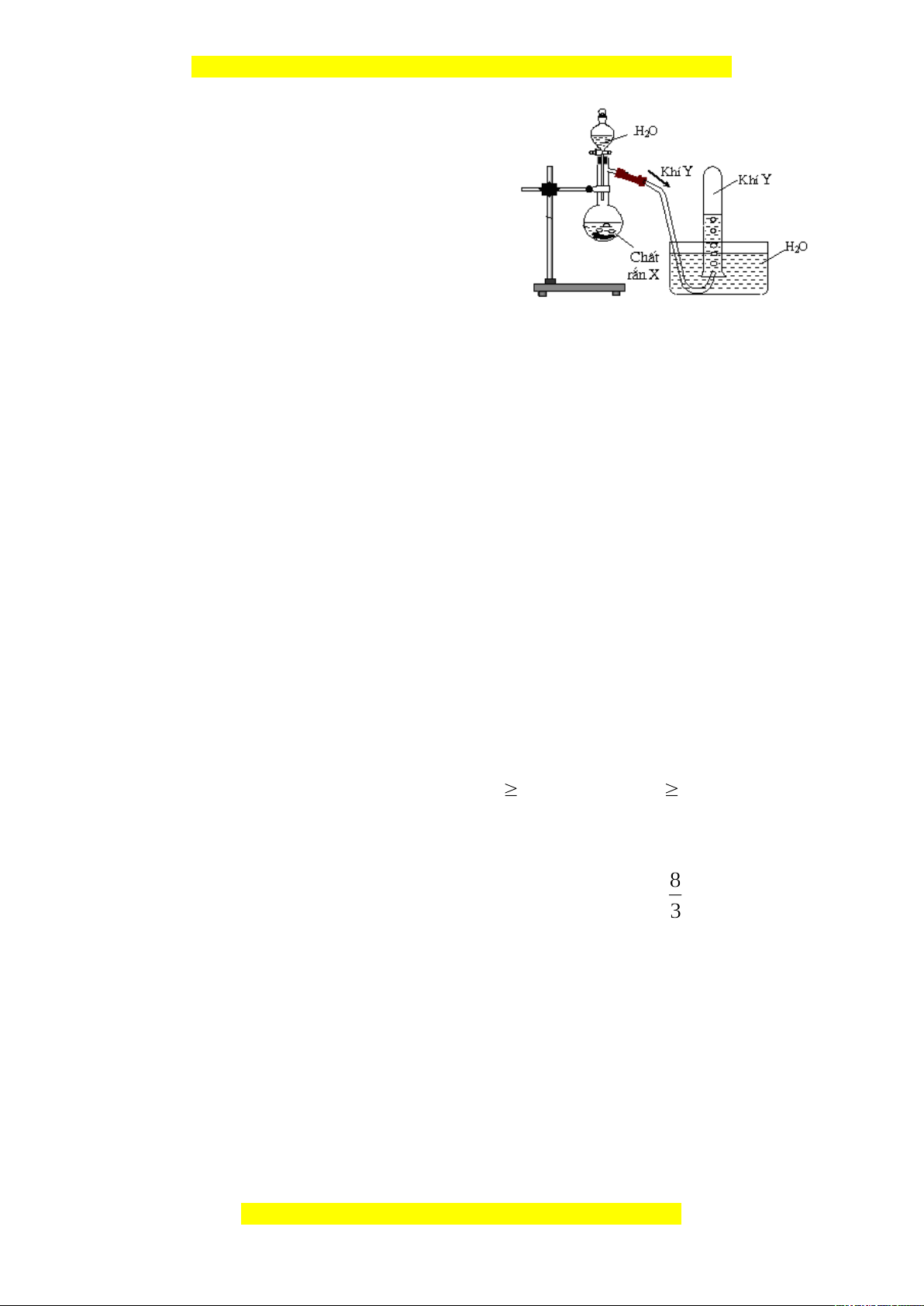
2.2. Hình vẽ bên là thiết bị điều chế khí Y
trong phòng thí nghiệm. Khí Y có thể là khi
nào trong 2 khí sau: metan, axetilen. Biết khí
Y làm mất màu dung dịch brom.
- Xác định công thức cấu tạo của Y.
- Viết phương trình điều chế Y, phản ứng
hóa học Y tác dụng với dung dịch brom dư.
Câu 3. (2,0 điểm)
3.1. Hòa tan hoàn toàn 28,4 gam hỗn hợp X gồm MgCO
3
và muối cacbonat của kim
loại M bằng lượng vừa đủ dung dịch HCl 7,3% thu được dung dịch Y và 6,72 lít khí
CO
2
(ở điều kiện tiêu chuẩn). Thêm 64,8 gam nước vào dung dịch Y được dung dịch
Z. Nồng độ của MgCl
2
trong dung dịch Z là 5%. Xác định công thức muối cacbonat
và tính thành phần phần trăm theo khối lượng của mỗi chất trong hỗn hợp X.
3.2. Hòa tan hoàn toàn m gam hỗn hợp X gồm Al, Al
2
O
3
, Al(OH)
3
vào dung dịch
H
2
SO
4
loãng 20% (vừa đủ) thu được 140 gam dung dịch Y chỉ chứa muối trung hòa
có nồng độ 21,375% và 2,52 lít H
2
(ở điều kiện tiêu chuẩn). Viết phương trình hóa
học của các phản ứng xảy ra và tính giá trị của m.
Câu 4. (1,5 điểm)
Hỗn hợp X gồm hai hiđrocacbon (C
n
H
2n+2
với n 1; C
m
H
2m-2
với m 2). Đốt cháy hoàn
toàn hỗn hợp X cần dùng vừa đủ 12,88 lít khí O
2
(ở điều kiện tiêu chuẩn) thì thu được
hỗn hợp Y gồm CO
2
và 6,3 gam H
2
O, biết thể tích khí CO
2
bằng thể tích hỗn hợp
X (các khí đều đo cùng điều kiện nhiệt độ và áp suất). Dẫn toàn bộ Y nói trên vào
dung dịch Ca(OH)
2
dư thu được m gam kết tủa và thấy khối lượng dung dịch giảm x
gam so với khối lượng dung dịch Ca(OH)
2
ban đầu.
a) Xác định công thức phân tử của hai hiđrocacbon.
b) Tính m, X.
Câu 5. (3,0 điểm)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
5.1. Lên men m gam glucozơ thành rượu etylic với hiệu suất phản ứng 90%. Hấp thụ
toàn bộ khí CO
2
sinh ra vào dung dịch Ba(OH)
2
, thu được 98,5 gam kết tủa và dung
dịch X. Cho từ từ dung dịch NaOH vào dung dịch X, đến khi kết tủa lớn nhất thì cần
ít nhất 100 ml dung dịch NaOH 1M. Tính giá trị của m.
5.2. Hòa tan m gam hỗn hợp X gồm FeO, Fe
3
O
4
, Fe(OH)
2
, FeCO
3
(trong đó số mol
Fe
3
O
4
bằng tổng số mol hỗn hợp) vào dung dịch H
2
SO
4
đặc, nóng dư, khi phản
ứng xảy ra hoàn toàn thu được dung dịch Y chứa (m + 104,4) gam muối sunfat và
10,08 lít hỗn hợp khí Z (ở điều kiện tiêu chuẩn) gồm CO
2
và SO
2
(sản phẩm khử duy
nhất), Z có tỉ khối so với khí hiđro bằng . Viết phương trình hóa học của các phản
ứng xảy ra và tính giá trị của m.
5.3. Nhúng một thanh sắt nặng 110 gam vào 200 ml dung dịch hỗn hợp gồm
Cu(NO
3
)
2
0,1M và AgNO
3
0,1M. Sau một thời gian lấy thanh kim loại ra, rửa sạch
làm khô cân được 111,72 gam (giả thiết các kim loại tạo thành đều bám hết vào thanh
sắt). Tính khối lượng sắt tham gia phản ứng (biết rằng trong dung dịch không xảy ra
phản ứng tạo muối Fe(NO
3
)
3
).
Cho nguyên tử khối: C = 12; H = 1; O = 16; N = 14; Na = 23; K = 39; Ba = 137;
Ca = 40; Mg = 24; Si = 28; Al = 27; Fe = 56; Cu = 64; Ag = 108; Cl = 35,5; S = 32.
----------------HẾT-----------------
- Thí sinh không được sử dụng bảng Hệ thống tuần hoàn các nguyên tố hóa học
- Cán bộ coi thi không giải thích gì thêm.
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
HƯỚNG DẪN GIẢI ĐỀ THI TUYỂN SINH VÀO LỚP 10
TRƯỜNG THPT CHUYÊN HÙNG VƯƠNG – TỈNH GIA LAI
Năm học 2022 - 2023
Môn thi: HÓA HỌC
Câu 1. (2,0 điểm)
1.1. Cho chuỗi phản ứng sau (mỗi mũi tên ứng với một phương trình hóa học):
C
2
H
4
C
2
H
5
OH CH
3
COOH CH
3
COOC
2
H
5
CH
3
COONa
CH
4
Viết phương trình hóa học thực hiện chuỗi phản ứng trên (ghi rõ điều kiện nếu có).
1.2. Viết công thức phân tử của các chất ứng với các kí hiệu X
1
, X
2
, X
3
, X
4
, X
5
và
hoàn thành phương trình hoá học của các sơ đồ phản ứng sau:
X
1
+ H
2
O X
2
+ X
3
↑ + H
2
↑
X
2
+ X
4
BaCO
3
↓+ Na
2
CO
3
+ H
2
O
X
2
+ X
3
X
1
+ NaClO + H
2
O
X
4
+ X
5
BaSO
4
↓ + CO
2
↓ + H
2
O
Hướng dẫn giải:
1.1. Phương trình hóa học minh họa chuỗi phản ứng:
(1) CH
2
= CH
2
+ H
2
O CH
3
CH
2
OH
(2) CH
3
CH
2
OH + O
2
CH
3
COOH + H
2
O
(3) CH
3
COOH + CH
3
CH
2
OH CH
3
COOCH
2
CH
3
+ H
2
O
(4) CH
3
COOCH
2
CH
3
+ NaOH CH
3
COONa + H
2
O
(5) CH
3
COONa + NaOH CH
4
↑ + Na
2
CO
3
1.2. Các chất X
1
: NaCl; X
2
: NaOH; X
3
: Cl
2
; X
4
: Ba(HCO
3
)
2
; X
5
: H
2
SO
4
.
(1) 2NaCl (X
1
) + 2H
2
O 2NaOH (X
2
) + Cl
2
↑ (X
3
) + H
2
↑
(2) 2NaOH + Ba(HCO
3
)
2
(X
4
) → BaCO
3
↓ + Na
2
CO
3
+ 2H
2
O
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
(3) 2NaOH + Cl
2
→ NaCl + NaClO + H
2
O
(4) Ba(HCO
3
)
2
+ H
2
SO
4
(X
5
) → BaSO
4
↓ + 2CO
2
↓ + 2H
2
O
Câu 2. (1,5 điểm)
2.1. Hỗn hợp X gồm MgO, Al
2
O
3
, Fe
3
O
4
, CuO. Cho khí CO dư qua X nung nóng
được chất rắn Y. Hòa tan Y vào dung dịch KOH dư được dung dịch Z và chất rắn T.
Hoà tan chất rắn T vào dung dịch H
2
SO
4
loãng dư. Cho dung dịch HCl đến dư vào
dung dịch Z thấy xuất hiện kết tủa, sau đó kết tủa tan dần đến hết. Viết phương trình
hóa học của các phản ứng xảy ra (ghi rõ điều kiện phản ứng nếu có), biết các phản
ứng xảy ra hoàn toàn.
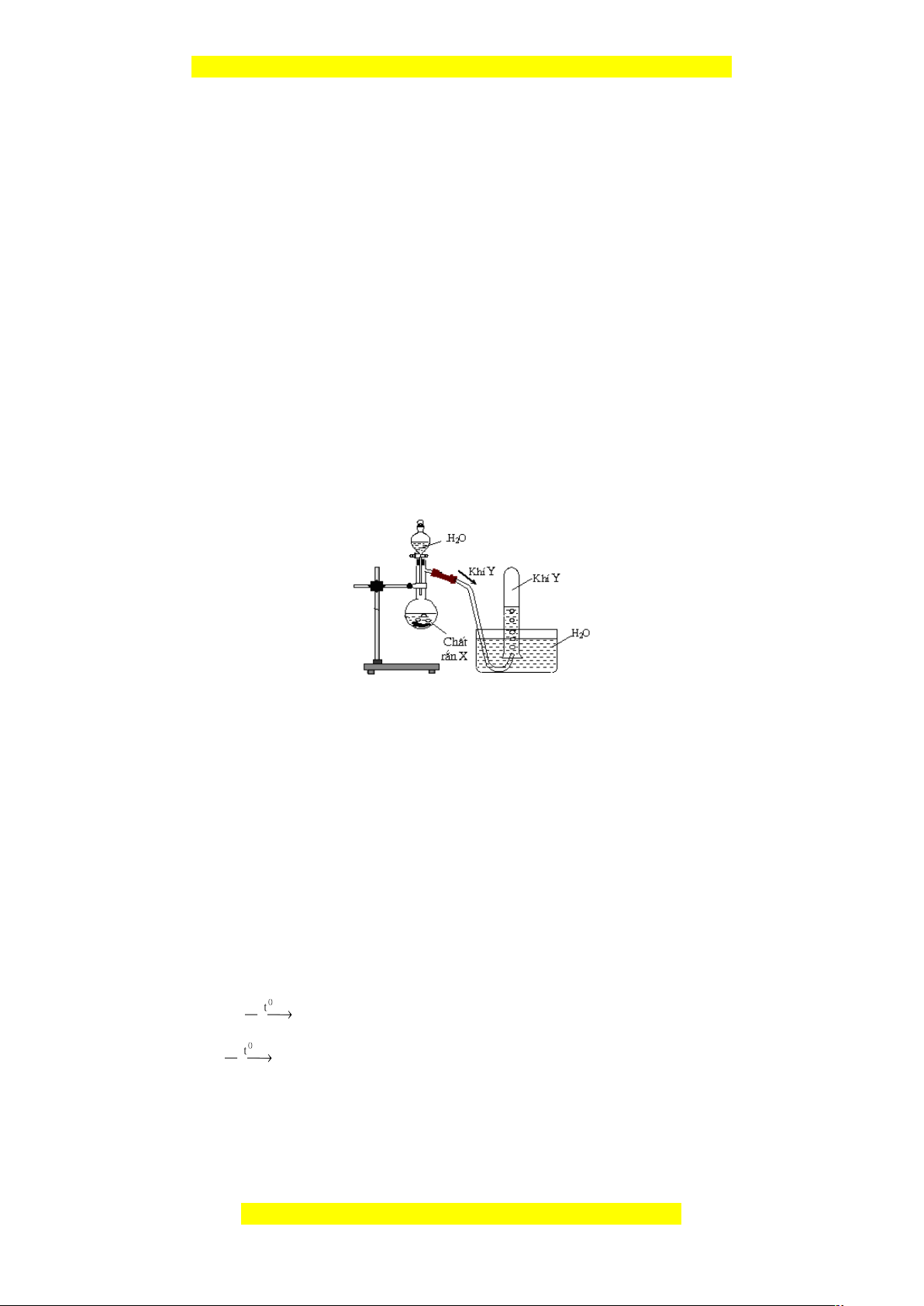
2.2. Hình vẽ bên là thiết bị điều chế khí Y trong phòng thí nghiệm.
Khí Y có thể là khi nào trong 2 khí sau: metan, axetilen. Biết khí Y làm mất màu
dung dịch brom.
- Xác định công thức cấu tạo của Y.
- Viết phương trình điều chế Y, phản ứng hóa học Y tác dụng với dung dịch brom dư.
Hướng dẫn giải:
2.1.
Các phương trình hóa học của phản ứng xảy ra:
- Cho khí CO dư qua X gồm MgO, Al
2
O
3
, Fe
3
O
4
, CuO.
(1) Fe
3
O
4
+ 4CO 3Fe + 4CO
2
(2) CuO + CO Cu + CO
2
- Chất rắn Y gồm gồm MgO, Al
2
O
3
, Fe, Cu tác dụng KOH dư được dung dịch Z và
chất rắn T
(3) Al
2
O
3
+ 2KOH → 2KAlO
2
+ H
2
O
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85






















