Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải) Trường:................... Họ và tên giáo viên:
Tổ:............................ ……………………
BÀI 5: AMMONIA-MUỐI AMMONIUM (1 tiết) I. MỤC TIÊU 1. Kiến thức:
- Mô tả được công thức Lewis và hình học phân tử của ammonia
– Dựa vào đặc điểm cấu tạo của phân tử ammonia, giải thích được tính chất vật lí (tính tan),
tính chất hoá học (tính base, tính khử). Viết được phương trình hoá học minh hoạ.
- Trình bày được tính chất cơ bản của muối ammonium (dễ tan và phân li, chuyển hóa thành
ammonia trong kiểm, dễ bị nhiệt phân) và nhận biết được ion ammonium trong dung dịch
– Vận dụng được kiến thức về cân bằng hoá học, tốc độ phản ứng, enthalpy cho phản ứng
tổng hợp ammonia từ nitrogen và hydrogen trong quá trình Haber. 2. Năng lực: * Năng lực chung:
- Năng lực tự chủ và tự học: Ap dụng kiến thức đã học (công thức Lewis, hình học phân tử,
tính tan, tính base, tính khử, cân bằng hoá học, tốc độ phản ứng, enthalpy ) để tìm hiểu tính
chất của ammonia, ammonium
- Năng lực giao tiếp và hợp tác: Làm việc nhóm tìm hiểu về tính chất của ammonia, ammonium
- Năng lực giải quyết vấn đề và sáng tạo: Giải thích được tính tan của ammonia, các điều
kiện phản ứng tổng hợp ammonia từ nitrogen và hydrogen trong quá trình Haber * Năng lực hóa học:
a. Nhận thức hoá học: Học sinh đạt được các yêu cầu sau:
- Mô tả được công thức Lewis và hình học phân tử của ammonia
– Dựa vào đặc điểm cấu tạo của phân tử ammonia, giải thích được tính chất vật lí (tính tan),
tính chất hoá học (tính base, tính khử). Viết được phương trình hoá học minh hoạ.
- Trình bày được tính chất cơ bản của muối ammonium (dễ tan và phân li, chuyển hóa thành
ammonia trong kiểm, dễ bị nhiệt phân)
– Vận dụng được kiến thức về cân bằng hoá học, tốc độ phản ứng, enthalpy cho phản ứng
tổng hợp ammonia từ nitrogen và hydrogen trong quá trình Haber.
b. Tìm hiểu tự nhiên dưới góc độ hóa học :
- Nhận biết được ion ammonium trong dung dịch
- Thực hiện được (hoặc quan sát video) thí nghiệm nhận biết được ion ammonium trong
phân đạm chứa ion ammonium.
c. Vận dụng kiến thức, kĩ năng đã học:
-Trình bày được ứng dụng của ammonia (chất làm lạnh; sản xuất phân bón như: đạm,
ammophos; sản xuất nitric acid; làm dung môi...); của ammonium nitrate và một số muối
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
ammonium tan như: phân đạm, phân ammophos 3. Phẩm chất:
- Ham học, áp dụng kiến thức đã học (công thức Lewis, hình học phân tử, tính tan, tính
base, tính khử, cân bằng hoá học, tốc độ phản ứng, enthalpy ) để tìm hiểu tính chất của ammonia, ammonium
- HS có trách nhiệm trong việc hoạt động nhóm, hoàn thành các nội dung được giao.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
- Video thí nghiệm tính tan của ammonia trong nước, máy vi tính, tivi,
- Video thí nghiệm NH3 cháy trong không khí
- Video ứng dụng muối ammonium
- Phiếu bài tập số 1, số 2
- 4 bộ thí nghiệm: thí nghiệm tạo khói trắng NH4Cl
- 4 bộ thí nghiệm nhận biết ion ammonium trong phân đạm PHIẾU HỌC TẬP SỐ 1 Câu 1:
a) Viết công thức e, công thức cấu tạo, công thức Lewis của ammonia ?
b) Dựa vào công thức Lewis, dự đoán dạng hình học phân tử của ammonia ?
c) Nhận xét các đặc điểm cấu tạo sau của phân tử NH3
- Phân tử NH3 có phân cực không ? Vì sao ?
- Nguyên tử N còn bao nhiêu e chưa tham gia liên kết ?
- Số oxi hóa của N trong phân tử NH3 là bao nhiêu ? Có đặc điểm gì ?
Câu 2: Trong công nghiệp, quá trình sản xuất ammonia thường được thực hiện ở nhiệt độ
4000C – 4500C, áp suất 150 – 200 bar, xúc tác Fe 0 N t ,p,xt 2 (g) + 3H2(g) 2NH3(g), 0 H 9 1,8kJ r
Vận dụng kiến thức về cân bằng hóa học, tốc độ phản ứng, biến thiên enthaipy để giải thích
các điều kiện của phản ứng tổng hợp NH3, cụ thể
a) Nếu tăng hoặc giảm nhiệt độ sẽ ảnh hưởng đến sự chuyển dịch cân bằng và tốc độ phản ứng như thế nào ?
b) Nếu giảm áp suất, cân bằng chuyển dịch theo chiều nào ? Tại sao không thực hiện ở áp suất cao hơn ?
c) Vai trò của chất xúc tác trong phản ứng là gì ? PHIẾU HỌC TẬP SỐ 2
1) Vẽ sơ đồ liên kết hydrogen của ammonia và H2O ? Vì sao ammonia tạo được liên kết
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
hydrogen với nước ? Giải thích khả năng tan tốt trong nước của NH3 ?
2) Dựa theo thuyết base của Bronsted – Lowry dự đoán NH3 có tính acid hay base ? Viết
các phương trình minh họa ?
3) Dựa vào số oxi hóa của N trong NH3 dự đoán NH3 có tính khử hay oxi hóa ? Viết
phương trình phản ứng minh họa ?
III. TIẾN TRÌNH DẠY HỌC:
Kiểm tra bài cũ: Không kiểm tra đầu giờ, kiểm tra kiến thức cũ lồng vào trong tiết học.
1. Hoạt động 1: Khởi động (5 phút) a) Mục tiêu:
- Huy động những hiểu biết của học sinh giải thích hiện tượng tính tan của ammonia trong
nước và đặt vấn đề vào các hoạt động hình thành kiến thức
- Tạo hứng thú, vui vẻ cho học sinh b) Nội dung:
- HS theo dõi đoạn đoạn phim: Tính tan của ammonia trong nước. Thảo luận cặp đôi trả lời câu hỏi giáo viên giao
c) Sản phẩm: Câu trả lời của bản thân của các câu hỏi giáo viên nêu d) Tổ chức thực hiện: Chuyển giao nhiệm vụ
+ Cho học sinh xem đoạn phim: Tính tan của ammonia trong nước.
+ Quan sát thí nghiệm và nêu các hiện tượng xảy ra.
+ Giải thích hiện tượng. Thực hiện nhiệm vụ
- HS thảo luận cặp đôi để trả lời câu hỏi của giáo viên - GV hỗ trợ học sinh Báo cáo, thảo luận
- GV Chỉ định học sinh trả lời
- Các học sinh khác nhận xét, bổ sung Kết luận, nhận định
- GV nhận xét câu trả lời
- Đặt vấn đề để vào bài
2. Hoạt động 2: Hình thành kiến thức mới
Hoạt động 1: Tìm hiểu đặc điểm cấu tạo phân tử NH3, điều kiện tổng hợp NH3 (8 phút) a) Mục tiêu:
- Mô tả được công thức Lewis và hình học phân tử của ammonia
– Vận dụng được kiến thức về cân bằng hoá học, tốc độ phản ứng, enthalpy cho phản ứng
tổng hợp ammonia từ nitrogen và hydrogen trong quá trình Haber.
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải) b) Nội dung:
- GV giao phiếu học tập số 1 cho các tổ nghiên cứu, tìm hiểu, chuẩn bị sẵn ở nhà bằng bảng
phụ và lên bảng báo cáo theo sự chỉ định của giáo viên. GV và hs góp ý bổ sung hoàn chỉnh
- Cho hs xem clip Quy trình tổng hợp NH3 tại link:
https://www.youtube.com/watch?v=IMTY7XCBL-U
c) Sản phẩm: Các bảng phụ trả lời các câu hỏi của PHT số 1 d) Tổ chức thực hiện: Hoạt động của GV - HS Nội dung Chuyển giao nhiệm vụ I. Ammonia
Tiết trước GV giao phiếu học tập cho các tổ nghiên 1. Cấu tạo phân tử, điều chế
cứu, tìm hiểu trước ở nhà. Chuẩn bị sản phẩm là - Phân tử ammonia được tạo bởi
nội dung viết sẵn trong bảng phụ để lên lớp trình một nguyên tử nitrogen liên kết với bày
ba nguyên tử hydrogen và có dạng Thực hiện nhiệm vụ
- Các tổ tìm hiểu và trả lời phiếu học tập trên bảng hình học là chóp tam giác. phụ
- Đặc điểm cấu tạo của phân tử - GV Hỗ trợ học sinh ammonia: Báo cáo, thảo luận
+ Nguyên tử nitrogen còn một cặp
- GV Chỉ định học sinh đại diện nhóm lên bảng electron không liên kết, tạo ra vùng
treo bảng phụ và thuyết trình
có mật độ điện tích âm trên nguyên
- Các học sinh khác nhận xét, bổ sung
- GV Cho học sinh xem clip Quy trình tổng hợp tử nitrogen. NH
+ Liên kết N–H phân cực, cặp 3 tại link:
https://www.youtube.com/watch?v=IMTY7XCBL- electron dùng chung lệch về nguyên U
tử nitrogen làm cho nguyên tử Kết luận, nhận định
hydrogen mang một phần điện tích
- GV nhận xét câu trả lời dương. - Cho điểm thưởng
+ Liên kết N–H tương đối bền với
năng lượng liên kết là 386 kJ/mol.
Trong công nghiệp, quá trình sản
xuất ammonia thường được thực
hiện ở nhiệt độ 400 oC – 450 oC, áp
suất 150 – 200 bar, xúc tác Fe. o N t ,p,xt
2(g) + 3H2(g) 2NH3 (g)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Giáo án Ammonia. Muối ammonium Hóa học 11 Kết nối tri thức
1 K
491 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Bộ giáo án Hóa học 11 Kết nối tri thức được cập nhật liên tục trong gói này từ nay đến hết tháng 3/2024
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Bộ giáo án Hóa học 11 Kết nối tri thức năm 2023 mới, chuẩn nhất được thiết kế theo phong cách hiện đại, đẹp mắt, trình bày chi tiết cho từng bài học và bám sát chương trình Sách giáo khoa Hóa học 11 Kết nối tri thức.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(981 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 11
Xem thêmTài liệu bộ mới nhất

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Trường:...................
Tổ:............................
Họ và tên giáo viên:
……………………
BÀI 5: AMMONIA-MUỐI AMMONIUM (1 tiết)
I. MỤC TIÊU
1. Kiến thức:
- Mô tả được công thức Lewis và hình học phân tử của ammonia
– Dựa vào đặc điểm cấu tạo của phân tử ammonia, giải thích được tính chất vật lí (tính tan),
tính chất hoá học (tính base, tính khử). Viết được phương trình hoá học minh hoạ.
- Trình bày được tính chất cơ bản của muối ammonium (dễ tan và phân li, chuyển hóa thành
ammonia trong kiểm, dễ bị nhiệt phân) và nhận biết được ion ammonium trong dung dịch
– Vận dụng được kiến thức về cân bằng hoá học, tốc độ phản ứng, enthalpy cho phản ứng
tổng hợp ammonia từ nitrogen và hydrogen trong quá trình Haber.
2. Năng lực:
* Năng lực chung:
- Năng lực tự chủ và tự học: Ap dụng kiến thức đã học (công thức Lewis, hình học phân tử,
tính tan, tính base, tính khử, cân bằng hoá học, tốc độ phản ứng, enthalpy ) để tìm hiểu tính
chất của ammonia, ammonium
- Năng lực giao tiếp và hợp tác: Làm việc nhóm tìm hiểu về tính chất của ammonia,
ammonium
- Năng lực giải quyết vấn đề và sáng tạo: Giải thích được tính tan của ammonia, các điều
kiện phản ứng tổng hợp ammonia từ nitrogen và hydrogen trong quá trình Haber
* Năng lực hóa học:
a. Nhận thức hoá học: Học sinh đạt được các yêu cầu sau:
- Mô tả được công thức Lewis và hình học phân tử của ammonia
– Dựa vào đặc điểm cấu tạo của phân tử ammonia, giải thích được tính chất vật lí (tính tan),
tính chất hoá học (tính base, tính khử). Viết được phương trình hoá học minh hoạ.
- Trình bày được tính chất cơ bản của muối ammonium (dễ tan và phân li, chuyển hóa thành
ammonia trong kiểm, dễ bị nhiệt phân)
– Vận dụng được kiến thức về cân bằng hoá học, tốc độ phản ứng, enthalpy cho phản ứng
tổng hợp ammonia từ nitrogen và hydrogen trong quá trình Haber.
b. Tìm hiểu tự nhiên dưới góc độ hóa học :
- Nhận biết được ion ammonium trong dung dịch
- Thực hiện được (hoặc quan sát video) thí nghiệm nhận biết được ion ammonium trong
phân đạm chứa ion ammonium.
c. Vận dụng kiến thức, kĩ năng đã học:
-Trình bày được ứng dụng của ammonia (chất làm lạnh; sản xuất phân bón như: đạm,
ammophos; sản xuất nitric acid; làm dung môi...); của ammonium nitrate và một số muối

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
ammonium tan như: phân đạm, phân ammophos
3. Phẩm chất:
- Ham học, áp dụng kiến thức đã học (công thức Lewis, hình học phân tử, tính tan, tính
base, tính khử, cân bằng hoá học, tốc độ phản ứng, enthalpy ) để tìm hiểu tính chất của
ammonia, ammonium
- HS có trách nhiệm trong việc hoạt động nhóm, hoàn thành các nội dung được giao.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
- Video thí nghiệm tính tan của ammonia trong nước, máy vi tính, tivi,
- Video thí nghiệm NH
3
cháy trong không khí
- Video ứng dụng muối ammonium
- Phiếu bài tập số 1, số 2
- 4 bộ thí nghiệm: thí nghiệm tạo khói trắng NH
4
Cl
- 4 bộ thí nghiệm nhận biết ion ammonium trong phân đạm
PHIẾU HỌC TẬP SỐ 1
Câu 1:
a) Viết công thức e, công thức cấu tạo, công thức Lewis của ammonia ?
b) Dựa vào công thức Lewis, dự đoán dạng hình học phân tử của ammonia ?
c) Nhận xét các đặc điểm cấu tạo sau của phân tử NH
3
- Phân tử NH
3
có phân cực không ? Vì sao ?
- Nguyên tử N còn bao nhiêu e chưa tham gia liên kết ?
- Số oxi hóa của N trong phân tử NH
3
là bao nhiêu ? Có đặc điểm gì ?
Câu 2: Trong công nghiệp, quá trình sản xuất ammonia thường được thực hiện ở nhiệt độ
400
0
C – 450
0
C, áp suất 150 – 200 bar, xúc tác Fe
N
2
(g) + 3H
2
(g)
0
t ,p,xt
2NH
3
(g),
0
r
H 91,8kJ
Vận dụng kiến thức về cân bằng hóa học, tốc độ phản ứng, biến thiên enthaipy để giải thích
các điều kiện của phản ứng tổng hợp NH
3
, cụ thể
a) Nếu tăng hoặc giảm nhiệt độ sẽ ảnh hưởng đến sự chuyển dịch cân bằng và tốc độ phản
ứng như thế nào ?
b) Nếu giảm áp suất, cân bằng chuyển dịch theo chiều nào ? Tại sao không thực hiện ở áp
suất cao hơn ?
c) Vai trò của chất xúc tác trong phản ứng là gì ?
PHIẾU HỌC TẬP SỐ 2
1) Vẽ sơ đồ liên kết hydrogen của ammonia và H
2
O ? Vì sao ammonia tạo được liên kết

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
hydrogen với nước ? Giải thích khả năng tan tốt trong nước của NH
3
?
2) Dựa theo thuyết base của Bronsted – Lowry dự đoán NH
3
có tính acid hay base ? Viết
các phương trình minh họa ?
3) Dựa vào số oxi hóa của N trong NH
3
dự đoán NH
3
có tính khử hay oxi hóa ? Viết
phương trình phản ứng minh họa ?
III. TIẾN TRÌNH DẠY HỌC:
Kiểm tra bài cũ: Không kiểm tra đầu giờ, kiểm tra kiến thức cũ lồng vào trong tiết học.
1. Hoạt động 1: Khởi động (5 phút)
a) Mục tiêu:
- Huy động những hiểu biết của học sinh giải thích hiện tượng tính tan của ammonia trong
nước và đặt vấn đề vào các hoạt động hình thành kiến thức
- Tạo hứng thú, vui vẻ cho học sinh
b) Nội dung:
- HS theo dõi đoạn đoạn phim: Tính tan của ammonia trong nước. Thảo luận cặp đôi trả lời
câu hỏi giáo viên giao
c) Sản phẩm: Câu trả lời của bản thân của các câu hỏi giáo viên nêu
d) Tổ chức thực hiện:
Chuyển giao nhiệm vụ
+ Cho học sinh xem đoạn phim: Tính tan của ammonia trong nước.
+ Quan sát thí nghiệm và nêu các hiện tượng xảy ra.
+ Giải thích hiện tượng.
Thực hiện nhiệm vụ
- HS thảo luận cặp đôi để trả lời câu hỏi của giáo viên
- GV hỗ trợ học sinh
Báo cáo, thảo luận
- GV Chỉ định học sinh trả lời
- Các học sinh khác nhận xét, bổ sung
Kết luận, nhận định
- GV nhận xét câu trả lời
- Đặt vấn đề để vào bài
2. Hoạt động 2: Hình thành kiến thức mới
Hoạt động 1: Tìm hiểu đặc điểm cấu tạo phân tử NH
3
, điều kiện tổng hợp NH
3
(8 phút)
a) Mục tiêu:
- Mô tả được công thức Lewis và hình học phân tử của ammonia
– Vận dụng được kiến thức về cân bằng hoá học, tốc độ phản ứng, enthalpy cho phản ứng
tổng hợp ammonia từ nitrogen và hydrogen trong quá trình Haber.

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
b) Nội dung:
- GV giao phiếu học tập số 1 cho các tổ nghiên cứu, tìm hiểu, chuẩn bị sẵn ở nhà bằng bảng
phụ và lên bảng báo cáo theo sự chỉ định của giáo viên. GV và hs góp ý bổ sung hoàn chỉnh
- Cho hs xem clip Quy trình tổng hợp NH
3
tại link:
https://www.youtube.com/watch?v=IMTY7XCBL-U
c) Sản phẩm: Các bảng phụ trả lời các câu hỏi của PHT số 1
d) Tổ chức thực hiện:
Hoạt động của GV - HS Nội dung
Chuyển giao nhiệm vụ
Tiết trước GV giao phiếu học tập cho các tổ nghiên
cứu, tìm hiểu trước ở nhà. Chuẩn bị sản phẩm là
nội dung viết sẵn trong bảng phụ để lên lớp trình
bày
Thực hiện nhiệm vụ
- Các tổ tìm hiểu và trả lời phiếu học tập trên bảng
phụ
- GV Hỗ trợ học sinh
Báo cáo, thảo luận
- GV Chỉ định học sinh đại diện nhóm lên bảng
treo bảng phụ và thuyết trình
- Các học sinh khác nhận xét, bổ sung
- GV Cho học sinh xem clip Quy trình tổng hợp
NH
3
tại link:
https://www.youtube.com/watch?v=IMTY7XCBL-
U
Kết luận, nhận định
- GV nhận xét câu trả lời
- Cho điểm thưởng
I. Ammonia
1. Cấu tạo phân tử, điều chế
- Phân tử ammonia được tạo bởi
một nguyên tử nitrogen liên kết với
ba nguyên tử hydrogen và có dạng
hình học là chóp tam giác.
- Đặc điểm cấu tạo của phân tử
ammonia:
+ Nguyên tử nitrogen còn một cặp
electron không liên kết, tạo ra vùng
có mật độ điện tích âm trên nguyên
tử nitrogen.
+ Liên kết N–H phân cực, cặp
electron dùng chung lệch về nguyên
tử nitrogen làm cho nguyên tử
hydrogen mang một phần điện tích
dương.
+ Liên kết N–H tương đối bền với
năng lượng liên kết là 386 kJ/mol.
Trong công nghiệp, quá trình sản
xuất ammonia thường được thực
hiện ở nhiệt độ 400
o
C – 450
o
C, áp
suất 150 – 200 bar, xúc tác Fe.
N
2
(g) + 3H
2
(g)
o
t ,p,xt
2NH
3
(g)

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
o
r
H 91,8kJ
Hoạt động 2: Tính chất vật lí và hóa học của NH
3
( 18 phút)
a) Mục tiêu:
Dựa vào đặc điểm cấu tạo của phân tử ammonia, giải thích được tính chất vật lí (tính tan),
tính chất hoá học (tính base, tính khử). Viết được phương trình hoá học minh hoạ.
b) Nội dung:
- GV giao phiếu học tập số 2 cho các tổ nghiên cứu, tìm hiểu, chuẩn bị sẵn ở nhà bằng bảng
phụ và lên bảng báo cáo theo sự chỉ định của giáo viên. GV và hs góp ý bổ sung hoàn chỉnh
- Cho hs làm thí nghiệm kiểm chứng tính base: Phản ứng tạo khói trắng NH
4
Cl
- Cho hs xem clip thí nghiệm NH
3
cháy trong không khí để kiểm chứng tính khử của NH
3
c) Sản phẩm:
- Các bảng phụ trả lời các câu hỏi của PHT số 2
- Thực hiện thành công thí nghiệm: Phản ứng tạo khói trắng NH
4
Cl
- Xác định vai trò và cân bằng theo phương pháp thăng bằng e của phản ứng NH
3
cháy trong
không khí
d) Tổ chức thực hiện:
Hoạt động của GV - HS Nội dung
Chuyển giao nhiệm vụ
- Tiết trước GV giao PHT số 2 cho
các tổ nghiên cứu, tìm hiểu trước ở
nhà. Chuẩn bị sản phẩm là nội dung
viết sẵn trong bảng phụ để lên lớp
trình bày.
- Học sinh nhận nhiệm vụ và tìm hiểu
cách thực hiện.
Thực hiện nhiệm vụ
- Các tổ tìm hiểu và trả lời phiếu học
tập trên bảng phụ
- GV Hỗ trợ học sinh khi cần thiết.
Báo cáo, thảo luận
- GV Chỉ định học sinh đại diện nhóm
lên bảng treo bảng phụ và thuyết trình
- Các học sinh khác nhận xét, bổ sung
- Câu hỏi mở rộng: Nêu điểm giống
và khác nhau của liên kết giữa nguyên
2. Tính chất vật lí
- Ammonia tồn tại ở cả trong môi trường đất,
nước, không khí. Trong cơ thể người,
ammonia được tạo ra trong quá trình chuyển
hoá thức ăn chứa protein.
- Ở điều kiện thường, ammonia tồn tại ở thể
khí, không màu, nhẹ hơn không khí, mùi khai
và xốc. Ammonia tan nhiều trong nước. Ở
điều kiện thường, 1 lít nước hoà tan được
khoảng 700 lít khí ammonia. Ammonia dễ
hoá lỏng (hoá lỏng ở –33,3 °C) và dễ hoá rắn
(hoá rắn ở –77,7 °C).
3. Tính chất hoá học
a) Tính base
- Trong dung dịch, một phần số phân tử
ammonia nhận proton của nước, tạo thành ion

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
tử N với 3 nghuyên tử H trong phân tử
NH
3
lúc đầu và H
+
của axit.
- GV Cho các tổ làm thí nghiệm kiểm
chứng phản ứng tạo khói trắng NH
4
Cl
- GV Cho hs xem clip thí nghiệm NH
3
cháy trong không khí và yêu cầu một
học sinh lên bảng xác định vai trò và
cân bằng theo phương pháp thăng
bằng e
Kết luận, nhận định
- GV nhận xét câu trả lời
- Liên hệ với thí nghiệm tính tan của
NH
3
trong nước của hoạt động khởi
động để nhấn mạnh khí tính tan của
NH
3
- Khẳng định NH
3
có tính base và tính
khử.
ammonium (
4
NH
).
- Dung dịch ammonia có môi trường base
yếu, làm quỳ tím chuyển sang màu xanh,
phenolphthalein chuyển sang màu hồng.
- Ở thể khí, ammonia cũng có khả năng nhận
proton, thể hiện tính chất của một base
Bronsted – Lowry.
Ví dụ: NH
3
(g) + HCl(g) → NH
4
Cl(s).
b. Tính khử
- Trong phân tử ammonia, nguyên tử nitrogen
có số oxi hoá –3 (số oxi hoá thấp nhất của
nitrogen) nên ammonia thể hiện tính khử.
- Khi đốt cháy trong oxygen, ammonia cháy
với ngọn lửa màu vàng.
4NH
3
+ 3O
2
o
t
2N
2
+ 6H
2
O
- Trong công nghiệp, phản ứng giữa ammonia
và oxygen được thực hiện ở nhiệt độ 800 °C –
900 °C với xúc tác Pt.
4NH
3
+ 5O
2
o
t ,Pt
4NO + 6H
2
O
Phản ứng trên là giai đoạn trung gian quan
trọng trong quá trình sản xuất nitric acid theo
phương pháp Ostwald.
Hoạt động 3: Tính chất hóa học và ứng dụng của muối ammonium (7 phút)
a) Mục tiêu:
- Trình bày được tính chất cơ bản của muối ammonium (dễ tan và phân li, chuyển hóa thành
ammonia trong kiểm, dễ bị nhiệt phân) và nhận biết được ion ammonium trong dung dịch
- Trình bày được ứng dụng của muối ammonium; ammonium nitrate và một số muối
ammonium tan
b) Nội dung:
- Giới thiệu nhanh tính tan, tính chất kém bền nhiệt của muối ammonium

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
- Hs làm thí nghiệm nhận biết ion ammonium trong phân đạm. Nêu hiện tượng, viết phương
trình phân tử, ion
c) Sản phẩm:
- Làm thí nghiệm đúng thao tác, thành công
- Viết được các pt minh họa
d) Tổ chức thực hiện:
Hoạt động của GV - HS Nội dung
Chuyển giao nhiệm vụ
- Nêu nhanh cho hs về tính tan, tính
chất kém bền nhiệt của muối
ammonium
- Cho 4 tổ làm thí nghiệm nhận biết
ion ammonium trong phân đạm. Nêu
hiện tượng, viết phương trình phân
tử, ion
Thực hiện nhiệm vụ
- Các tổ thực hiện thí nghiệm,
- GV giám sát hỗ trợ học sinh.
Báo cáo, thảo luận
- GV Chỉ định học sinh đại diện
nhóm lên bảng treo bảng phụ và
thuyết trình
- Các học sinh khác nhận xét, bổ
sung
- Câu hỏi mở rộng: Tại sao khi bón
phân đạm thì không nên bón chung
với vôi ?
- Cho hs xem clip ứng dụng muối
ammonium
Kết luận, nhận định
- GV nhận xét câu trả lời
- Chốt lại các tính chất của muối
ammonium. Lưu ý bảo quản phân
đạm, tránh gây cháy nổ
II. Muối ammonium
1. Tính tan, sự điện li
Hầu hết các muối ammonia đều tan trong nước
và phân li hoàn toàn ra ion.
Ví dụ:
4 4
NH Cl NH Cl
2. Tác dụng với kiềm – Nhận biết ion
ammonium
Khi đun nóng hỗn hợp muối ammonium với
dung dịch kiềm, sinh ra khí ammonia có mùi
khai.
Ví dụ:
(NH
4
)
2
SO
4
+ 2NaOH
o
t
Na
2
SO
4
+ 2NH
3
+
2H
2
O
Phương trình ion rút gọn:
o
t
4 3 2
NH OH NH H O
3. Tính chất
Các muối ammonium đều kém bền nhiệt và dễ
bị phân huỷ khi đun nóng.
Ví dụ:
NH
4
Cl
o
t
NH
3
+ HCl
NH
4
HCO
3
o
t
NH
3
+ CO
2
+ H
2
O
NH
4
NO
3
o
t
N
2
O + 2H
2
O
4. Ứng dụng
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
(SGK)
3. Hoạt động 3: Luyện tập (6 phút)
a) Mục tiêu: Củng cố lại phần kiến thức đã học về ammonia, muối ammonium
b) Nội dung: GV đưa ra các bài tập cụ thể, gọi HS lên làm và chữa lại. HS hoàn thành các
bài tập sau:
PHIẾU BÀI TẬP
Câu 1: Có 4 dung dịch muối riêng biệt: CuCl
2
, ZnCl
2
, FeCl
3
, AlCl
3
. Nếu thêm dung dịch
KOH (dư) rồi thêm tiếp dung dịch NH3 (dư) vào 4 dung dịch trên thì số chất kết tủa thu
được là
A. 4. B. 1. C. 3. D. 2.
Câu 2: Hòa tan một khí X vào nước, thu được dung dịch Y. Cho từ từ dung dịch Y đến dư
vào dung dịch ZnSO4, ban đầu thấy có kết tủa trắng, sau đó kết tủa tan ra. Khí X là
A. NO
2
. B. HCl. C. SO
2
. D. NH
3
.
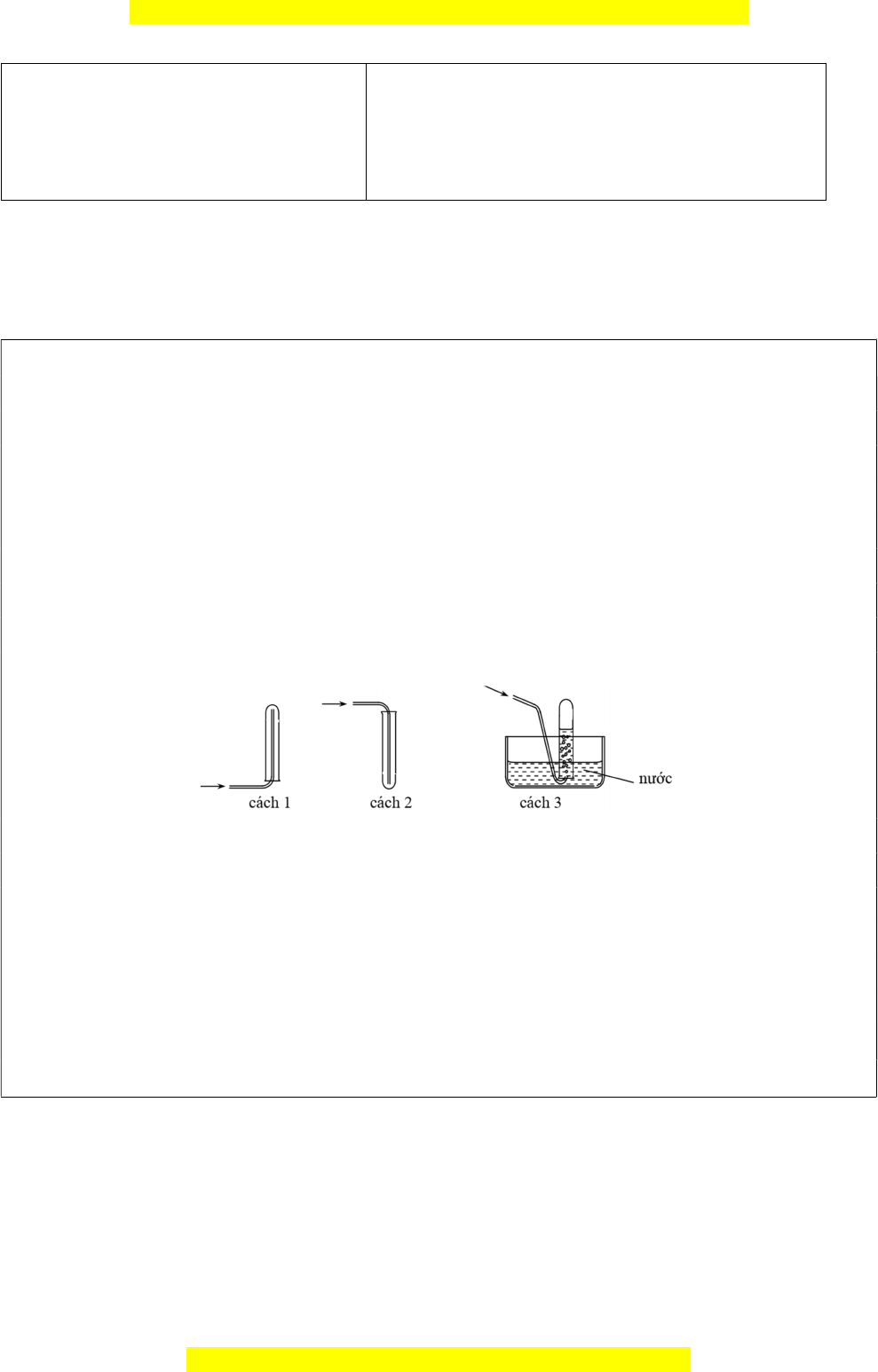
Câu 3: Các chất khí điều chế trong phòng thí nghiệm thường được thu theo phương pháp
đẩy không khí (cách 1, cách 2) hoặc đẩy nước (cách 3) như các hình vẽ dưới đây:
Có thể dùng cách nào trong 3 cách trên để thu khí NH
3
?
A. Cách 3. B. Cách 1.
C. Cách 2. D. Cách 2 hoặc cách 3.
Câu 4: Phải dùng bao nhiêu lít khí nitrogen và bao nhiêu lít khí hydrogen để điều chế 17,0
gam NH
3
? Biết rằng hiệu suất chuyển hóa thành amoniac là 25%. Các thể tích khí được đo ở
đktc.
A. 44,8 lít N
2
và 134,4 lít H
2
. B. 22,4 lít N
2
và 134,4 lít H
2
.
C. 22,4 lít N
2
và 67,2 lít H
2
. D. 44,8 lít N
2
và 67,2 lít H
2
.
c) Sản phẩm:
Câu 1: B Câu 2: D Câu 3: B Câu 4: A
d) Tổ chức thực hiện: HS làm việc cá nhân.
4. Hoạt động 4: Vận dụng (1 phút)
a) Mục tiêu: giúp HS vận dụng kiến thức đã được học trong bài để giải quyết các câu hỏi,
nội dung gắn liền với thực tiễn và mở rộng thêm kiến thức của HS về ammonia, muối
ammonium.

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
b) Nội dung: Tìm hiểu mưa acid là gì và tác hại của mưa acid đối với con người ?
c) Sản phẩm:
- Mưa acid là nước mưa có độ pH < 5,6 do hòa tan HNO
3
, H
2
SO
4
tạo ra từ các khí ô nhiễm
- Độc hại cây cối, vật nuôi, công trình ngoài trời và sức khỏe con người
d) Tổ chức thực hiện: GV hướng dẫn HS về nhà làm và hướng dẫn HS tìm nguồn tài liệu
tham khảo qua internet, thư viện….























