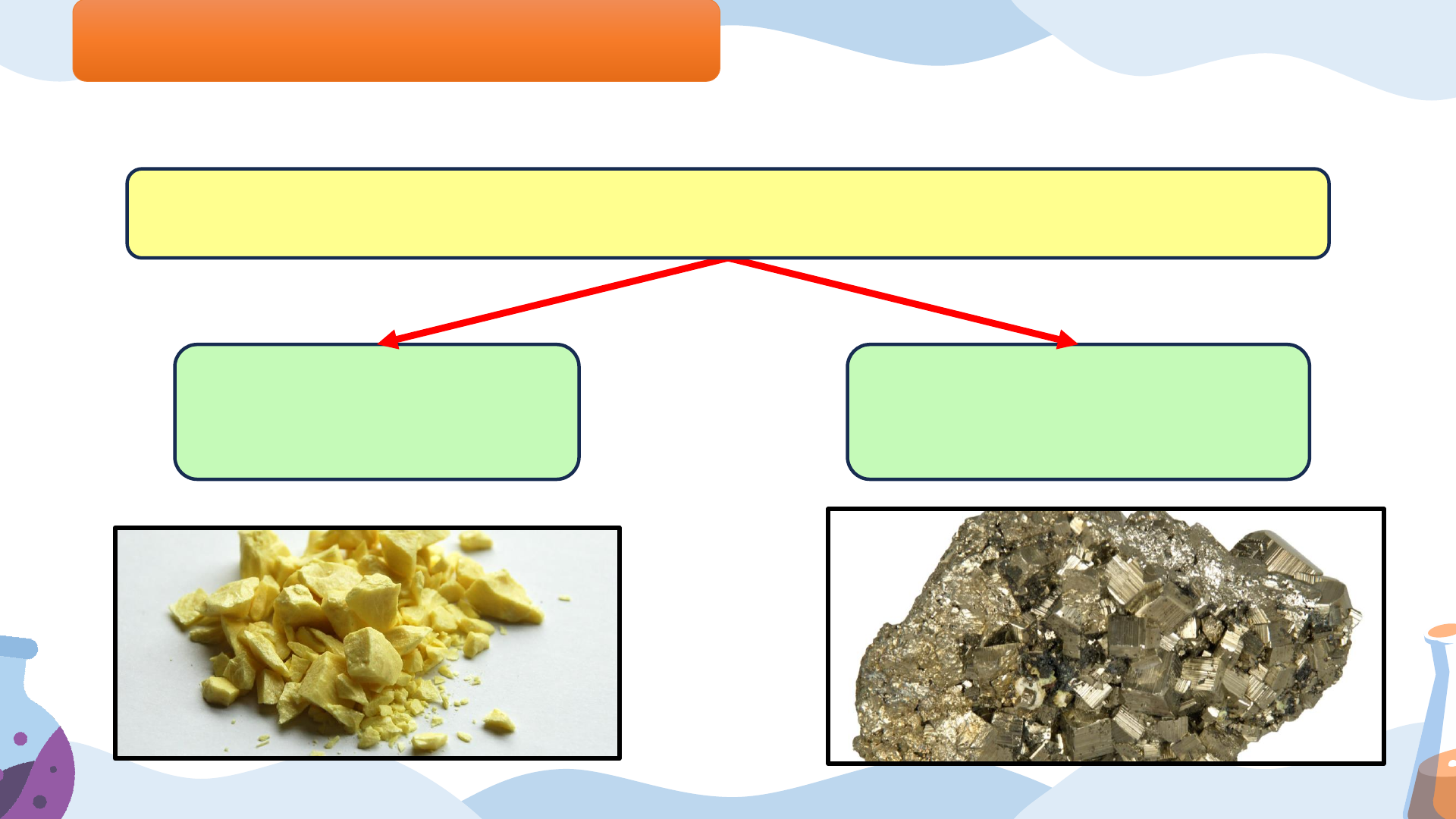
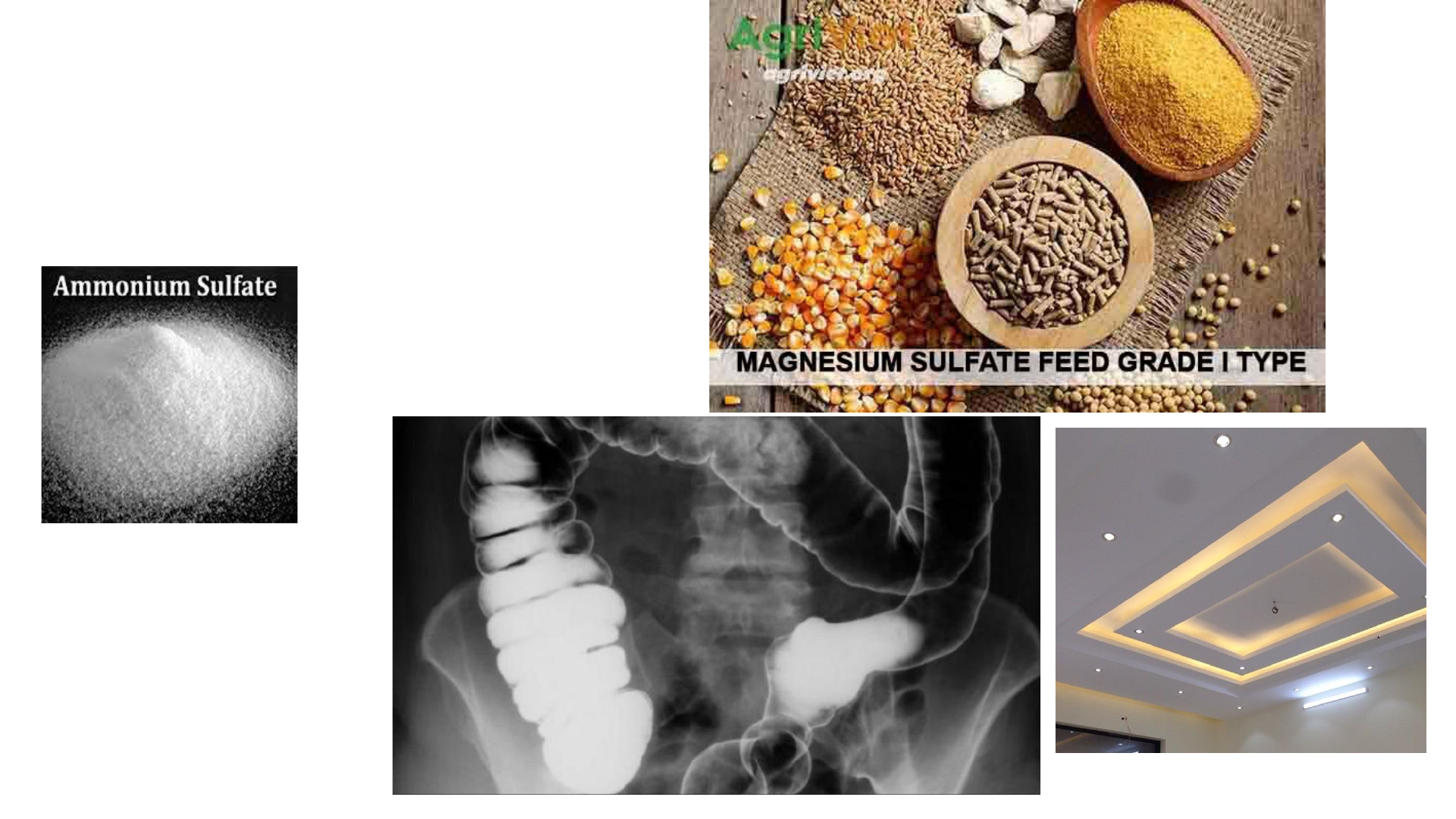
Bài 7: SULFURIC ACID VÀ MUỐI SUNFATE
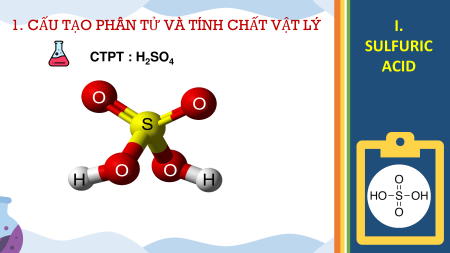
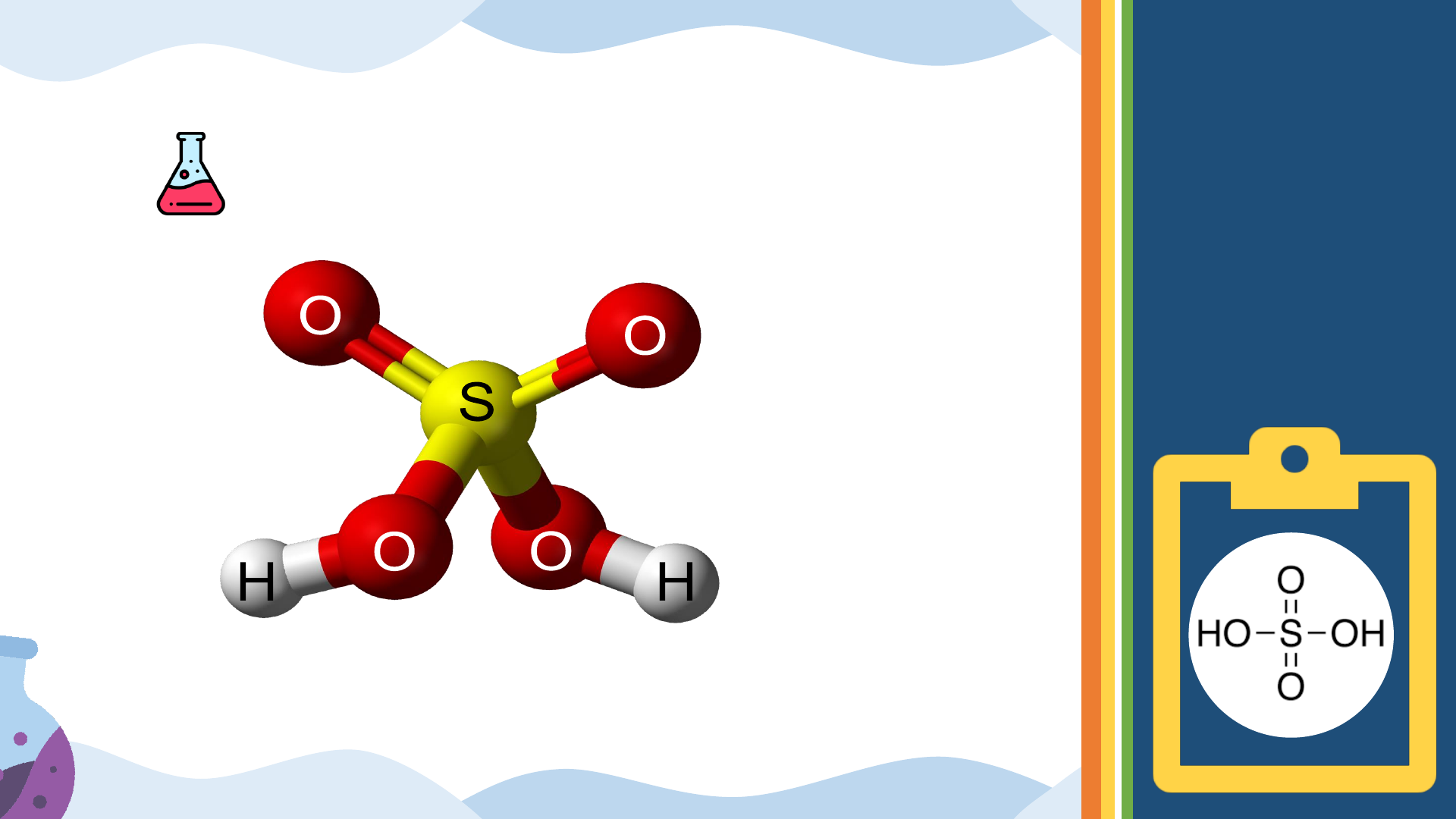
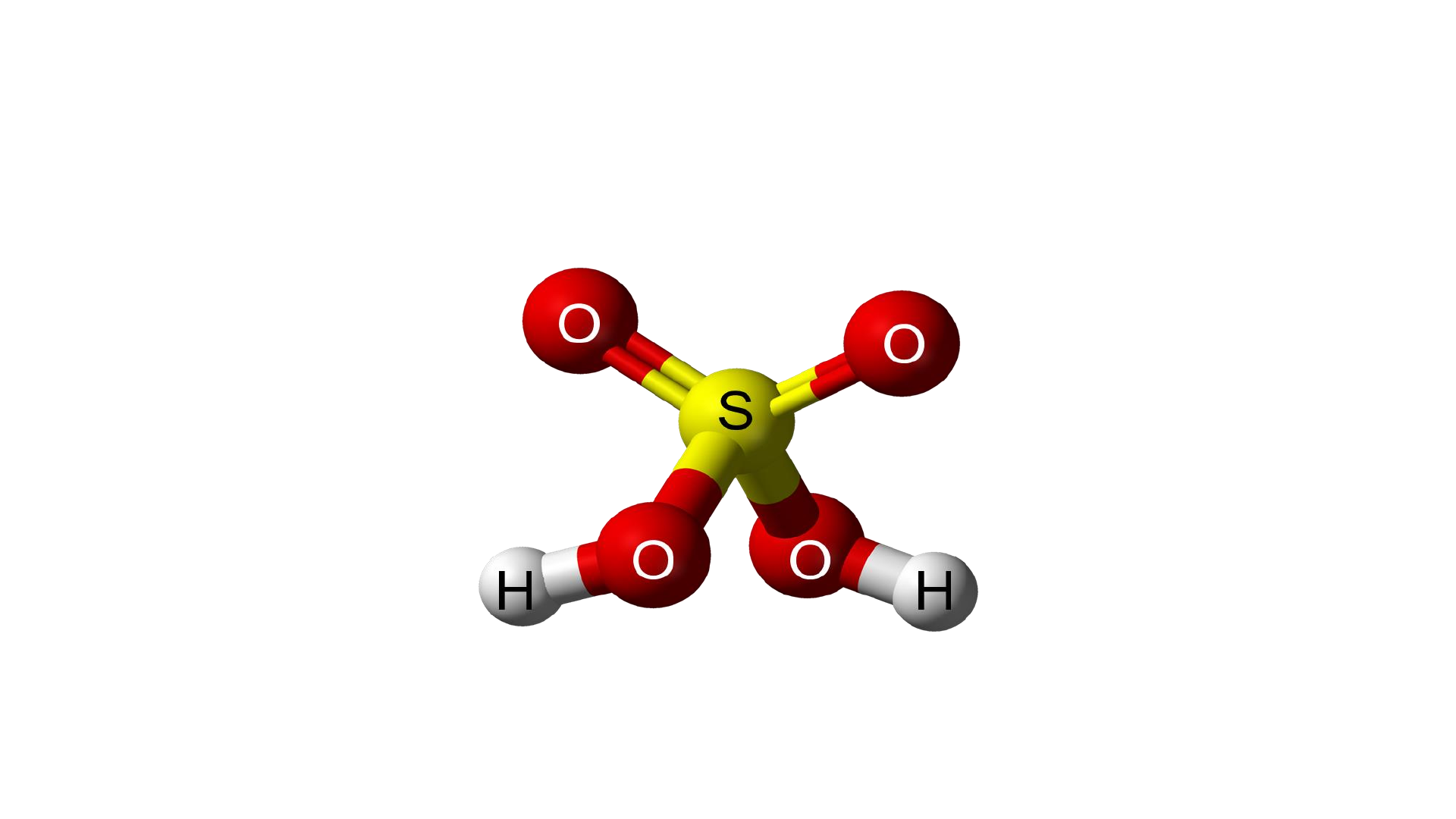
1. CẤU TẠO PHÂN TỬ VÀ TÍNH CHẤT VẬT LÝ I. SULFURIC CTPT : H SO 2 4 ACID
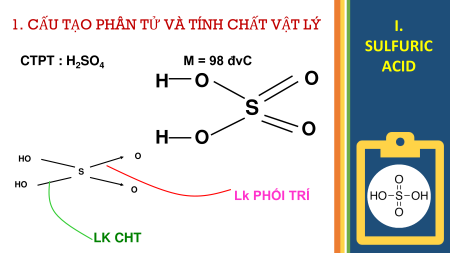
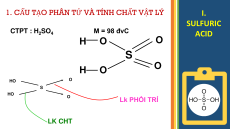
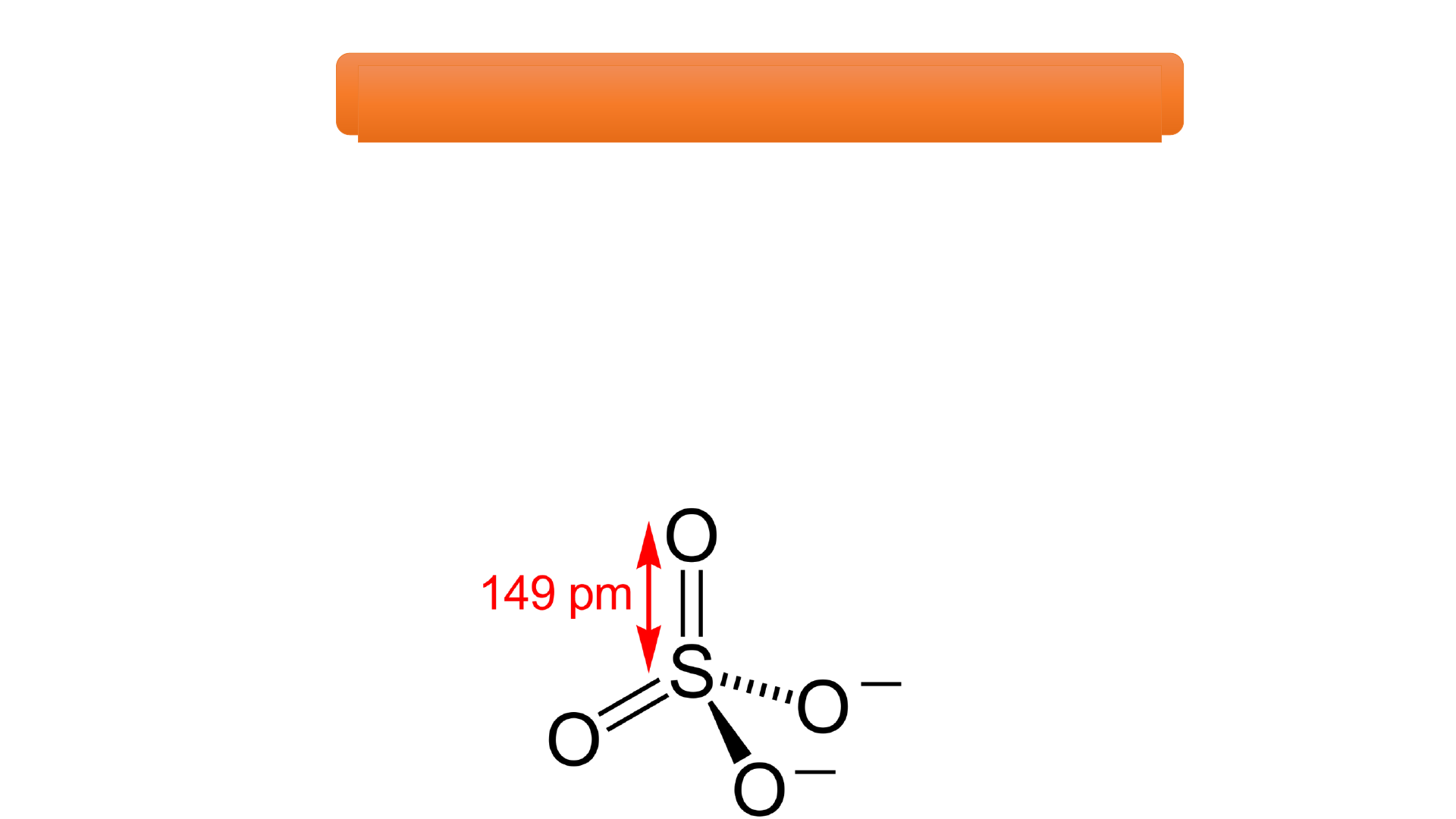
1. CẤU TẠO PHÂN TỬ VÀ TÍNH CHẤT VẬT LÝ I. SULFURIC CTPT : H SO M = 98 đvC 2 4 ACID H O O S H O O O HO S HO O Lk PHỐI TRÍ LK CHT
1. CẤU TẠO PHÂN TỬ VÀ TÍNH CHẤT VẬT LÝ I. SULFURIC
Sulfuric acid là chất lỏng sánh như dầu, không màu, ACID
không bay hơi, nặng gần gấp hai nước.
Dung dịch sulfuric acid đặc có khả năng hút ẩm nên
thường để dùng làm khô hóa chất trong các bình hút ẩm.
Document Outline
- Slide 1: Bài 7: SULFURIC ACID VÀ MUỐI SUNFATE
- Slide 2
- Slide 3: 1. CẤU TẠO PHÂN TỬ VÀ TÍNH CHẤT VẬT LÝ
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
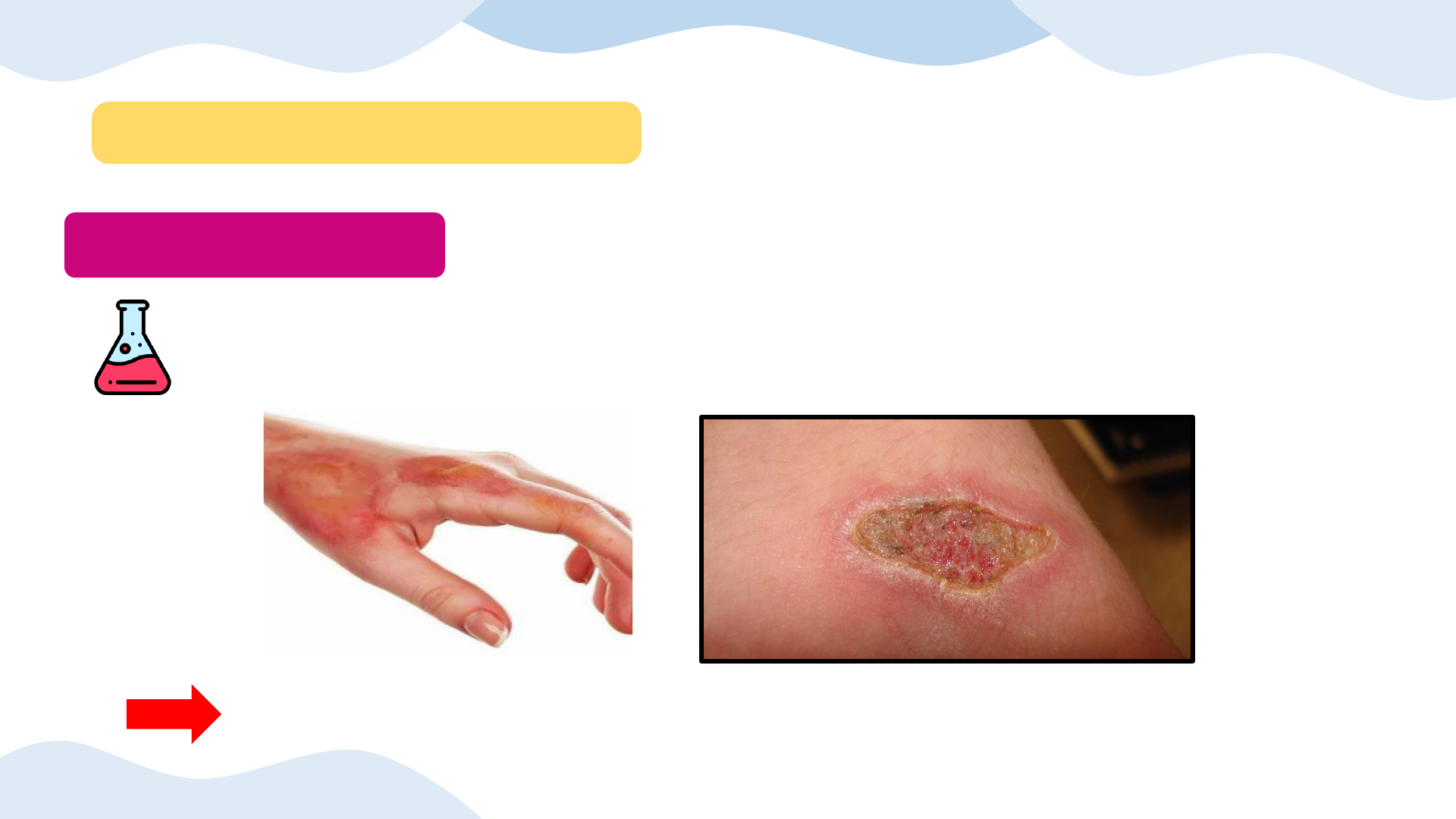
- Slide 17: 3. BẢO QUẢN VÀ XỬ LÍ BỎNG SULFURIC ACID
- Slide 18
- Slide 19: Sơ cứu sơ bộ khi bị bỏng acid
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36