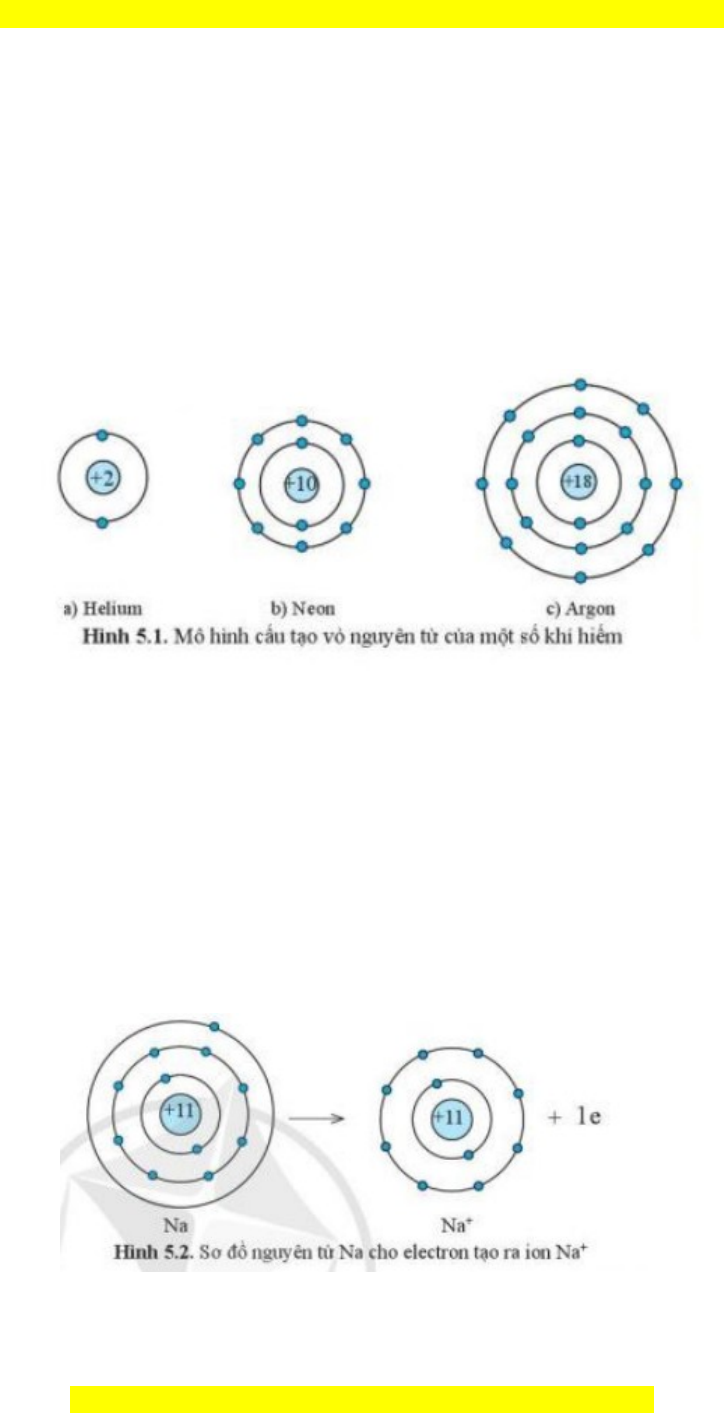
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t (c ế ó l i ờ gi i ả ) Chủ đ 3: ề Phân tử Bài 5: Gi i ớ thi u v ệ l ề iên k t ế hóa h c ọ I. Đặc đi m ể c u t ấ o v ạ ng ỏ uyên t k ử hí hi m ế - L p ớ vỏ ngoài cùng c a
ủ các nguyên tử khí hi m
ế có 8 electron (riêng He có 2 electron) là l p v ớ b ỏ n v ề ng. ữ - Các nguyên t khí ử hi m ế t n t ồ i ạ đ c l ộ p ậ trong đi u ki ề n t ệ hư ng. ờ
- Nguyên tử nguyên tố khác có l p
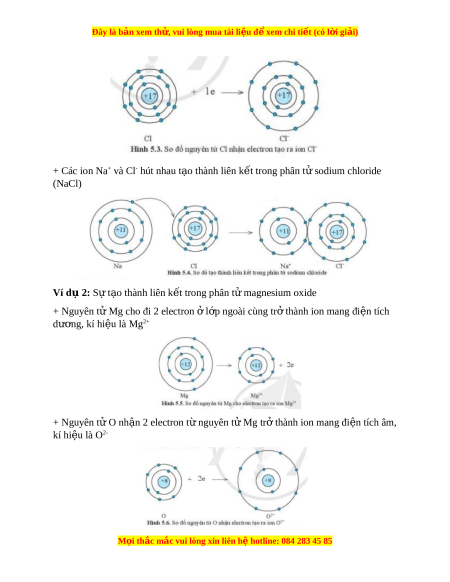
ớ vỏ ngoài cùng kém b n, ề có xu hư ng ớ t o ạ ra l p v ớ ỏ tư ng t ơ khí ự hi m ế khi liên k t ế v i ớ nguyên t khác. ử II. Liên k t ế ion - Liên k t ế ion là liên k t ế đư c t ợ o ạ thành b i ở l c hút ự gi a i ữ on dư ng ơ và ion âm. Ví d 1 ụ : S t ự o ạ thành liên k t ế trong phân t s ử odium chloride
+ Nguyên tử Na cho đi 1 electron l ở p ngoài ớ cùng tr t ở hành ion mang đi n t ệ ích dư ng, ơ kí hi u l ệ à Na+ + Nguyên tử Cl nh n 1 el ậ ectron t nguyên ừ t N ử a tr t ở hành ion mang đi n t ệ ích âm, kí hi u l ệ à Cl- M i
ọ thắc mắc vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t (c ế ó l i ờ gi i ả )
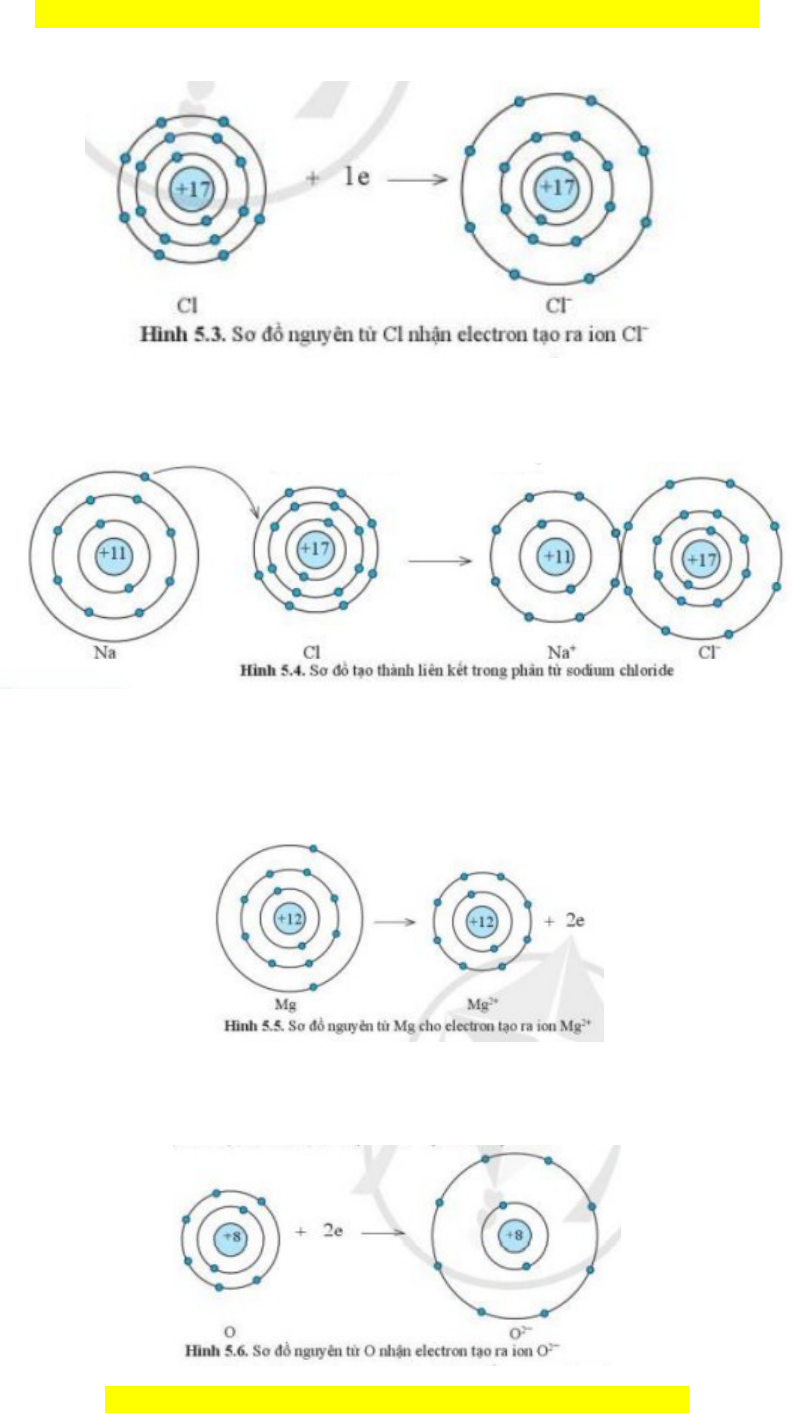
+ Các ion Na+ và Cl- hút nhau t o ạ thành liên k t ế trong phân t ử sodium chloride (NaCl) Ví d 2 ụ : S t ự o ạ thành liên k t ế trong phân t m ử agnesium oxide
+ Nguyên tử Mg cho đi 2 electron l ở p ngoài ớ cùng tr t ở hành ion mang đi n t ệ ích dư ng, ơ kí hi u l ệ à Mg2+ + Nguyên tử O nh n 2 el ậ ectron t nguyên t ừ M ử g tr t ở hành ion mang đi n t ệ ích âm, kí hi u l ệ à O2- M i
ọ thắc mắc vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t (c ế ó l i ờ gi i ả )
+ Các ion Mg2+ và O2- hút nhau t o ạ thành liên k t ế trong phân t ử magnesium oxide (MgO). - Chất đư c ợ t o t ạ hành b i ở các ion dư ng và i ơ on âm đư c ợ g i ọ là h p ch ợ t ấ ion. - Các h p ch ợ t ấ ion có nh ng t ữ ính ch t ấ chung sau: + Là ch t ấ r n ắ đi ở u ki ề n t ệ hư ng. ờ + Thư ng ờ có nhi t ệ đ nóng ch ộ y và ả nhi t ệ độ sôi cao. + Khi tan trong nư c t ớ o ạ ra dung d ch ị d n đ ẫ ư c ợ đi n. ệ III. Liên k t ế c ng hóa t ộ rị - Liên k t ế c ng hóa t ộ r l ị à liên k t ế đư c t ợ o ạ thành b i ở m t ộ ho c ặ nhi u ề đôi electron dùng chung gi a ữ hai nguyên t . ử Ví d 1 ụ : S t ự o ạ thành liên k t ế trong phân tử chlorine M i
ọ thắc mắc vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t (c ế ó l i ờ gi i ả )
+ Nguyên tử Cl có 7 electron l p ớ ngoài cùng và c n ầ thêm 1 electron đ ể có l p ớ vỏ b n v ề ng ữ tư ng t ơ khí ự hi m ế . + Khi hai nguyên t ử Cl liên k t ế v i ớ nhau, m i ỗ nguyên t ử góp 1 electron đ ể t o ạ ra đôi electron dùng chung. + H t ạ nhân c a ủ hai nguyên t
ử Cl cùng hút đôi electron dùng chung và liên k t ế v i ớ nhau t o ạ thành phân t chl ử orine. Ví d 2 ụ : S t ự o ạ thành liên k t ế trong phân tử amomonia
Nguyên tử N có 7 electron, trong đó có 5 electron l p ớ ngoài cùng, c n ầ thêm 3 electron đ có ể l p v ớ b ỏ n v ề ng t ữ ư ng ơ t khí ự hi m ế .
Nguyên tử H chỉ có 1 electron và c n
ầ thêm 1 electron để có l p ớ vỏ b n ề v ng ữ tư ng ơ t khí ự hi m ế . Khi N k t ế h p ợ v i
ớ H, nguyên tử N góp 3 electron, m i ỗ nguyên tử H góp 1 electron. Như v y ậ gi a ữ nguyên tử N và m i
ỗ nguyên tử H có 1 đôi electron dùng chung. H t ạ nhân nguyên t
ử N và H cùng hút đôi electron dùng chung, liên k t ế v i ớ nhau t o ạ ra phân t am ử monia. M i
ọ thắc mắc vui lòng xin liên h h
ệ otline: 084 283 45 85
Lý thuyết Giới thiệu về liên kết hóa học KHTN 7 Cánh diều
748
374 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Tài liệu được cập nhật liên tục trong gói này từ nay đến hết tháng 6/2023. Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu Bộ câu hỏi lý thuyết Khoa học tự nhiên 7 mới nhất nhằm giúp Giáo viên có thêm tài liệu tham khảo lý thuyết môn Khoa học tự nhiên lớp 7.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(748 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN KHTN
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 7
Xem thêmTài liệu bộ mới nhất
Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
Ch đ 3: Phân tủ ề ử
Bài 5: Gi i thi u v liên k t hóa h cớ ệ ề ế ọ
I. Đ c đi m c u t o v nguyên t khí hi mặ ể ấ ạ ỏ ử ế
- L p v ngoài cùng c a các nguyên t khí hi m có 8 electron ớ ỏ ủ ử ế (riêng He có 2
electron) là l p v b n v ng.ớ ỏ ề ữ
- Các nguyên t khí hi m t n t i đ c l p trong đi u ki n th ng.ử ế ồ ạ ộ ậ ề ệ ườ
- Nguyên t nguyên t khác có l p v ngoài cùng kém b n, có xu h ng t o raử ố ớ ỏ ề ướ ạ
l p v t ng t khí hi m khi liên k t v i nguyên t khác.ớ ỏ ươ ự ế ế ớ ử
II. Liên k t ionế
- Liên k t ion là liên k t đ c t o thành b i l c hút gi a ion d ng và ion âm.ế ế ượ ạ ở ự ữ ươ
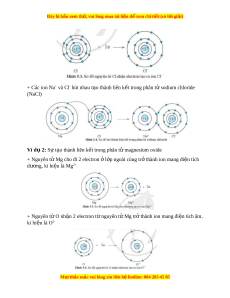
Ví d 1:ụ S t o thành liên k t trong phân t sodium chlorideự ạ ế ử
+ Nguyên t Na cho đi 1 electron l p ngoài cùng tr thành ion mang đi n tích ử ở ớ ở ệ
d ng, kí hi u là Naươ ệ
+
+ Nguyên t Cl nh n 1 electron t nguyên t Na tr thành ion mang đi n tích âm,ử ậ ừ ử ở ệ
kí hi u là Clệ
-
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ
Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
+ Các ion Na
+
và Cl
-
hút nhau t o thành liên k t trong phân t ạ ế ử sodium chloride
(NaCl)
Ví d 2:ụ S t o thành liên k t trong phân t magnesium oxideự ạ ế ử
+ Nguyên t Mg cho đi 2 electron l p ngoài cùng tr thành ion mang đi n tích ử ở ớ ở ệ
d ng, kí hi u là Mgươ ệ
2+
+ Nguyên t O nh n 2 electron t nguyên t Mg tr thành ion mang đi n tích âm,ử ậ ừ ử ở ệ
kí hi u là Oệ
2-
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
+ Các ion Mg
2+
và O
2-
hút nhau t o thành liên k t trong phân t ạ ế ử magnesium oxide
(MgO).
- Ch t đ c t o thành b i các ion d ng và ion âm đ c g i là h p ch t ion.ấ ượ ạ ở ươ ượ ọ ợ ấ
- Các h p ch t ion có nh ng tính ch t chung sau:ợ ấ ữ ấ
+ Là ch t r n đi u ki n th ng.ấ ắ ở ề ệ ườ
+ Th ng có nhi t đ nóng ch y và nhi t đ sôi cao.ườ ệ ộ ả ệ ộ
+ Khi tan trong n c t o ra dung d ch d n đ c đi n.ướ ạ ị ẫ ượ ệ
III. Liên k t c ng hóa trế ộ ị
- Liên k t c ng hóa tr là liên k t đ c t o thành b i m t ho c nhi u đôi ế ộ ị ế ượ ạ ở ộ ặ ề
electron dùng chung gi a hai nguyên t .ữ ử
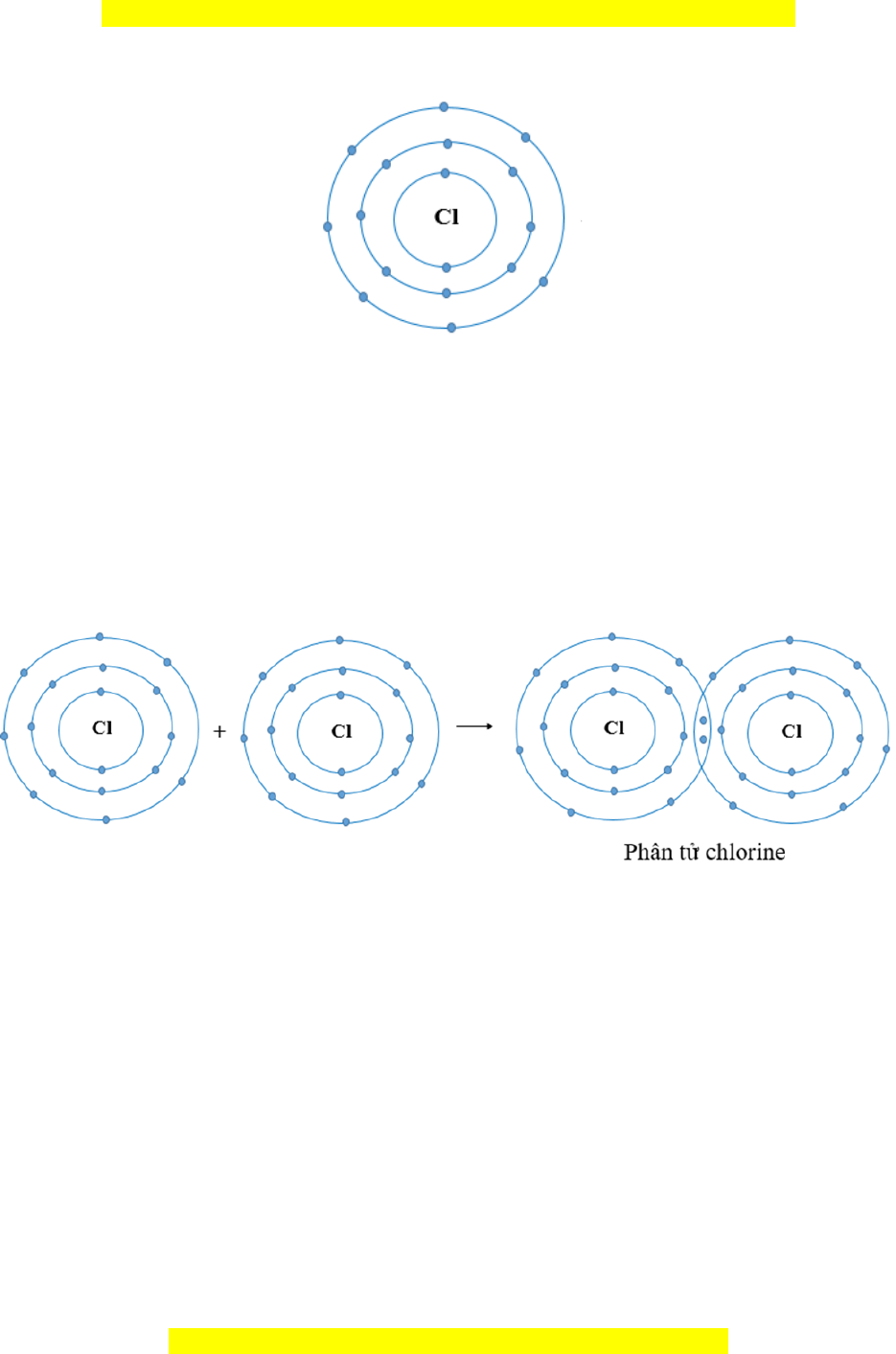
Ví d 1:ụ S t o thành liên k t trong phân tự ạ ế ử chlorine
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ
Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
+ Nguyên t Cl có 7 electron l p ngoài cùng và c n thêm 1 electron đ có l p vử ớ ầ ể ớ ỏ
b n v ng t ng t khí hi m. ề ữ ươ ự ế
+ Khi hai nguyên t Cl liên k t v i nhau, m i nguyên t góp 1 electron đ t o raử ế ớ ỗ ử ể ạ
đôi electron dùng chung.
+ H t nhân c a hai nguyên t Cl cùng hút đôi electron dùng chung và liên k t v iạ ủ ử ế ớ
nhau t o thành phân t chlorine.ạ ử
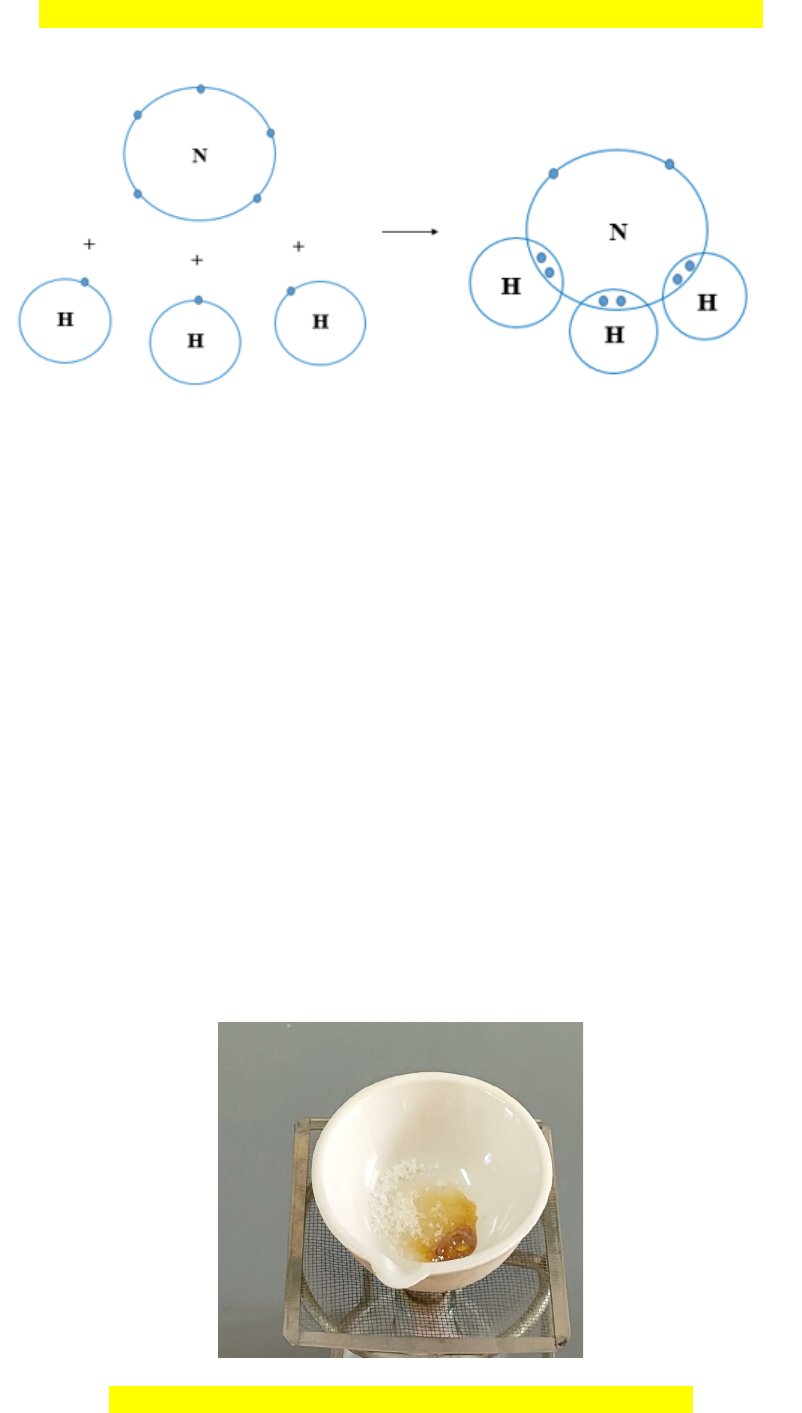
Ví d 2:ụ S t o thành liên k t trong phân tự ạ ế ử amomonia
Nguyên t N có 7 electron, trong đó có 5 electron l p ngoài cùng, c n thêm 3ử ớ ầ
electron đ có l p v b n v ng t ng t khí hi m. ể ớ ỏ ề ữ ươ ự ế
Nguyên t H ch có 1 electron và c n thêm 1 electron đ có l p v b n v ngử ỉ ầ ể ớ ỏ ề ữ
t ng t khí hi m.ươ ự ế
Khi N k t h p v i H, nguyên t N góp 3 electron, m i nguyên t H góp 1ế ợ ớ ử ỗ ử
electron. Nh v y gi a nguyên t N và m i nguyên t H có 1 đôi electron dùngư ậ ữ ử ỗ ử
chung. H t nhân nguyên t N và H cùng hút đôi electron dùng chung, liên k t v iạ ử ế ớ
nhau t o ra phân t ammonia.ạ ử
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ
Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
Chú ý: Trong mô hình c u t o v nguyên t các ph n liên k t c ng hóa tr , chấ ạ ỏ ử ở ầ ế ộ ị ỉ
c n bi u di n l p electron ngoài cùng.ầ ể ễ ớ
- Ch t đ c t o thành nh liên k t công hóa tr gi a các nguyên t đ c g i là ấ ượ ạ ờ ế ị ữ ử ượ ọ
ch t c ng hóa tr .ấ ộ ị
- Tính ch t c a ch t c ng hóa tr :ấ ủ ấ ộ ị
+ Trong đi u ki n th ng, các ch t c ng hóa tr có c ba th : ề ệ ườ ấ ộ ị ở ả ể
R n (đ ng ăn, iodine,...)ắ ườ
L ng (bromine, ethanol,...)ỏ
Khí (oxygen, carbon dioxide,...)
+ Nhi t đ sôi và nhi t đ nóng ch y th p.ệ ộ ệ ộ ả ấ
+ Nhi u ch t c ng hóa tr không d n đi n (đ ng ăn, ethanol,...)ề ấ ộ ị ẫ ệ ườ
Ví d :ụ Đ ng ăn là h p ch t c ng hóa tr nên d dàng b nóng ch y khi đun ườ ợ ấ ộ ị ễ ị ả
nóng.
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ