ĐỀ MINH HỌA
KỲ THI TRUNG HỌC PHỔ THÔNG QUỐC GIA NĂM 2023
Bài thi: Khoa học tự nhiên; Môn: Hóa Học SỐ 17
Thời gian làm bài: 50 phút, không kể thời gian phát đề
Cho biết nguyên tử khối của các nguyên tố: H=1; O=16; S=32; F=19; Cl=35,5; Br=80; I=127; N=14; P=31; C=12;
Si=28; Li=7; Na=23; K=39; Mg=24; Ca=40; Ba=137; Sr=88; Al=27;Fe=56; Cu=64; Pb=207; Ag=108.
Câu 1: Kim loại nào sau đây dẫn nhiệt tốt gấp 3 lần sắt và bằng 2/3 lần đồng? A. Au. B. Cr. C. Al. D. Ag.
Câu 2: Kim loại nào sau đây là kim loại kiềm? A. Li. B. Ca. C. Zn. D. Ba.
Câu 3: X là chất lỏng, không màu, bốc hơi mạnh trong không khí ẩm. Ở điều kiện thường, khi có ánh sáng, dung
dịch X đặc bị phân hủy một phần giải phóng khí nitơ đioxit. Chất X là A. HNO2. B. H2SO4. C. H3PO4. D. HNO3.
Câu 4: Hợp chất Y có công thức phân tử C4H8O2. Khi cho Y tác dụng với dung dịch NaOH sinh ra chất Z có công
thức C3H5O2Na. Công thức cấu tạo của Y là A. CH3COOC2H5. B. HCOOC3H7. C. C2H5COOCH3. D. C2H5COOC2H5.
Câu 5: Ở điều kiện thích hợp, dung dịch H2S không phản ứng với chất hoặc dung dịch chứa chất nào sau đây? A. O2. B. CuSO4. C. FeSO4. D. Cl2.
Câu 6: Chất nào sau đây thuộc loại amin bậc hai và là chất khí ở điều kiện thường? A. CH3NH2. B. (CH3)3N. C. CH3NHCH3. D. CH3CH2NHCH3.
Câu 7: Kim loại Al phản ứng với dung dịch chứa chất nào sau đây? A. Na2SO4. B. NaHSO4. C. NaNO3. D. MgCl2.
Câu 8: Công thức hóa học của sắt(III) hiđroxit là A. Fe(OH)3. B. Fe2O3. C. Fe2(SO4)3. D. Fe3O4.
Câu 9: Tơ nitron (tơ olon) là sản phẩm trùng hợp của monome nào sau đây? A. CH2=CH−CN. B. CH2=CH−CH=CH2. C. CH3COO−CH=CH2. D. CH2=C(CH3)−COOCH3.
Câu 10: Kim loại nào sau đây có tính khử mạnh nhất A. Fe. B. Sn. C. Ag. D. Au.
Câu 11: Đồng phân của glucozơ là A. xenlulozơ. B. fructozơ. C. saccarozơ. D. sobitol.
Câu 12: Hematit nâu là một loại quặng sắt quan trọng dùng để luyện gang, thép. Thành phần chính của quặng hematit nâu là A. FeCO . B. Fe O . C. Fe O .nH O. D. Fe O . 3 3 4 2 3 2 2 3
Câu 13: Nung nóng hỗn hợp bột gồm a mol Fe và b mol S trong khí trơ, hiệu suất phản ứng bằng 75%, thu được
hỗn hợp rắn Y. Cho Y vào dung dịch HCl dư, sau khi các phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí Z có tỉ
khối so với H2 là 5,0. Tỉ lệ a : b là A. 3 : 1. B. 2 : 1. C. 1 : 2. D. 1 : 3.
Câu 14: Cho hỗn hợp X gồm 0,1 mol Na và 0,2 mol Al vào nước dư, sau phản ứng hoàn toàn thấy thoát ra V lít khí
H2 (đktc). Giá trị của V là A. 7,84. B. 1,12. C. 6,72. D. 4,48.
Câu 15: Cho các chất sau: glyxin, etylamin, phenylamoni clorua, natri phenolat. Số chất phản ứng được với dung dịch HCl là A. 3. B. 4. C. 2. D. 1.
Câu 16: Lên men 45 gam glucozơ để điều chế ancol etylic, hiệu suất phản ứng 80% thu được V lít khí CO2 (đktc). Giá trị của V là A. 11,20. B. 8,96. C. 4,48. D. 5,60. 1
Câu 17: Cho 13,35 gam hỗn hợp X gồm CH2NH2CH2COOH và CH3CHNH2COOH tác dụng với V ml dung dịch
NaOH 1M, KOH 1,5M, thu được dung dịch Y. Biết dung dịch Y tác dụng vừa đủ với 250 ml dung dịch HCl 1M. Giá trị của V là A. 40 ml. B. 150 ml. C. 250 ml. D. 100 ml.
Câu 18: Cho các phát biểu về cách sử dụng hóa chất trong phòng thí nghiệm hóa học:
(1) Không dùng tay trực tiếp cầm hóa chất.
(2) Không đổ hóa chất này vào hóa chất khác.
(3) Hóa chất dùng xong nếu còn thừa, được đổ trở lại bình chứa.
(4) Không dùng hóa chất đựng trong những lọ không có nhãn ghi rõ tên hóa chất.
(5) Không nếm hoặc ngửi trực tiếp hóa chất. Số phát biểu đúng là A. 2. B. 4. C. 3. D. 5.
Câu 19: Chất nào sau đây là chất điện li mạnh? A. NaOH. B. HF. C. CH3COOH. D. C2H5OH.
Câu 20: Cho các chất sau: glucozơ, fructozơ, saccarozơ, tinh bột, xenlulozơ. Những monosaccarit mà dung dịch có
khả năng hòa tan Cu(OH)2 là:
A. saccarozơ và glucozơ.
B. saccarozơ và tinh bột.
C. glucozơ và tinh bột.
D. glucozơ và fructozơ.
Câu 21: Cho các nhận định sau:
(a) Ăn mòn hoá học làm phát sinh dòng điện một chiều.
(b) Để tách lấy Ag ra khỏi hỗn hợp gồm Fe, Cu, Ag ta dùng lượng dư dung dịch Fe2(SO4)3.
(c) Các kim loại dẫn điện được là vì electron tự do trong tinh thể kim loại gây ra.
(d) Các thiết bị máy móc bằng kim loại tiếp xúc với hơi nước ở nhiệt độ cao có khả năng bị ăn mòn hoá học. Số nhận định đúng là A. 2. B. 3. C. 4. D. 1.
Câu 22: Cho C2H4(OH)2 phản ứng với hỗn hợp gồm CH3COOH và HCOOH trong môi trường axit (H2SO4), thu
được tối đa số đieste là A. 5. B. 3. C. 4. D. 2.
Câu 23: Hòa tan Fe3O4 vào dung dịch H2SO4 (loãng, dư), thu được dung dịch X. Cho dãy các chất: KMnO4, Cl2,
Cu, KNO3. Số chất trong dãy tác dụng được với X là A. 3. B. 1. C. 2. D. 4.
Câu 24: Cho các polime: policaproamit, poli(vinyl clorua), polistiren, poli(phenol-fomanđehit), polietilen,
poliisopren. Số polime được điều chế bằng phản ứng trùng hợp là A. 5. B. 2. C. 3. D. 4.
Câu 25: Một loại đá vôi có chứa 80% CaCO3, 10,2% Al2O3 và 9,8% Fe2O3 về khối lượng. Nung đá ở nhiệt độ cao,
thu được chất rắn có khối lượng bằng 73,6% khối lượng đá trước khi nung. Hiệu suất của quá trình phân hủy CaCO3 là A. 37,5%. B. 75%. C. 62,5%. D. 8,25%.
Câu 26: Đốt cháy hoàn toàn 0,05 mol hỗn hợp X gồm ba triglixerit cần vừa đủ 3,75 mol O2 thu được 2,7 mol CO2.
Mặt khác, hiđro hóa hoàn toàn 50,4 gam X (xúc tác Ni, to) thu được hỗn hợp Y. Đun nóng Y với dung dịch KOH
vừa đủ, thu được glixerol và m gam muối. Giá trị của m là A. 54,96. B. 55,44. C. 48,72. D. 55,08.
Câu 27: Cho sơ đồ phản ứng theo đúng tỉ lệ mol: X + 2NaOH X1 + X2 + X3 X1 + H2SO4 X4 (axit ađipic) + Na2SO4 X2 + CO X5 X3 + X5
X6 (este có mùi chuối chín) + H2O 2
Phát biểu sau đây sai?
A. Phân tử khối của X5 là 60.
B. Phân tử khối của X là 230.
C. Phân tử khối của X6 là 130.
D. Phân tử khối của X3 là 74.
Câu 28: Tiến hành các thí nghiệm sau:
(a) Cho dung dịch NaOH vào dung dịch Ca(HCO3)2.
(b) Cho dung dịch HCl tới dư vào dung dịch NaAlO2 (hoặc Na[Al(OH)4]).
(c) Sục khí H2S vào dung dịch FeCl2.
(d) Sục khí NH3 tới dư vào dung dịch AlCl3.
(e) Sục khí CO2 tới dư vào dung dịch NaAlO2 (hoặc Na[Al(OH)4]).
(g) Cho AgNO3 vào dung dịch FeCl3.
Sau khi các phản ứng kết thúc, tổng số thí nghiệm thu được kết tủa là A. 4. B. 6. C. 3. D. 5.
Câu 29: Cho các phát biểu sau:
(a) Trong quá trình điện phân dung dịch NaCl, trên catot xảy ra sự oxi hoá nước.
(b) Trong thực tế, để loại bỏ Cl2 thoát ra trong phòng thí nghiệm ta phun khí NH3 vào phòng.
(c) Khi cho thêm CaCl2 vào nước cứng tạm thời sẽ thu được nước cứng toàn phần.
(d) Nguyên tắc để sản xuất gang là khử quặng sắt oxit bằng than cốc trong lò cao.
(e) Sục H2S vào dung dịch hỗn hợp FeCl3 và CuCl2 thu được 2 loại kết tủa.
(g) Cho NaNO3 (rắn) tác dụng với H2SO4 (đặc, to) để điều chế HNO3 trong phòng thí nghiệm. Số phát biểu đúng là A. 3. B. 2. C. 5. D. 4.
Câu 30: Hỗn hợp khí A chứa hai hiđrocacbon, hỗn hợp khí B chứa O2 và O3 (tỉ khối của B so với H2 là 18,4). Trộn
A và B theo tỉ lệ 1 : 2 về thể tích rồi đốt cháy thì chỉ còn CO2 và hơi H2O theo tỉ lệ 8 : 7 về thể tích. Nếu dẫn 5 lít A
qua nước brom dư thì thể tích khí còn lại 2 lít. Công thức phân tử của hai hiđrocacbon là (các thể tích khí đo cùng
điều kiện nhiệt độ, áp suất) A. CH4 và C3H6. B. CH4 và C4H2. C. CH4 và C2H2. D. CH4 và C3H4.
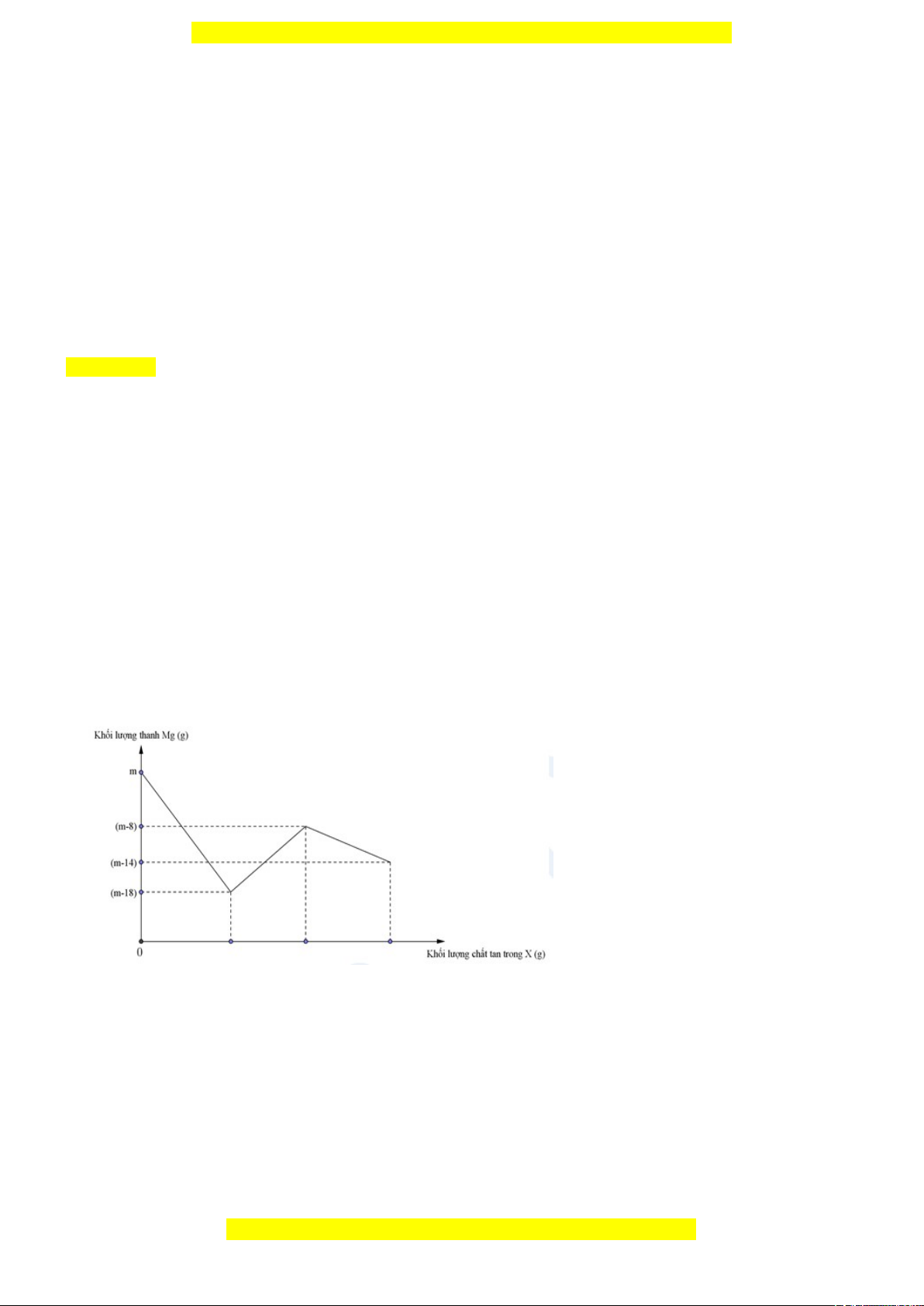
Câu 31: Đồ thị biểu diễn sự phụ thuộc của khối lượng Mg vào dung dịch hỗn hợp X chứa a mol Cu(NO3)2 và b mol
HCl khi nhúng thanh Mg có khối lượng m gam vào dung dịch hỗn hợp X được biểu diễn như hình vẽ dưới đây:
Sau khi phản ứng xảy ra hoàn toàn rút thanh Mg ra, thu được NO là sản phẩm khử duy nhất của N+5. Tỉ lệ a : b là A. 1 : 6. B. 1 : 8. C. 1 : 10. D. 1 : 12.
Câu 32: Cho các phát biểu sau:
(a) Ở nhiệt độ thường, tất cả các amin đều tan nhiều trong nước.
(b) Để rửa sạch ống nghiệm có dính anilin, có thể dùng dung dịch HCl.
(c) Tinh bột được tạo thành trong cây xanh nhờ quá trình quang hợp.
(d) Trong một phân tử chất béo luôn có 6 nguyên tử oxi. 3
(e) Vật liệu compozit có độ bền, độ nhịu nhiệt tốt hơn polime thành phần.
(g) Phản ứng của chất béo với dung dịch kiềm được gọi là phản ứng xà phòng hóa và nó xảy ra chậm hơn phản
ứng thủy phân trong môi trường axit. Số phát biểu đúng là A. 5. B. 2. C. 3. D. 4.
Câu 33: Điện phân (điện cực trơ, hiệu suất điện phân 100%) dung dịch chứa đồng thời 0,15 mol Cu(NO3)2 và 0,12
mol HCl trong thời gian t giờ với cường độ dòng điện không đổi 2,68A thì ở anot thoát ra 0,672 lít khí (đktc) và thu
được dung dịch X. Dung dịch X hòa tan tối đa m gam bột sắt (sản phẩm khử của NO là khí NO duy nhất). Giá trị 3
của t và m lần lượt là A. 0,6 và 10,08. B. 0,6 và 8,96. C. 0,6 và 9,24. D. 0,5 và 8,96. Câu 34:
Hỗn hợp X gồm (CH3COO)3C3H5, CH3COOCH2CH(OOCCH3)CH2OH, CH3COOH,
CH3COOCH2CHOHCH2OH và CH2OHCHOHCH2OH trong đó CH3COOH chiếm 10% tổng số mol hỗn hợp. Đun
nóng m gam hỗn hợp X với dung dịch NaOH vừa đủ, thu được dung dịch chứa 20,5 gam natri axetat và 0,604m
gam glixerol. Để đốt cháy m gam hỗn hợp X cần V lít O2 (đktc). Giá trị của V gần nhất là A. 25,3. B. 24,6. C. 24,9. D. 25,5.
Câu 35: Hòa tan hoàn toàn m gam hỗn hợp X gồm Al và Al2O3 trong 200,0 ml dung dịch NaOH 2M, thu được
dung dịch Y và 3,36 lít khí H2 (đktc). Thêm 300,0 ml hoặc 700,0 ml dung dịch HCl yM vào dung dịch Y đều thu
được cùng một lượng kết tủa có khối lượng m gam. Giá trị gần nhất của m là A. 6,9. B. 8,0. C. 9,1. D. 8,4.
Câu 36: Cho các bước ở thí nghiệm sau:
- Bước 1: Nhỏ vài giọt anilin vào ống nghiệm chứa 10 ml nước cất, lắc đều, sau đó để yên.
- Bước 2: Nhỏ tiếp dung dịch HCl đặc vào ống nghiệm.
- Bước 3: Cho tiếp dung dịch NaOH loãng (dùng dư), đun nóng.
Nhận định nào sau đây là sai?
A. Kết thúc bước 1, nhúng quỳ tím vào thấy quỳ tím không đổi màu.
B. Ở bước 2 thì anilin tan dần.
C. Kết thúc bước 3, thu được dung dịch trong suốt.
D. Ở bước 1, anilin hầu như không tan, nó tạo vẩn đục và lắng xuống đáy.
Câu 37: Cho 3 ống nghiệm riêng biệt lần lượt chứa 3 chất tan X, Y, Z trong nước (tỉ lệ mol nX : nY : nZ = 1 : 2 : 3).
Tiến hành các thí nghiệm sau:
- Thí nghiệm 1: Cho dung dịch KOH dư lần lượt vào 3 ống nghiệm trên thì thu được tổng số mol kết tủa trong 3 ống nghiệm là a mol.
- Thí nghiệm 2: Cho dung dịch Ca(OH)2 dư lần lượt vào 3 ống nghiệm trên thì thu được tổng số mol kết tủa
trong 3 ống nghiệm là b mol.
- Thí nghiệm 3: Đun nóng 3 ống nghiệm trên thu được tổng số mol kết tủa trong 3 ống nghiệm là c mol. Biết
các phản ứng xảy ra hoàn toàn và c < a < b. Ba chất X, Y, Z lần lượt là
A. Al(NO3)3, Ca(HCO3)2, Ba(HCO3)2.
B. Ba(HCO3)2, Ba(NO3)2, Ca(HCO3)2.
C. Ca(HCO3)2, Fe(NO3)2, Al(NO3)3.
D. Ca(HCO3)2, Ba(NO3)2, Al(NO3)3.
Câu 38: Hỗn hợp E gồm 3 chất: X (là este của amino axit); Y và Z là hai peptit mạch hở, hơn kém nhau một
nguyên tử nitơ (đều chứa ít nhất hai loại gốc amino axit, MY < MZ). Cho 36 gam E tác dụng vừa đủ với 0,44 mol
NaOH, thu được 7,36 gam ancol no, đơn chức, mạch hở và 45,34 gam ba muối của glyxin, alanin, valin (trong đó
có 0,1 mol muối của alanin). Mặt khác, đốt cháy hoàn toàn 36 gam E trong O2 dư, thu được CO2, N2 và 1,38 mol
H2O. Phần trăm khối lượng của Y trong E là A. 18,39%. B. 20,72%. C. 27,58%. D. 43,33%.
Câu 39: Hòa tan hoàn toàn 8,6 gam hỗn hợp Al, Mg, Fe, Zn vào 100 gam dung dịch gồm KNO3 1M và H2SO4 2M,
thu được dung dịch X chứa 43,25 gam muối trung hòa và hỗn hợp khí Y (trong đó H2 chiếm 4% khối lượng Y).
Cho một lượng KOH vào X, thu được dung dịch chỉ chứa một chất tan và kết tủa Z (không có khí thoát ra). Nung Z
trong không khí đến khối lượng không đổi được 12,6 gam chất rắn. Nồng độ phần trăm của FeSO4 trong X gần giá
trị nào nhất sau đây? A. 7,50%. B. 7,00%. C. 7,75%. D. 7,25%. 4
Bộ 30 đề thi thử THPTQG môn Hóa học năm 2023 - GV Nguyễn Minh Tuấn có đáp án (Đề 17)
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Đề thi được cập nhật liên tục trong gói này từ nay đến hết tháng 6/2023. Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
-
Bộ 30 đề thi THPT Quốc gia môn Hóa học năm 2022-2023 có lời giải chi tiết được thầy Nguyễn Minh Tuấn biên soạn công phu bám sát đề thi minh họa của Bộ GD&ĐT.
-
File word có lời giải chi tiết 100%.
-
Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(984 )Trọng Bình
Giúp ích cho tôi rất nhiều
Duy Trần
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 12
Xem thêmTài liệu bộ mới nhất