CHƯƠNG 6: HIĐROCACBON KHÔNG NO BÀI 18. ANKEN Mục tiêu Kiến thức
+ Nêu được công thức chung, đặc điểm cấu tạo phân tử, đồng phân cấu tạo và đồng phân hình học, danh pháp của anken.
+ Trình bày được tính chất vật lí chung và phương pháp điều chế, ứng dụng của anken.
+ Trình bày được tính chất hóa học (phản ứng cộng, phản ứng trùng hợp, phản ứng oxi hóa) của anken. Kĩ năng
+ Viết được công thức cấu tạo và gọi tên của các đồng phân anken.
+ Viết được các phương trình hóa học minh họa tính chất hóa học của anken.
+ Phân biệt được một số anken với ankan cụ thể bằng phương pháp hóa học.
+ Giải được các bài tập liên quan đến anken. Trang 1
I. LÍ THUYẾT TRỌNG TÂM
1. Đồng đẳng, đồng phân, danh pháp
a. Dãy đồng đẳng anken là những hiđrocacbon mạch hở, trong phân tử có 1 liên kết đôi , có công thức phân tử chung là .
Ví dụ: C2H4, C3H6, C4H8,… b. Đồng phân
Đồng phân cấu tạo: Từ C4H8 trở đi, có đồng phân về mạch cacbon và đồng phân về vị trí liên kết đôi. Đồng phân hình học:
Đồng phân cis-: có mạch chính nằm ở cùng phía liên kết đôi.
Đồng phân trans-: có mạch chính nằm ở hai phía khác nhau của liên kết đôi.
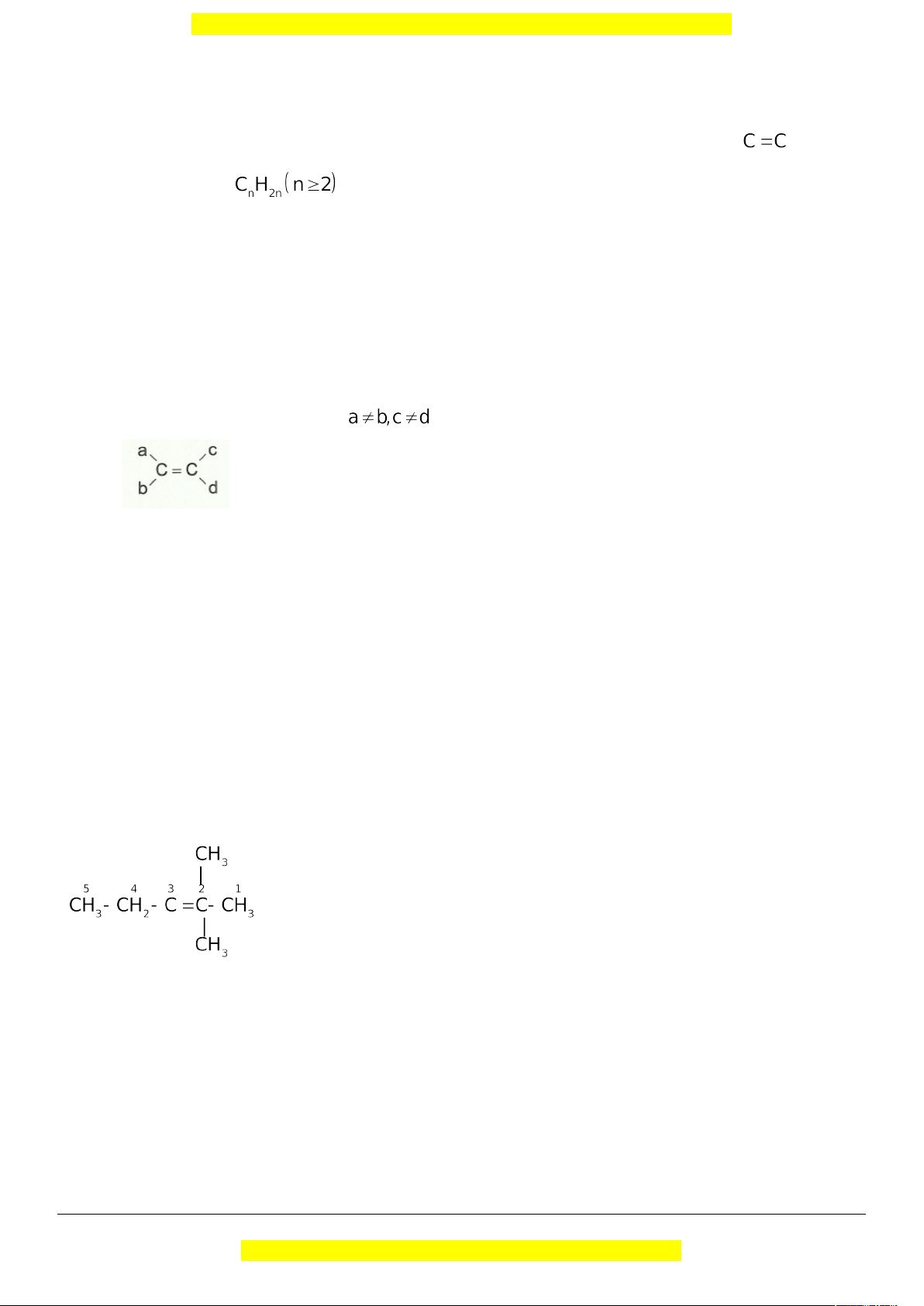
Điều kiện để có đồng phân hình học: . c. Danh pháp
Tên thông thường: Từ tên ankan cùng số cacbon, đổi đuôi “an” thành đuôi “ilen”.
Tên thay thế của anken = Số chỉ vị trí nhánh + Tên nhánh + Tên mạch chính
+ số chỉ vị trí liên kết đôi + en
Mạch chính: Mạch dài nhất có chứa liên kết đôi.
Đánh số thứ tự trên mạch chính từ phía gần liên kết đôi hơn.
Gọi tên nhánh theo thứ tự vần chữ cái cùng với số chỉ của nhánh.
Ví dụ: C2H4 : etilen; C3H6 : propilen; C4H8 : butilen
Đọc tên: 2,3-đimetylpent-2-en.
2. Tính chất vật lí
Điều kiện thường, các anken từ C2H4 đến C4H8 là chất khí, từ C5H10 trở đi là chất lỏng hoặc rắn.
Nhiệt độ sôi, nhiệt độ nóng chảy và khối lượng riêng của anken tăng theo chiều tăng của phân tử khối.
Các anken nhẹ hơn trước, hầu như không tan trong nước.
3. Tính chất hóa học Trang 2
Liên kết đôi
gồm 1 liên kết bền và 1 liên kết kém bền, dễ bị phân cắt trong các phản ứng hóa học.
a. Phản ứng cộng
Cộng H2 tạo ankan tương ứng: Ví dụ:
Cộng halogen X2 (Cl2, Br2): Ví dụ:
(màu nâu đỏ) (không màu)
Dùng dung dịch brom làm thuốc thử để nhận biết anken.
Cộng HX (X: OH, Cl, Br,…): Ví dụ:
Các anken có cấu tạo phân tử không đối xứng khi cộng HX có thể cho hỗn hợp hai sản phẩm.
Quy tắc cộng Mac-côp-nhi-côp định hướng sản phẩm chính: nguyên tử H được cộng vào nguyên tử C có nhiều H hơn. Ví dụ:
b. Phản ứng trùng hợp
Phản ứng trùng hợp là quá trình kết hợp liên tiếp nhiều phân tử nhỏ giống nhau hoặc tương tự nhau
(monome) tạo thành những phân tử rất lớn gọi là polime.
Điều kiện để monome tham gia phản ứng trùng hợp là phân tử phải có liên kết Ví dụ:
c. Phản ứng oxi hóa
Phản ứng oxi hóa hoàn toàn: Trang 3
Ví dụ:
Nhận xét: Khi đốt anken luôn có
Phản ứng oix hóa không hoàn toàn: Ví dụ: (etylen glicol)
Nhận xét: Các đồng đẳng của anken đều làm mất màu dung dịch thuốc tím (KMnO4). 4. Điều chế
a. Trong phòng thí nghiệm
Etilen được điều chế từ ancol etylic
b. Trong công nghiệp
Các anken được điều chế từ ankan bằng phản ứng tách hiđro: Ví dụ: 5. Ứng dụng
Các anken và dẫn xuất của anken là nguyên liệu cho nhiều quá trình sản xuất hóa học.
Dùng làm chất đầu tổng hợp các polime có nhiều ứng dụng như chất dẻo PE, PVC…
Nguyên liệu cho công nghiệp hóa học Dung môi, axit hữu cơ. Trang 4
Bộ chuyên đề đầy đủ môn Hóa học 11 năm 2023 - Chương 6: Hidrocacbon không no
659
330 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Tài liệu được cập nhật liên tục trong gói này từ nay đến hết tháng 6/2023. Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu bộ chuyên đề môn Hóa học 11 năm 2023 - Chương 6: Hidrocacbon không no bao gồm: Bài 18: Anken; Bài 19: Ankađien; Bài 20: Ankin mới nhất năm 2022 - 2023 nhằm giúp Giáo viên có thêm tài liệu tham khảo chuyên đề luyện thi Hóa học lớp 11.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(659 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 11
Xem thêmTài liệu bộ mới nhất

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
CHƯƠNG 6: HIĐROCACBON KHÔNG NO
BÀI 18. ANKEN
Mục tiêu
Kiến thức
+ Nêu được công thức chung, đặc điểm cấu tạo phân tử, đồng phân cấu tạo và đồng phân hình
học, danh pháp của anken.
+ Trình bày được tính chất vật lí chung và phương pháp điều chế, ứng dụng của anken.
+ Trình bày được tính chất hóa học (phản ứng cộng, phản ứng trùng hợp, phản ứng oxi hóa) của
anken.
Kĩ năng
+ Viết được công thức cấu tạo và gọi tên của các đồng phân anken.
+ Viết được các phương trình hóa học minh họa tính chất hóa học của anken.
+ Phân biệt được một số anken với ankan cụ thể bằng phương pháp hóa học.
+ Giải được các bài tập liên quan đến anken.
Trang 1
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
I. LÍ THUYẾT TRỌNG TÂM
1. Đồng đẳng, đồng phân, danh pháp
a. Dãy đồng đẳng anken là những hiđrocacbon mạch hở, trong phân tử có 1 liên kết đôi , có công
thức phân tử chung là .
Ví dụ: C
2
H
4
, C
3
H
6
, C
4
H
8
,…
b. Đồng phân
Đồng phân cấu tạo: Từ C
4
H
8
trở đi, có đồng phân về mạch cacbon và đồng phân về vị trí liên kết đôi.
Đồng phân hình học:
Đồng phân cis-: có mạch chính nằm ở cùng phía liên kết đôi.
Đồng phân trans-: có mạch chính nằm ở hai phía khác nhau của liên kết đôi.
Điều kiện để có đồng phân hình học: .
c. Danh pháp
Tên thông thường: Từ tên ankan cùng số cacbon, đổi đuôi “an” thành đuôi “ilen”.
Tên thay thế của anken = Số chỉ vị trí nhánh
+ Tên nhánh
+ Tên mạch chính
+ số chỉ vị trí liên kết đôi + en
Mạch chính: Mạch dài nhất có chứa liên kết đôi.
Đánh số thứ tự trên mạch chính từ phía gần liên kết đôi hơn.
Gọi tên nhánh theo thứ tự vần chữ cái cùng với số chỉ của nhánh.
Ví dụ: C
2
H
4
: etilen; C
3
H
6
: propilen; C
4
H
8
: butilen
Đọc tên: 2,3-đimetylpent-2-en.
2. Tính chất vật lí
Điều kiện thường, các anken từ C
2
H
4
đến C
4
H
8
là chất khí, từ C
5
H
10
trở đi là chất lỏng hoặc rắn.
Nhiệt độ sôi, nhiệt độ nóng chảy và khối lượng riêng của anken tăng theo chiều tăng của phân tử khối.
Các anken nhẹ hơn trước, hầu như không tan trong nước.
3. Tính chất hóa học
Trang 2
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Liên kết đôi gồm 1 liên kết bền và 1 liên kết kém bền, dễ bị phân cắt trong các phản ứng hóa
học.
a. Phản ứng cộng
Cộng H
2
tạo ankan tương ứng:
Ví dụ:
Cộng halogen X
2
(Cl
2
, Br
2
):
Ví dụ:
(màu nâu đỏ) (không màu)
Dùng dung dịch brom làm thuốc thử để nhận biết anken.
Cộng HX (X: OH, Cl, Br,…):
Ví dụ:
Các anken có cấu tạo phân tử không đối xứng khi cộng HX có thể cho hỗn hợp hai sản phẩm.
Quy tắc cộng Mac-côp-nhi-côp định hướng sản phẩm chính: nguyên tử H được cộng vào nguyên tử C
có nhiều H hơn.
Ví dụ:
b. Phản ứng trùng hợp
Phản ứng trùng hợp là quá trình kết hợp liên tiếp nhiều phân tử nhỏ giống nhau hoặc tương tự nhau
(monome) tạo thành những phân tử rất lớn gọi là polime.
Điều kiện để monome tham gia phản ứng trùng hợp là phân tử phải có liên kết
Ví dụ:
c. Phản ứng oxi hóa
Phản ứng oxi hóa hoàn toàn:
Trang 3
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Ví dụ:
Nhận xét: Khi đốt anken luôn có
Phản ứng oix hóa không hoàn toàn:
Ví dụ:
(etylen glicol)
Nhận xét: Các đồng đẳng của anken đều làm mất màu dung dịch thuốc tím (KMnO
4
).
4. Điều chế
a. Trong phòng thí nghiệm
Etilen được điều chế từ ancol etylic
b. Trong công nghiệp
Các anken được điều chế từ ankan bằng phản ứng tách hiđro:
Ví dụ:
5. Ứng dụng
Các anken và dẫn xuất của anken là nguyên liệu cho nhiều quá trình sản xuất hóa học.
Dùng làm chất đầu tổng hợp các polime có nhiều ứng dụng như chất dẻo PE, PVC…
Nguyên liệu cho công nghiệp hóa học
Dung môi, axit hữu cơ.
Trang 4
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
SƠ ĐỒ HỆ THỐNG HÓA
II. CÁC DẠNG BÀI TẬP
Dạng 1: Lí thuyết liên quan đến đồng phân, danh pháp, tính chất của anken, điều chế ứng dụng của
anken
Kiểu hỏi 1: Đặc điểm phân tử, danh pháp
Ví dụ mẫu
Ví dụ 1: Anken X có công thức cấu tạo: Tên của X là
A. isohexan. B. 3-metylpent-3-en. C. 3-metylpent-2-en. D. 2-etylbut-2-en.
Trang 5
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
ANKEN
CẤU TẠO
PHÂN TỬ
KHÁI NIỆM
Anken là hiđrocacbon mạch hở, trong phân tử có 1 liên kết đôi
, có công thức chung là
TÍNH CHẤT
HÓA HỌC
Phản ứng
cộng
Cộng hiđro:
Cộng HX: Theo nguyên tắc
Mac-côp-nhi-côp
Cộng halogen:
Phản ứng
trùng hợp
t ,xt
2 2 2 2 nn
nCH CH (CH CH )
Phản ứng
oxi hóa
Oxi hóa hoàn toàn:
Oxi hóa không hoàn toàn:






















