CHƯƠNG 1. SỰ ĐIỆN LI BÀI 1. SỰ ĐIỆN LI Mục tiêu Kiến thức
+ Nêu được các khái niệm về sự điện li, chất điện li, chất điện li mạnh, chất điện li yếu.
+ Giải thích được nguyên nhân về tính dẫn điện của dung dịch chất điện li. Kĩ năng
+ Viết được các phương trình điện li.
+ Phân biệt được chất điện li, chất không điện li, chất điện li mạnh, chất điện li yếu. Trang 1
I. LÍ THUYẾT TRỌNG TÂM
a. Những chất dẫn điện, không dẫn điện
Dung dịch axit, bazơ và muối đều dẫn điện.
Các chất rắn khan: NaCl, NaOH và một số dung dịch rượu, đường… không dẫn điện.
Ví dụ: Axit HCl, HNO3; dung dịch bazơ NaOH, KOH; dung dịch muối NaCl, K2SO4… dẫn điện được.
b. Nguyên nhân tính dẫn điện của các dung dịch axit, bazơ và muối trong nước
Tính dẫn điện qua các dung dịch axit, bazơ và muối là do dung dịch của chúng có các tiểu phân mang
điện tích chuyển động tự do được gọi là ion.
Axit, bazơ, muối là những chất điện li.
Quá trình phân li các chất trong nước ra ion là sự điện li.
Những chất tan trong nước phân li ra ion được gọi là những chất điện li.
Sự điện li được biểu diễn bằng phương trình điện li. Ví dụ:
2. Phân loại các chất điện li
a. Chất điện li mạnh
Chất điện li mạnh là chất tan trong nước, các phân tử hòa tan đều phân li ra ion.
Những chất điện li mạnh:
+ Các axit mạnh: HCl, HNO3, HClO4, H2SO4,…
+ Các bazơ mạnh: NaOH, KOH, Ba(OH)2,… + Các muối tan.
Trong phương trình điện li của chất điện li mạnh người ta dùng một mũi tên chỉ chiều của quá trình điện li. Ví dụ:
b. Chất điện li yếu
Chất điện li yếu là chất khi tan trong nước chỉ có một số phân tử hòa tan phân li ra ion, phần còn lại vẫn
tồn tại dưới dạng phân tử trong dung dịch.
Những chất điện li yếu:
+ Các axit yếu như: CH3COOH, HClO, H2S, HF, H2SO3,…
+ Các bazơ không tan như: Mg(OH)2, Fe(OH)3,…
+ Các muối không tan: CaCO3, BaSO4,…
Trong phương trình điện li của chất điện li yếu người ta dùng hai mũi tên chỉ ngược chiều nhau. Ví dụ: Trang 2
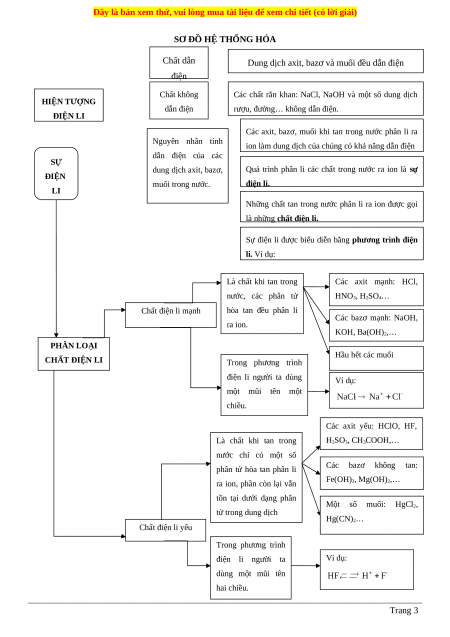
SƠ ĐỒ HỆ THỐNG HÓA Chất dẫn
Dung dịch axit, bazơ và muối đều dẫn điện điện Chất không
Các chất rắn khan: NaCl, NaOH và một số dung dịch HIỆN TƯỢNG dẫn điện
rượu, đường… không dẫn điện. ĐIỆN LI
Các axit, bazơ, muối khi tan trong nước phân li ra Nguyên nhân tính
ion làm dung dịch của chúng có khả năng dẫn điện dẫn điện của các SỰ dung dịch axit, bazơ,
Quá trình phân li các chất trong nước ra ion là sự ĐIỆN muối trong nước. điện li. LI
Những chất tan trong nước phân li ra ion được gọi
là những chất điện li.
Sự điện li được biểu diễn bằng phương trình điện li. Ví dụ: Là chất khi tan trong Các axit mạnh: HCl, nước, các phân tử HNO3, H2SO4… Chất điện li mạnh hòa tan đều phân li Các bazơ mạnh: NaOH, ra ion. KOH, Ba(OH)2,… PHÂN LOẠI Hầu hết các muối CHẤT ĐIỆN LI Trong phương trình điện li người ta dùng Ví dụ: một mũi tên một chiều. Các axit yếu: HClO, HF, Là chất khi tan trong H2SO3, CH3COOH,… nước chỉ có một số phân tử hòa tan phân li Các bazơ không tan:
ra ion, phần còn lại vẫn Fe(OH)3, Mg(OH)2,…
tồn tại dưới dạng phân Một số muối: HgCl2, tử trong dung dịch Hg(CN)2… Chất điện li yếu Trong phương trình điện li người ta Ví dụ: dùng một mũi tên hai chiều. Trang 3
II. CÁC DẠNG BÀI TẬP
Kiểu hỏi 1: Xác định chất điện li Phương pháp giải
Những chất tan trong nước phân li ra ion được gọi là những chất điện li.
Các dung dịch axit, bazơ và muối là các chất điện li.
Ví dụ: Cho các chất sau: H2S, SO2, Cl2, H2SO3, CH4, NaHCO3, Ca(OH)2, HF, C6H6, NaClO. Chất nào là chất điện li?
Hướng dẫn giải
Ta có: các dung dịch axit, bazơ, muối là các chất điện li.
Những chất điện li là: H2S, H2SO3, NaHCO3, Ca(OH)2, HF, NaClO. Ví dụ mẫu
Ví dụ 1: Cho các chất sau: NaCl, HF, CuSO4, Mg3(PO4)2, AgNO3, HNO3, C6H12O6 (glucozơ), CH3OH,
CH3COONa., C2H5OH. Số chất điện li là A. 4. B. 5. C. 6. D. 7.
Hướng dẫn giải
Ta có: các dung dịch axit, bazơ, muối là các chất điện li.
Có 7 chất điện li là: NaCl, HF, CuSO4, Mg3(PO4)2, AgNO3, HNO3, CH3COONa. Chọn D.
Kiểu hỏi 2: Phân biệt chất điện li mạnh, chất điện li yếu Phương pháp giải Chất điện li mạnh
Các axit mạnh: HCl, HNO3, H2SO4…
Các bazơ mạnh: NaOH, Ba(OH)2…
Hầu hết các muối: NaCl, K2SO4… Chất điện li yếu
Axit yếu và trung bình: CH3COOH, HClO, H2S…
Bazơ yếu: Mg(OH)2, Fe(OH)3…
Một số muối: CaCO3, BaSO4…
Ví dụ: Cho các chất sau: NaCl, HF, CuSO4, NaOH, Mg(NO3)2, H3PO4, (NH4)3PO4, H2CO3, ancol etylic
(C2H5OH), CH3COOH, AgNO3, glucozơ (C6H12O6), glixerol (C3H8O3), Al(OH)3, Fe(OH)2, HNO3.
Chất nào là chất điện li mạnh, chất điện li yếu?
Hướng dẫn giải
Chất điện li mạnh: NaCl, CuSO4, NaOH, Mg(NO3)2, (NH4)3PO4, AgNO3, HNO3.
Chất điện li yếu: HF, H3PO4, H2CO3, CH3COOH, Al(OH)3, Fe(OH)2. Ví dụ mẫu Trang 4
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Bộ tài liệu bao gồm: 11 tài liệu lẻ (mua theo bộ tiết kiệm đến 50%)
- Tailieugiaovien.com.vn giới thiệu bộ chuyên đề đầy đủ môn Hóa 11 bao gồm: Chương 1: Sự điện li; Chương 2: Nito - Photpho; Chương 3: Cacbon - Silic; Chương 4: Đại cương về hóa học hữu cơ; Chương 5: Hidrocacbon no; Chương 6: Hidrocacbon không no; Chương 7: Hidrocacbon thơm - Nguồn hidrocacbon thiên nhiên - Hệ thống hóa về hidrocacbon; Chương 8: Ancol - Phenol; Chương 9: Andehit - Axit cacboxylic; Đề kiểm tra học kì 1; Đề kiểm tra học kì 2 cực hay nhằm giúp Giáo viên có thêm tài liệu tham khảo chuyên đề luyện thi Hóa lớp 11.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(1101 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 11
Xem thêmTài liệu bộ mới nhất

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
CHƯƠNG 1. SỰ ĐIỆN LI
BÀI 1. SỰ ĐIỆN LI
Mục tiêu
Kiến thức
+ Nêu được các khái niệm về sự điện li, chất điện li, chất điện li mạnh, chất điện li yếu.
+ Giải thích được nguyên nhân về tính dẫn điện của dung dịch chất điện li.
Kĩ năng
+ Viết được các phương trình điện li.
+ Phân biệt được chất điện li, chất không điện li, chất điện li mạnh, chất điện li yếu.
Trang 1
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
I. LÍ THUYẾT TRỌNG TÂM
a. Những chất dẫn điện, không dẫn điện
Dung dịch axit, bazơ và muối đều dẫn điện.
Các chất rắn khan: NaCl, NaOH và một số dung dịch rượu, đường… không dẫn điện.
Ví dụ: Axit HCl, HNO
3
; dung dịch bazơ NaOH, KOH; dung dịch muối NaCl, K
2
SO
4
… dẫn điện được.
b. Nguyên nhân tính dẫn điện của các dung dịch axit, bazơ và muối trong nước
Tính dẫn điện qua các dung dịch axit, bazơ và muối là do dung dịch của chúng có các tiểu phân mang
điện tích chuyển động tự do được gọi là ion.
Axit, bazơ, muối là những chất điện li.
Quá trình phân li các chất trong nước ra ion là sự điện li.
Những chất tan trong nước phân li ra ion được gọi là những chất điện li.
Sự điện li được biểu diễn bằng phương trình điện li.
Ví dụ:
2. Phân loại các chất điện li
a. Chất điện li mạnh
Chất điện li mạnh là chất tan trong nước, các phân tử hòa tan đều phân li ra ion.
Những chất điện li mạnh:
+ Các axit mạnh: HCl, HNO
3
, HClO
4
, H
2
SO
4
,…
+ Các bazơ mạnh: NaOH, KOH, Ba(OH)
2
,…
+ Các muối tan.
Trong phương trình điện li của chất điện li mạnh người ta dùng một mũi tên chỉ chiều của quá trình điện
li.
Ví dụ:
b. Chất điện li yếu
Chất điện li yếu là chất khi tan trong nước chỉ có một số phân tử hòa tan phân li ra ion, phần còn lại vẫn
tồn tại dưới dạng phân tử trong dung dịch.
Những chất điện li yếu:
+ Các axit yếu như: CH
3
COOH, HClO, H
2
S, HF, H
2
SO
3
,…
+ Các bazơ không tan như: Mg(OH)
2
, Fe(OH)
3
,…
+ Các muối không tan: CaCO
3
, BaSO
4
,…
Trong phương trình điện li của chất điện li yếu người ta dùng hai mũi tên chỉ ngược chiều nhau.
Ví dụ:
Trang 2
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
SƠ ĐỒ HỆ THỐNG HÓA
Trang 3
PHÂN LOẠI
CHẤT ĐIỆN LI
Chất điện li mạnh
Là chất khi tan trong
nước, các phân tử
hòa tan đều phân li
ra ion.
Các axit mạnh: HCl,
HNO
3
, H
2
SO
4
…
Các bazơ mạnh: NaOH,
KOH, Ba(OH)
2
,…
Hầu hết các muối
Trong phương trình
điện li người ta dùng
một mũi tên một
chiều.
Ví dụ:
Chất điện li yếu
Là chất khi tan trong
nước chỉ có một số
phân tử hòa tan phân li
ra ion, phần còn lại vẫn
tồn tại dưới dạng phân
tử trong dung dịch
Các axit yếu: HClO, HF,
H
2
SO
3
, CH
3
COOH,…
Các bazơ không tan:
Fe(OH)
3
, Mg(OH)
2
,…
Một số muối: HgCl
2
,
Hg(CN)
2
…
Trong phương trình
điện li người ta
dùng một mũi tên
hai chiều.
Ví dụ:
SỰ
ĐIỆN
LI
HIỆN TƯỢNG
ĐIỆN LI
Chất dẫn
điện
Chất không
dẫn điện
Dung dịch axit, bazơ và muối đều dẫn điện
Các chất rắn khan: NaCl, NaOH và một số dung dịch
rượu, đường… không dẫn điện.
Nguyên nhân tính
dẫn điện của các
dung dịch axit, bazơ,
muối trong nước.
Các axit, bazơ, muối khi tan trong nước phân li ra
ion làm dung dịch của chúng có khả năng dẫn điện
Quá trình phân li các chất trong nước ra ion là sự
điện li.
Những chất tan trong nước phân li ra ion được gọi
là những chất điện li.
Sự điện li được biểu diễn bằng phương trình điện
li. Ví dụ:

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
II. CÁC DẠNG BÀI TẬP
Kiểu hỏi 1: Xác định chất điện li
Phương pháp giải
Những chất tan trong nước phân li ra ion được gọi là những chất điện li.
Các dung dịch axit, bazơ và muối là các chất điện li.
Ví dụ: Cho các chất sau: H
2
S, SO
2
, Cl
2
, H
2
SO
3
, CH
4
, NaHCO
3
, Ca(OH)
2
, HF, C
6
H
6
, NaClO. Chất nào là
chất điện li?
Hướng dẫn giải
Ta có: các dung dịch axit, bazơ, muối là các chất điện li.
Những chất điện li là: H
2
S, H
2
SO
3
, NaHCO
3
, Ca(OH)
2
, HF, NaClO.
Ví dụ mẫu
Ví dụ 1: Cho các chất sau: NaCl, HF, CuSO
4
, Mg
3
(PO
4
)
2
, AgNO
3
, HNO
3
, C
6
H
12
O
6
(glucozơ), CH
3
OH,
CH
3
COONa., C
2
H
5
OH. Số chất điện li là
A. 4. B. 5. C. 6. D. 7.
Hướng dẫn giải
Ta có: các dung dịch axit, bazơ, muối là các chất điện li.
Có 7 chất điện li là: NaCl, HF, CuSO
4
, Mg
3
(PO
4
)
2
, AgNO
3
, HNO
3
, CH
3
COONa.
Chọn D.
Kiểu hỏi 2: Phân biệt chất điện li mạnh, chất điện li yếu
Phương pháp giải
Chất điện li mạnh
Các axit mạnh: HCl, HNO
3
, H
2
SO
4
…
Các bazơ mạnh: NaOH, Ba(OH)
2
…
Hầu hết các muối: NaCl, K
2
SO
4
…
Chất điện li yếu
Axit yếu và trung bình: CH
3
COOH, HClO, H
2
S…
Bazơ yếu: Mg(OH)
2
, Fe(OH)
3
…
Một số muối: CaCO
3
, BaSO
4
…
Ví dụ: Cho các chất sau: NaCl, HF, CuSO
4
, NaOH, Mg(NO
3
)
2
, H
3
PO
4
, (NH
4
)
3
PO
4
, H
2
CO
3
, ancol etylic
(C
2
H
5
OH), CH
3
COOH, AgNO
3
, glucozơ (C
6
H
12
O
6
), glixerol (C
3
H
8
O
3
), Al(OH)
3
, Fe(OH)
2
, HNO
3
.
Chất nào là chất điện li mạnh, chất điện li yếu?
Hướng dẫn giải
Chất điện li mạnh: NaCl, CuSO
4
, NaOH, Mg(NO
3
)
2
, (NH
4
)
3
PO
4
, AgNO
3
, HNO
3
.
Chất điện li yếu: HF, H
3
PO
4
, H
2
CO
3
, CH
3
COOH, Al(OH)
3
, Fe(OH)
2
.
Ví dụ mẫu
Trang 4

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Ví dụ 1: Cho các chất sau: CH
3
COOH, HClO, H
3
PO
4
, NaOH, HgCl
2
, NH
4
NO
3
, HClO
4
, Zn(OH)
2
,
K
2
Cr
2
O
7
, HNO
3
, KMnO
4
, HI. Số chất điện li mạnh là
A. 7. B. 8. C. 5. D. 6.
Hướng dẫn giải
Có 7 chất điện li mạnh là: NaOH, NH
4
NO
3
, HClO
4
, K
2
Cr
2
O
7
, HNO
3
, KMnO
4
, HI.
Chọn A.
Kiểu hỏi 3: Cách nhận dạng phương trình điện li viết đúng của các chất (nếu có)
Phương pháp giải
Trong phương trình điện li của chất điện li mạnh người ta dùng một mũi tên chỉ chiều của quá trình điện
li.
Trong phương trình điện li của chất điện li yếu người ta dùng hai mũi tên chỉ ngược chiều nhau.
Ví dụ: Phương trình điện li viết đúng là
A.
B.
C.
D.
Hướng dẫn giải
HNO
3
, NaOH, H
2
SO
4
là chất điện li mạnh suy ra dùng một mũi tên chỉ chiều của quá trình điện li.
HF là chất điện li yếu suy ra dùng hai mũi tên chỉ ngược chiều của quá trình điện li.
Phương trình D viết đúng.
Chọn D.
Ví dụ mẫu
Ví dụ 1: Cho các phương trình điện li sau:
Số phương trình điện li đúng là
A. 4. B. 3. C. 2. D. 1.
Hướng dẫn giải
NaCl, KOH, HClO
4
là chất điện li mạnh Sử dụng mũi tên một chiều.
Trang 5