CHƯƠNG 9: ANĐEHIT – AXIT CACBOXYLIC BÀI 24: ANĐEHIT Mục tiêu Kiến thức
+ Trình bày được định nghĩa, phân loại, danh pháp của anđehit.
+ Mô tả được đặc điểm cấu tạo phân tử của anđehit.
+ Trình bày được tính chất vật lí của anđehit: trạng thái, nhiệt độ sôi, nhiệt độ nóng chảy, tính tan.
+ Trình bày được tính chất hóa học của anđehit no đơn chức (đại diện là anđehit axetic): Tính
khử (tác dụng với dung dịch bạc nitrat trong amoniac), tính oxi hóa (tác dụng với hiđro).
+ Trình bày được phương pháp đều chế anđehit từ ancol bậc I, điều chế trực tiếp anđehit fomic từ
metan, anđehit axetic từ etilen. Một số ứng dụng chính của anđehit. Kĩ năng
+ Quan sát thí nghiệm, hình ảnh và rút ra nhận xét, dự đoán về cấu tạo và chất hóa học của anđehit.
+ Viết các phương trình hóa học minh họa tính chất hóa học của anđehit fomic và anđehit axetic, axeton.
+ Nhận biết anđehit bằng phản ứng hóa học đặc trưng.
+ Giải được các bài tập có liên quan: tính khối lượng hoặc nồng độ dung dịch anđehit trong phản ứng. Trang 1
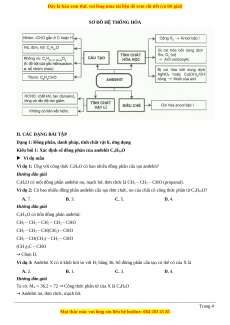
I. LÍ THUYẾT TRỌNG TÂM
1. Đồng đẳng, đồng phân, danh pháp
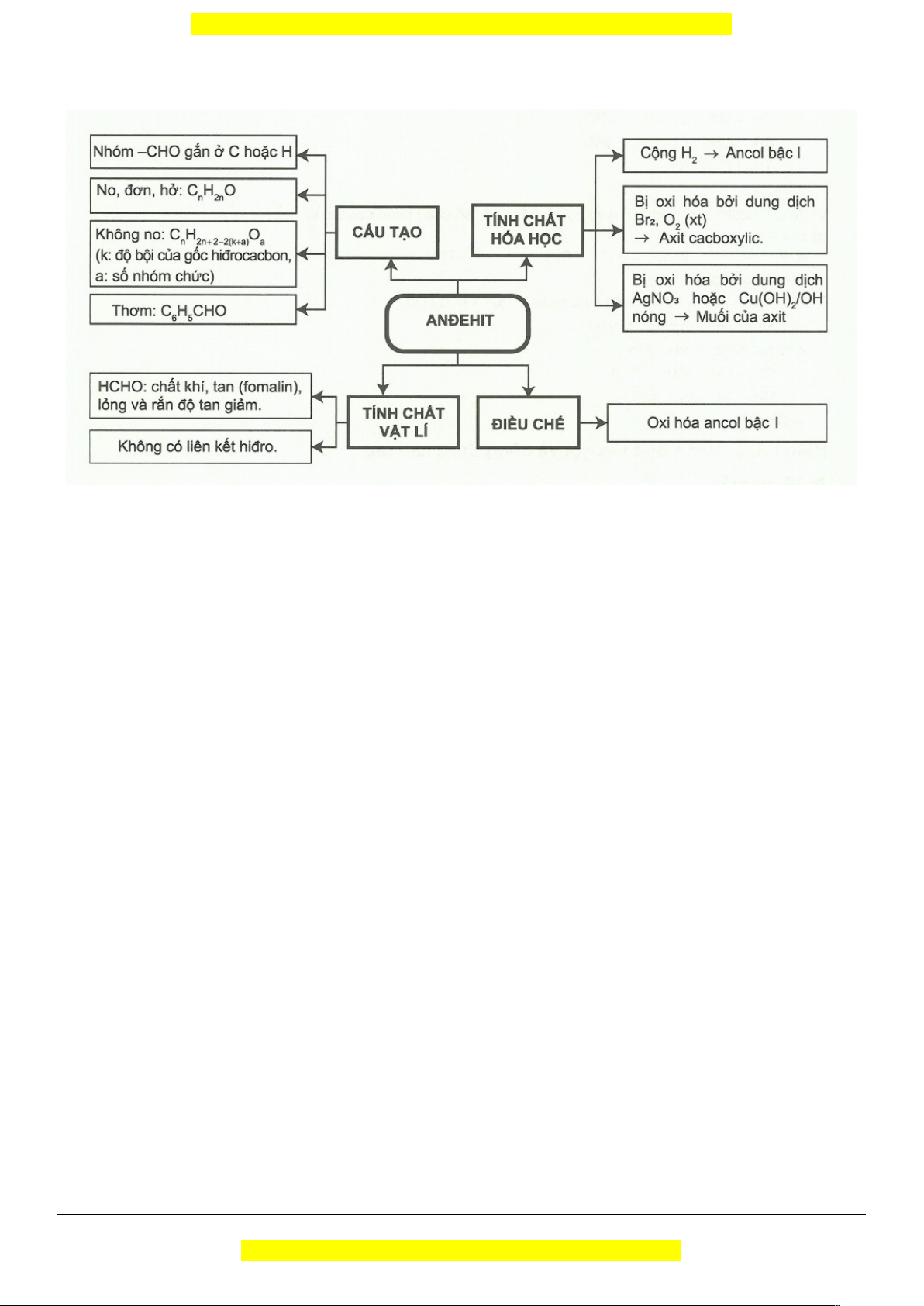
a. Đặc điểm cấu tạo phân tử anđehit.
Nhóm định chức – CH = O liên kết với nguyên tử C hoặc H.
+ Anđehit no, đơn chức, mạch hở: CnH2nO hay Cn-1H2n-1CH = O với
Ví dụ: Dãy đồng đẳng no, đơn, mạch hở:
HCHO: anđehit fomic/fomanđehit/metanal.
CH3CHO: anđehit axetic/axetanđehit/etanal.
C2H5CHO: anđehit propionic/propanal.
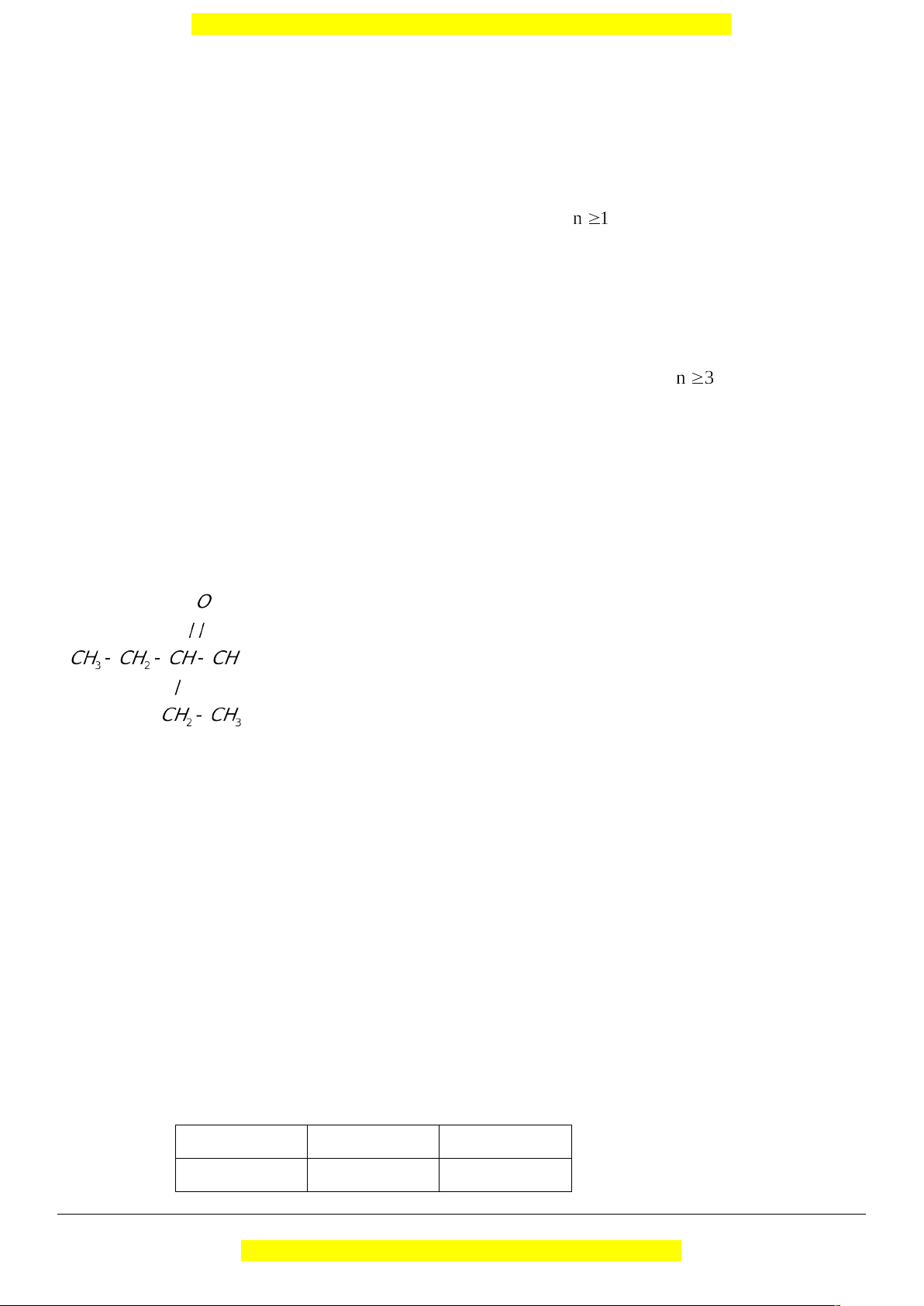
+ Anđehit không no, có một liên kết đôi C = C, đơn chức, mạch hở: CnH2n-2O với . b. Danh pháp
Tên thông thường = anđehit + tên axit tương ứng
(hoặc tên thông thường của axit bỏ “ic” + “anđehit”)
Tên thay thế = Tên IUPAC của hiđrocacbon + al Ví dụ: (2-etylbutanal) c. Đồng phân
Viết các đồng phân cấy tạo CnH2nO (mạch C, vị trí nhóm chức, loại nhóm chức anđehit). Đồng phân cấu
tạo anđehit đơn chức, no, mạch hở viết tương tự ankan: Mạch C (luôn có nhóm CHO ở đầu mạch), vị trí
nhanh ankyl trong mạch chính (nếu có).
Ngoài ra còn có thể viết đòng phân ancol không no có một nối đôi.
Ví dụ: Ứng với công thức C4H8O có hai đồng phân anđehit:
CH3 – CH2 – CH2 – CHO
CH3 – CH(CH3) – CHO
2. Tính chất vật lí
Do không có liên kết H nên anđehit có nhiệt độ sôi, độ tan kém hơn ancol tương ứng nhưng cao hơn
hiđrocacbon vì liên kết CO cũng phân cực.
Ví dụ: So sánh nhiệt độ sôi (ts) của một số chất: Chất Công thức ts(°C) Propan CH3CH2CH3 41,2 Trang 2
Propan–1–ol C2H5CH2OH 97,4 Propanal CH3CH2CHO 48,8
3. Tính chất hóa học
Trong nhóm – CH = O có liên kết đôi C = O gồm một liên kết bền và một liên kết kém bền (tương
tự liên kết đôi C = C trong phân tử anken) nên anđehit có một số tính chất giống anken.
a. Phản ứng cộng H2
Anđehit + H2 → Ancol bậc I Ví dụ:
b. Phản ứng oxi hóa (tác dụng với nước brom, dung dịch thuốc tím, dung dịch bạc nitrat trong
amoniac, Cu(OH)2 trong kiềm nóng)
Anđehit + AgNO3/NH3 → Muối amoni + Ag↓ + NH4NO3
Ví dụ: R – CH = O + 2AgNO3 + H2O + 3NH3
→ R – COONH4 + 2NH4NO3 + 2Ag↓
Trong đó: R – CH = O là chất khử và AgNO3 là chất oxi hóa.
Kết luận: Anđehit vừa thể hiện tính oxi hóa, vừa thể hiện tính khử. 4. Ứng dụng
HCHO: nguyên liệu sản xuất nhựa, dùng làm chất tẩy uế, dùng trong thuộc da.
CH3CHO: sản xuất axit axetic.
Anđehit có nguồn gốc thiên nhiên dùng làm hương liệu. 5. Điều chế
Oxi hóa ancol: Ancol bậc I → Anđehit
Ví dụ: CH3CH2CH2OH + CuO CH3CH2CHO + Cu + H2O Oxi hóa hiđrocacbon:
Ví dụ: CH4 H – CH = O CH2 = CH2 CH3CH = O Trang 3
SƠ ĐỒ HỆ THỐNG HÓA
II. CÁC DẠNG BÀI TẬP
Dạng 1: Đồng phân, danh pháp, tính chất vật lí, ứng dụng
Kiểu hỏi 1: Xác định số đồng phân của anđehit CnH2nO Ví dụ mẫu
Ví dụ 1: Ứng với công thức C3H6O có bao nhiêu đồng phân cấu tạo anđehit?
Hướng dẫn giải
C3H6O có một đồng phân anđehit no, mạch hở, đơn chức là CH3 – CH2 – CHO (propanal).
Ví dụ 2: Có bao nhiêu đồng phân anđehit cấu tạo đơn chức, no của chất có công thức phân tử C5H10O? A. 7. B. 3. C. 5. D. 4.
Hướng dẫn giải
C5H10O có bốn đồng phân anđehit:
CH3 – CH2 – CH2 – CH2 – CHO
CH3 – CH2 – CH(CH3) – CHO
CH3 – CH(CH3) – CH2 – CHO (CH3)3C – CHO → Chọn D.
Ví dụ 3: Anđehit X có tỉ khối hơi so với H2 bằng 36. Số đồmg phân cấu tạo có thể có của X là A. 2. B. 1. C. 3. D. 4. Hướng dẫn giải
Ta có: MX = 36.2 = 72 → Công thức phân tử của X là C4H8O
→ Anđehit no, đơn chức, mạch hở. Trang 4
Bộ chuyên đề đầy đủ môn Hóa học 11 năm 2023 - Chương 9: Andehit - Axit cacboxylic
738
369 lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Tài liệu được cập nhật liên tục trong gói này từ nay đến hết tháng 6/2023. Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu bộ chuyên đề môn Hóa học 11 năm 2023 - Chương 9: Andehit - Axit cacboxylic bao gồm: Bài 24: Andehit; Bài 25. Axit cacboxylic mới nhất năm 2022 - 2023 nhằm giúp Giáo viên có thêm tài liệu tham khảo chuyên đề luyện thi Hóa học lớp 11.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(738 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 11
Xem thêmTài liệu bộ mới nhất

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
CHƯƠNG 9: ANĐEHIT – AXIT CACBOXYLIC
BÀI 24: ANĐEHIT
Mục tiêu
Kiến thức
+ Trình bày được định nghĩa, phân loại, danh pháp của anđehit.
+ Mô tả được đặc điểm cấu tạo phân tử của anđehit.
+ Trình bày được tính chất vật lí của anđehit: trạng thái, nhiệt độ sôi, nhiệt độ nóng chảy, tính
tan.
+ Trình bày được tính chất hóa học của anđehit no đơn chức (đại diện là anđehit axetic): Tính
khử (tác dụng với dung dịch bạc nitrat trong amoniac), tính oxi hóa (tác dụng với hiđro).
+ Trình bày được phương pháp đều chế anđehit từ ancol bậc I, điều chế trực tiếp anđehit fomic từ
metan, anđehit axetic từ etilen. Một số ứng dụng chính của anđehit.
Kĩ năng
+ Quan sát thí nghiệm, hình ảnh và rút ra nhận xét, dự đoán về cấu tạo và chất hóa học của
anđehit.
+ Viết các phương trình hóa học minh họa tính chất hóa học của anđehit fomic và anđehit axetic,
axeton.
+ Nhận biết anđehit bằng phản ứng hóa học đặc trưng.
+ Giải được các bài tập có liên quan: tính khối lượng hoặc nồng độ dung dịch anđehit trong phản
ứng.
Trang 1
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
I. LÍ THUYẾT TRỌNG TÂM
1. Đồng đẳng, đồng phân, danh pháp
a. Đặc điểm cấu tạo phân tử anđehit.
Nhóm định chức – CH = O liên kết với nguyên tử C hoặc H.
+ Anđehit no, đơn chức, mạch hở: C
n
H
2n
O hay C
n-1
H
2n-1
CH = O với
Ví dụ: Dãy đồng đẳng no, đơn, mạch hở:
HCHO: anđehit fomic/fomanđehit/metanal.
CH
3
CHO: anđehit axetic/axetanđehit/etanal.
C
2
H
5
CHO: anđehit propionic/propanal.
+ Anđehit không no, có một liên kết đôi C = C, đơn chức, mạch hở: C
n
H
2n-2
O với .
b. Danh pháp
Tên thông thường = anđehit
+ tên axit tương ứng
(hoặc tên thông thường của axit bỏ “ic” + “anđehit”)
Tên thay thế = Tên IUPAC của hiđrocacbon + al
Ví dụ:
(2-etylbutanal)
c. Đồng phân
Viết các đồng phân cấy tạo C
n
H
2n
O (mạch C, vị trí nhóm chức, loại nhóm chức anđehit). Đồng phân cấu
tạo anđehit đơn chức, no, mạch hở viết tương tự ankan: Mạch C (luôn có nhóm CHO ở đầu mạch), vị trí
nhanh ankyl trong mạch chính (nếu có).
Ngoài ra còn có thể viết đòng phân ancol không no có một nối đôi.
Ví dụ: Ứng với công thức C
4
H
8
O có hai đồng phân anđehit:
CH
3
– CH
2
– CH
2
– CHO
CH
3
– CH(CH
3
) – CHO
2. Tính chất vật lí
Do không có liên kết H nên anđehit có nhiệt độ sôi, độ tan kém hơn ancol tương ứng nhưng cao hơn
hiđrocacbon vì liên kết CO cũng phân cực.
Ví dụ: So sánh nhiệt độ sôi (t
s
) của một số chất:
Chất Công thức t
s
(
°
C)
Propan CH
3
CH
2
CH
3
41,2
Trang 2
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
Propan–1–ol C
2
H
5
CH
2
OH 97,4
Propanal CH
3
CH
2
CHO 48,8
3. Tính chất hóa học
Trong nhóm – CH = O có liên kết đôi C = O gồm một liên kết bền và một liên kết kém bền (tương
tự liên kết đôi C = C trong phân tử anken) nên anđehit có một số tính chất giống anken.
a. Phản ứng cộng H
2
Anđehit + H
2
→ Ancol bậc I
Ví dụ:
b. Phản ứng oxi hóa (tác dụng với nước brom, dung dịch thuốc tím, dung dịch bạc nitrat trong
amoniac, Cu(OH)
2
trong kiềm nóng)
Anđehit + AgNO
3
/NH
3
→ Muối amoni + Ag↓ + NH
4
NO
3
Ví dụ: R – CH = O + 2AgNO
3
+ H
2
O + 3NH
3
→
R – COONH
4
+ 2NH
4
NO
3
+ 2Ag
↓
Trong đó: R – CH = O là chất khử và AgNO
3
là chất oxi hóa.
Kết luận: Anđehit vừa thể hiện tính oxi hóa, vừa thể hiện tính khử.
4. Ứng dụng
HCHO: nguyên liệu sản xuất nhựa, dùng làm chất tẩy uế, dùng trong thuộc da.
CH
3
CHO: sản xuất axit axetic.
Anđehit có nguồn gốc thiên nhiên dùng làm hương liệu.
5. Điều chế
Oxi hóa ancol: Ancol bậc I → Anđehit
Ví dụ: CH
3
CH
2
CH
2
OH + CuO
CH
3
CH
2
CHO + Cu + H
2
O
Oxi hóa hiđrocacbon:
Ví dụ: CH
4
H – CH = O
CH
2
= CH
2
CH
3
CH = O
Trang 3
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85
Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
SƠ ĐỒ HỆ THỐNG HÓA
II. CÁC DẠNG BÀI TẬP
Dạng 1: Đồng phân, danh pháp, tính chất vật lí, ứng dụng
Kiểu hỏi 1: Xác định số đồng phân của anđehit C
n
H
2n
O
Ví dụ mẫu
Ví dụ 1: Ứng với công thức C
3
H
6
O có bao nhiêu đồng phân cấu tạo anđehit?
Hướng dẫn giải
C
3
H
6
O có một đồng phân anđehit no, mạch hở, đơn chức là CH
3
– CH
2
– CHO (propanal).
Ví dụ 2: Có bao nhiêu đồng phân anđehit cấu tạo đơn chức, no của chất có công thức phân tử C
5
H
10
O?
A. 7. B. 3. C. 5. D. 4.
Hướng dẫn giải
C
5
H
10
O có bốn đồng phân anđehit:
CH
3
– CH
2
– CH
2
– CH
2
– CHO
CH
3
– CH
2
– CH(CH
3
) – CHO
CH
3
– CH(CH
3
) – CH
2
– CHO
(CH
3
)
3
C – CHO
→ Chọn D.
Ví dụ 3: Anđehit X có tỉ khối hơi so với H
2
bằng 36. Số đồmg phân cấu tạo có thể có của X là
A. 2. B. 1. C. 3. D. 4.
Hướng dẫn giải
Ta có: M
X
= 36.2 = 72 → Công thức phân tử của X là C
4
H
8
O
→ Anđehit no, đơn chức, mạch hở.
Trang 4
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85

Đây là bản xem thử, vui lòng mua tài liệu để xem chi tiết (có lời giải)
X có hai đồng phân anđehit:
CH
3
– CH
2
– CH
2
– CHO
CH
3
– CH(CH
3
) – CHO
→ Chọn A.
Kiểu hỏi 2: Nhận biết tên gọi và công thức cấu tạo
Ví dụ mẫu
Ví dụ 1: Xác định cấu tạo của chất có tên gọi propan-1-al.
Hướng dẫn giải
Propan-1-al có công thức cấu tạo: CH
3
– CH
2
– CHO.
Ví dụ 2: Anđehit metacrylic có tên IUPAC là 2-metylpropenal. Công thức cấu tạo của hợp chất có tên gọi
trên là
A. CH
3
– CHO. B. CH
3
– CH(CH
3
) – CHO.
C. CH
2
= CH – CHO. D. CH
2
= C(CH
3
) – CHO.
Hướng dẫn giải
Tên IUPAC của anđehit đơn chức = Số chỉ vị trí nhánh
+ tên hiđrocacbon tương ứng với mạch chính
+ al
→ Công thức cấu tạo của 2-metylpropenal là CH
2
= C(CH
3
) – CHO.
→ Chọn D.
Kiểu hỏi 3: So sánh nhiệt độ sôi
Ví dụ mẫu
Ví dụ 1: Sắp xếp nhiệt độ sôi theo thứ tự tăng dần: CH
3
OH, CH
4
, HCHO.
Hướng dẫn giải
Dãy sắp xếp theo thứ tự nhiệt độ sôi tăng dần là: CH
4
< HCHO < CH
3
OH.
Ví dụ 2: Chiều giảm dần nhiệt độ sôi (từ trái qua phải) của các chất: CH
3
CHO, C
2
H
5
OH , H
2
O là:
A. H
2
O, C
2
H
5
OH, CH
3
CHO. B. CH
3
CHO, H
2
O, C
2
H
5
OH.
C. H
2
O, CH
3
CHO, C
2
H
5
OH. D. CH
3
CHO, C
2
H
5
OH, H
2
O.
Hướng dẫn giải
Nhận xét:
CH
3
CHO: không có liên kết H; C
2
H
5
OH: có liên kết H.
H
2
O có liên kết H mạnh hơn C
2
H
5
OH.
→ Nhiệt độ sôi của H
2
O > C
2
H
5
OH > CH
3
CHO.
→ Chọn A.
Kiểu hỏi 4: Nhận biết ứng dụng
Ví dụ mẫu
Trang 5
Mọi thắc mắc vui lòng xin liên hệ hotline: 084 283 45 85