Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có l i ờ gi i ả ) S G Ở IÁO D C Ụ VÀ ĐÀO T O Ạ KỲ THI CH N Ọ H C Ọ SINH GI I Ỏ BÌNH THU N Ậ L P Ớ 12 THPT CẤP T N Ỉ H NĂM H C Ọ 2022 – 2023 ĐỀ CHÍNH TH C Ứ Môn thi: HÓA H C Ọ
(Đề này có 03 trang) Th i
ờ gian: 180 phút (Không kể th i ờ gian phát đ ) ề Đ : Ề
Câu 1 (4,5 đi m) ể 2- 1.1. (1,5 đi m) ể H p ợ chất X đư c ợ c u ấ t o ạ t
ừ cation M3+ và anion YOn . Tổng số hạt proton 2- trong X là 170. T ng ổ số h t
ạ electron trong YOn là 50. Nguyên tố Y (thu c ộ nhóm A) có hóa trị cao nh t ấ trong h p ợ ch t ấ v i ớ oxi g p ấ 3 l n ầ hóa tr ịtrong h p ợ ch t ấ khí v i ớ hidro. Xác đ nh ị công th c ứ phân t ử c a ủ X. 1.2. (1,5 đi m) ể Nêu hi n ệ tư ng ợ và vi t ế phư ng ơ trình hóa h c ọ x y ả ra khi th c ự hi n ệ các thí nghiệm sau: a. Cho m t ộ ít phenol vào ng ố nghi m ệ ch a ứ 2 ml dung d c ị h NaOH đ c ặ , l c ắ đ u ề r i ồ thêm t ừ t ừ dung d c ị h HCl vào và ti p ế t c ụ l c ắ đ u ề . b. Cho kho ng ả 3 - 4 gi t ọ triolein vào ng ố nghi m ệ ch a ứ 2 ml dung d c ị h KOH 10% r i ồ đun nóng. Đ ể ngu i ộ ng ố nghi m, ệ thêm ti p ế 3 - 4 gi t ọ dung d c ị h CuSO4 2%, lắc đ u. ề c. Cho dung d c ị h NH3 1M từ từ đ n ế dư vào ng ố nghi m ệ ch a ứ 2 ml dung d c ị h AlCl3 1M, lắc đ u ề . d. Cho 1-2 gi t ọ brom l ng ỏ vào ng ố nghi m ệ đ ng ự 3 ml benzen, l c ắ đ u, ề r i ồ đ ể ng ố
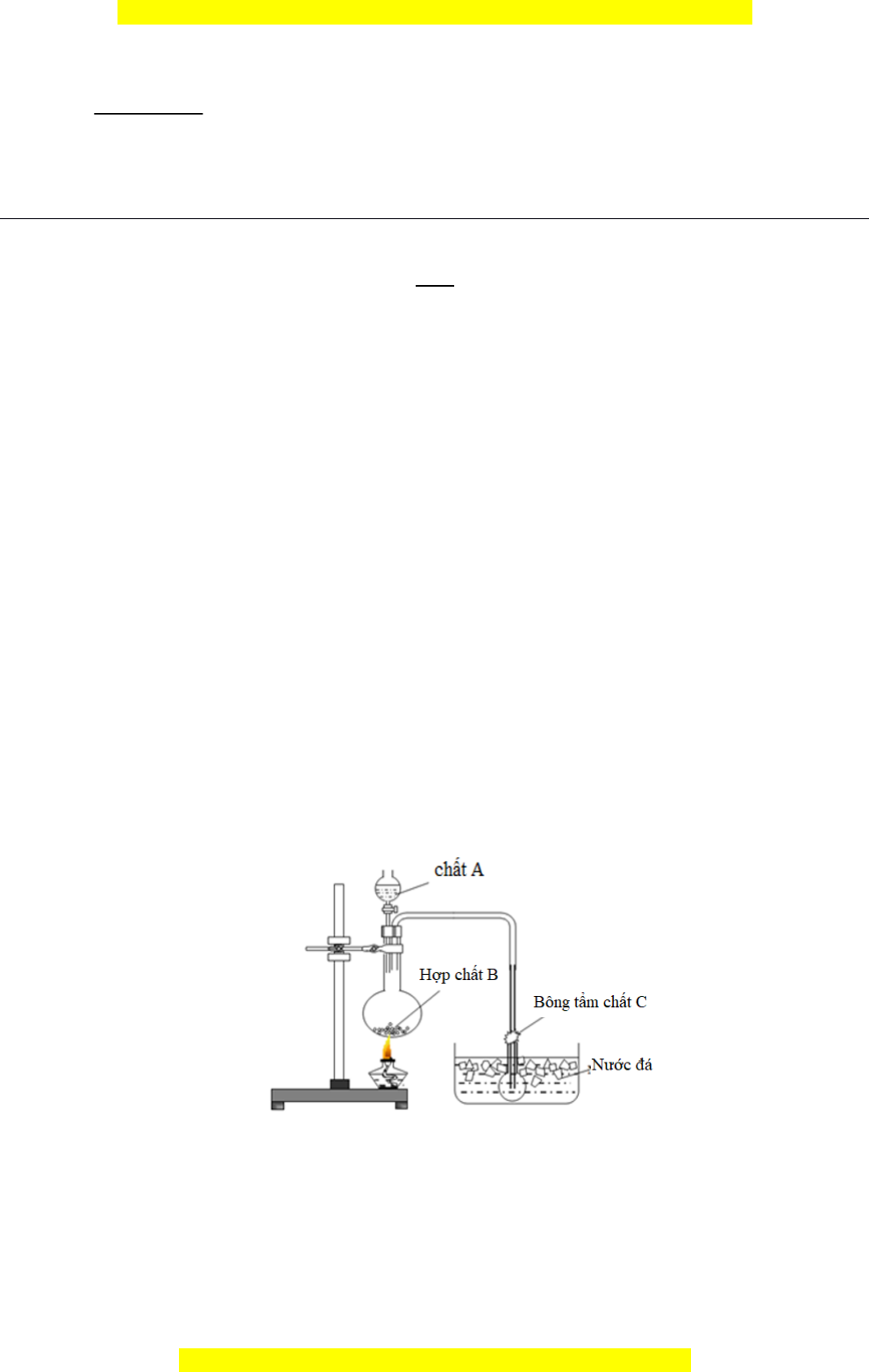
nghiệm trên giá trong 3 phút. Cho thêm ít b t ộ s t ắ vào ng ố nghi m, ệ l c ắ nh ẹ trong 1 phút. 1.3. (1,5 đi m) ể Cho hình v ẽ mô ph ng ỏ thí nghi m ệ nh ư sau: a. Cho bi t ế b ộ d ng ụ c ụ trong hình v ẽ trên có th ể đư c ợ s ử d ng ụ đ ể đi u ề ch ế ch t ấ nào trong s ố các ch t ấ sau: HCl, HBr, HI, HNO3? b. V i ớ mỗi ch t ấ th a ỏ mãn hãy ch n ọ c p ặ ch t ấ A, B phù h p ợ và vi t ế phư ng ơ trình ph n ả ứng xảy ra. c. Nêu vai trò c a ủ ch t ấ C và nư c ớ đá. M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có l i ờ gi i ả )
Câu 2 (4,5 đi m) ể 2.1. (1,5 đi m) ể Có năm ch t
ấ khí A, B, C, D và E. Khí A đư c ợ đi u ề chế b ng ằ cách nung KMnO4 ở nhi t
ệ độ cao, khí B thu đư c ợ ở anot b ng ằ cách đi n ệ phân dung d c ị h mu i ố ăn có màng ngăn, khí C đư c ợ đi u ề chế b ng ằ cách cho oxit s t ắ từ tác d ng ụ v i ớ dung d c ị h H2SO4 đ c ặ nóng, khí D đư c ợ đi u ề chế b ng ằ cách cho s t ắ (II) sunfua tác d ng ụ v i ớ dung d c ị h HCl, khí E thu đư c
ợ khi cho phân ure tác d ng ụ v i ớ nư c ớ vôi trong d . ư a. Xác đ nh ị A, B, C, D, E và vi t ế phư ng ơ trình ph n ả ng ứ x y ả ra. b. Hãy l a ự ch n ọ ch t ấ thích h p ợ đ ể làm khô t ng ừ khí A, C, D, E có l n ẫ h i ơ nư c ớ .
2.2. (1,5 đi m) ể Nung m gam h n ỗ h p ợ X g m
ồ Fe(NO3)2 và NaNO3 (trong bình kín, không có không khí) đ n ế kh i ố lư ng ợ không đ i, ổ thu đư c ợ ch t ấ r n ắ Y và 1,12 lít h n ỗ h p ợ khí Z (đktc). H p ấ th ụ h t ế Z vào nư c ớ , thu đư c ợ 400 ml dung d c ị h E (ch ỉch a ứ m t ộ ch t ấ tan) có pH
= a, không có khí thoát ra. Vi t ế các phư ng ơ trình hóa h c ọ c a ủ ph n ả ng ứ x y ả ra và tính giá trị m, a. 2.3. (1,5 đi m) ể Hòa tan h t
ế 1,69 gam oleum có công th c
ứ H2SO4.3SO3 vào 20,29 gam nư c ớ đư c ợ dung d c ị h X. Trung hòa X c n ầ v a ừ đủ 100,25 gam dung d c ị h Y g m ồ KOH 0,20M và Ba(OH)2 0,10M thu đư c ợ dung d c ị h Z. Tính n ng ồ đ ộ ph n ầ trăm c a ủ dung d c ị h Z.
Câu 3 (4,0 đi m) ể 3.1. (2,0 đi m)
ể Hỗn hợp Z gồm hai chất X và Y. X, Y là hai trong số ba ch t ấ sau: NH4HCO3, NaHCO3 và (NH4)2CO3.
Lấy m gam Z (với số mol X, Y bằng nhau) ti n ế hành các thí nghi m ệ sau: – Thí nghi m ệ 1: Cho Z ph n ả ng ứ v i ớ dung d c
ị h BaCl2 dư, thì có n1 mol BaCl2 phản ứng. – Thí nghi m ệ 2: Cho Z ph n ả ng ứ v i ớ dung d c ị h HCl d , ư thì có n2 mol HCl ph n ả ng. ứ – Thí nghi m ệ 3: Cho Z ph n ả ng ứ v i ớ dung d c ị h NaOH d , ư thì có n3 mol NaOH ph n ả ứng. Bi t ế các ph n ả ng ứ x y
ả ra hoàn toàn và n1 < n2 < n3. a. Lập luận đ ể xác đ nh ị X, Y trong h n ỗ h p ợ Z. b. Vi t ế phư ng ơ trình ion thu g n ọ c a ủ các ph n ả ng ứ trên. c. Bi t
ế n3 = 0,06. Tính giá tr ịn1, n2 và m. d. Trong th c ự ti n ễ , ngư i ờ ta dùng ch t ấ nào trong ba ch t ấ trên để làm b t ộ n ? ở Gi i ả thích.
3.2. (2,0 đi m) ể Hòa tan h t ế 5,990 gam h n ỗ h p ợ X g m
ồ Mg, FexOy, Mg(OH)2 và FeCO3 vào dung d c ị h ch a
ứ 0,115 mol H2SO4 (loãng) và 0,011 mol KNO3, thu đư c ợ dung d c ị h Y chỉ ch a
ứ 15,377 gam các muối sunfat trung hòa và 1,050 gam hỗn h p ợ khí Z g m ồ NO, CO2 và H2. Cho Y ph n ả ng ứ v a ừ đủ v i ớ dung d c ị h NaOH, thu đư c ợ 7,421 gam k t ế t a ủ . M t ặ khác, hòa tan h t ế 5,990 gam X trong dung d c ị h HCl dư, thu đư c ợ dung d c ị h ch a ứ m gam mu i ố và 0,060 mol hỗn h p ợ khí T có tỉ kh i ố so v i ớ H2 là 8,000. Bi t ế các ph n ả ng ứ x y ả ra hoàn toàn. Tính giá trị m.
Câu 4 (3,5 đi m) ể 4.1. (2,0 đi m) ể Cho hai h p ợ ch t ấ h u ữ cơ X, Y đ u ề đ n ơ ch c ứ , m c ạ h h , ở ch a ứ ba nguyên tố M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có l i ờ gi i ả ) (C, H, O) và đ u ề có t ỉl ệ kh i ố lư ng ợ oxi trong phân t ử là 53,33%. Bi t ế MX > MY và X, Y đ u ề tan trong nư c ớ . a. Xác đ nh ị X, Y bi t ế nhi t ệ đ ộ sôi c a ủ X và Y l n ầ lư t ợ là 118oC và -19,3oC. b. Vi t ế phư ng ơ trình phản ng ứ x y ả ra theo s ơ đ ồ sau: Y (1) Y1 (2) Y2 (3) Y3 (4) Y4 (5) Y5 (6) Y6 (7) poli(vinyl axetat) Bi t ế Y1 là ch t ấ có trong c n ồ công nghi p ệ (tuy t ệ đối không u ng ố ) và Y4 là hidrocacbon chi m ế 40 – 50% khí biogas.
4.2. (1,5 đi m)
ể Sục V lít khí axetilen (đktc) vào dung d c
ị h HgSO4 trong H2SO4 loãng, đun nóng ở 80oC m t ộ th i ờ gian thu đư c ợ h n ỗ h p ợ Y (h i ơ và khí). N u ế toàn bộ Y ph n ả ng ứ h t ế v i ớ lư ng ợ dư dung d c
ị h AgNO3 trong NH3 thì thu đư c ợ 8,88 gam k t ế t a ủ . M t ặ khác, d n ẫ Y vào dung d c ị h brom dư thì th y ấ dùng h t ế 250,00 ml dung d c ị h brom 0,20M. Vi t ế phư ng ơ trình hóa h c ọ c a ủ các ph n ả ng ứ x y ả ra và tính hi u ệ su t ấ c a ủ ph n ả ng ứ hidrat hóa trên.
Câu 5 (3,5 đi m) ể 5.1. (1,5 đi m)
ể Dùng dung dịch sát khu n ẩ (thành ph n ầ chính là etanol) là m t ộ trong nh n ữ g cách để phòng d c
ị h Covid-19. Ngoài ra, etanol đư c
ợ dùng thay xăng làm nhiên li u ệ cho đ n ộ g cơ đ t ố trong, như b n ằ g cách ti n
ế hành pha etanol vào xăng truy n ề th n ố g v i ớ t ỉl ệ 5% đ ể đư c ợ xăng E5 (xăng sinh h c ọ ). Các nhà máy s n ả xu t ấ c n ồ tinh khi t
ế dùng để pha xăng E5 thư ng ờ dùng nguyên li u ệ là s n ắ khô đ ể lên men rư u ợ theo s ơ đ ồ sau: (C6H10O5)n H = 60% C6H12O6 H = 75% C2H5OH. Cho bi t ế trong s n ắ khô có 68,00% kh i ố lư ng ợ tinh b t; ộ etanol có kh i ố lư ng ợ riêng là 0,80 g/ml. a. Tính th ể tích etanol 96o đi u ề ch ế đư c ợ t ừ 5,00 t n ấ s n ắ khô trên. b. Giả thi t ế 20% lư ng ợ etanol 96o thu đư c ợ t ừ 5,00 t n ấ s n ắ khô này đư c ợ dùng đ ể pha chế dung d c ị h sát khu n. ẩ Tính thể tích dung d c ị h sát khu n ẩ đư c ợ t o ạ ra, bi t ế r ng ằ để pha chế 10,00 lít dung d c ị h sát khu n ẩ sử d ng ụ trong phòng d c ị h Covid-19, Tổ ch c ứ Y tế Thế gi i ớ WHO gi i ớ thi u ệ m t ộ công th c ứ sau: Dung dịch etanol (rư u ợ etylic) 96o 8333,00 ml Dung dịch hiđro peoxit 3% 417,00 ml Dung dịch glixerol 98% 145,00 ml Nư c ớ cất đã đun sôi, đ ể ngu i ộ Phần còn lại
c. Tại sao xăng sinh h c ọ đư c ợ coi là gi i
ả pháp thay thế cho xăng truy n ề th ng? ố Bi t ế
khi đốt cháy 1,00 kg xăng truy n ề th ng ố thì c n ầ 3,22 kg O2.
5.2. (2,0 đi m) ể Hỗn h p ợ E g m
ồ axit cacboxylic X (không no, hai ch c ứ , m c ạ h h , ở có 3 liên k t ế trong phân t , ử có đ ng ồ phân hình h c
ọ ), hai ancol Y, Z (no, đ n ơ ch c ứ , m c ạ h h , ở k ế ti p ế
nhau, MY < MZ) và este T hai ch c ứ đư c ợ t o ạ b i
ở X và hai ancol Y, Z. Đ t ố cháy a gam h n ỗ h p ợ E, thu đư c
ợ 15,84 gam CO2 và 4,50 gam H2O. M t
ặ khác, khi đun nóng a gam E v i ớ 160,00 ml dung d c ị h NaOH 1,00 M thì đ ể trung hòa NaOH d ư c n ầ 10,00 ml dung d c ị h H2SO4 1,00 M, thu đư c ợ dung d c ị h F. Cô c n ạ F, thu đư c ợ m gam mu i ố khan và 2,02 gam h n ỗ h p ợ G
gồm hai ancol. Cho G tác d ng ụ v i ớ Na d , ư thu đư c
ợ 0,56 lít khí H2 (đktc). Bi t ế các ph n ả ng ứ xảy ra hoàn toàn. a. Tính giá trị m. b. Xác đ nh ị công th c ứ c u ấ t o ạ c a ủ các ch t ấ X, Y, Z và T. M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đây là bản xem th , vu ử i lòng mua tài li u ệ đ xe ể m chi ti t ế (có l i ờ gi i ả ) Cho nguyên t ử kh i ố c a
ủ 1H: 1; 2He: 4; 6C: 12; 7N: 14; 8O: 16; 11Na: 23; 12Mg: 24;
13Al: 27; 14Si: 28; 15P: 31; 16S: 32; 17Cl: 35,5; 19K: 39; 20Ca: 40; 24Cr: 52; 26Fe: 56;
29Cu: 64; 30Zn: 65; 32Ge: 73; 35Br: 80; 40Zr: 91; 47Ag: 108; 53I: 127; 56Ba: 137. ----------H T Ế ---------- H
ọ và tên thí sinh:………………………………….... S ố báo danh:………….
- Thí sinh không đư c ợ phép s ử d n ụ g B n ả g tu n
ầ hoàn các nguyên t ố hóa học.
- Cán bộ coi thi không đư c ợ gi i
ả thích gì thêm. SỞ GIÁO D C Ụ VÀ ĐÀO T O Ạ KỲ THI CH N Ọ HSG L P Ớ 12 C P Ấ T N Ỉ H BÌNH THU N Ậ Năm h c ọ : 2022 – 2023 HƯỚNG D N Ẫ CH M Ấ MÔN HÓA H C Ọ Đ C Ề HÍNH TH C Ứ Câ N i ộ dung Đi m ể u 1 1.1. (1,5 đi m) ể X: M2(YOn)3.
Ta có: 2ZM + 3ZY + 8.3n = 170 (1) 0,25đ Mà ZY + 8n = 48 (2) 0,25đ ZM = 13 0,25đ Vậy M là Al Mặt khác: ZY + 8n = 48 0,25đ
Và nguyên tố Y (nhóm A) có hóa trị cao nh t ấ v i ớ oxi g p ấ 3 l n ầ hóa tr ịtrong h p ợ chất khí v i
ớ hidro nên Y là nguyên t nhóm ố VIA. Lập bảng giá tr : ị n 1 2 3 4 0,25đ ZY 40 32 24 16 loại loại loại ch n ọ Vậy công th c ứ phân t c ử ủa X là Al2(SO4)3. 0,25đ 1.2. (1,5 đi m) ể a. Dung d c ị h t t ừ rong su t ố chuy n s ể ang v n đ ẩ c ụ . 0,25đ
C6H5OH + NaOH → C6H5ONa + H2O (dung d c ị h trong su t ố ).
C6H5ONa + HCl → C6H5OH + NaCl (tái t o phe ạ nol không tan). b. Dung d c ị h thu đư c ợ có màu xanh lam. 0 t
(C17H33COO)3C3H5 + 3KOH 3C17H33COOK + C3H5(OH)3. 0,25đ
CuSO4 + 2KOH → Cu(OH)2 + K2SO4.
2C3H5(OH)3 + Cu(OH)2 → (C3H5(OH)2O)2Cu + 2H2O. 0,25đ
c. Dung dịch xuất hiện kết t a ủ keo trắng, kết t a
ủ không bị tan lại trong NH3 d . ư
3NH3 + 3H2O + AlCl3 → Al(OH)3 + 3NH4Cl. 0,25đ d. Khi chưa có b t ộ s t ắ : dung d c ị h đ ng ồ nh t
ấ , có màu vàng không đ i ổ . Khi cho thêm b t ộ s t ắ vào h n ỗ h p ợ ph n ả ng ứ thì màu ch t ấ l ng ỏ trong ng ố nghi m ệ nh t ạ
màu dần và có khí HBr thoát ra, do ph n ả ng: ứ 0,25đ Fe C 6H6 + Br2 C6H5Br + HBr M i ọ thắc m c
ắ vui lòng xin liên h h
ệ otline: 084 283 45 85
Đề HSG Hóa 12 Bình Thuận năm 2023 có đáp án
2.9 K
1.5 K lượt tải
MUA NGAY ĐỂ XEM TOÀN BỘ TÀI LIỆU
CÁCH MUA:
- B1: Gửi phí vào TK:
1053587071- NGUYEN VAN DOAN - Ngân hàng Vietcombank (QR) - B2: Nhắn tin tới Zalo VietJack Official ( nhấn vào đây ) để xác nhận thanh toán và tải tài liệu - giáo án
Liên hệ ngay Hotline hỗ trợ: 084 283 45 85
Tài liệu được cập nhật liên tục trong gói này từ nay đến hết tháng 3/2024. Chúng tôi đảm bảo đủ số lượng đề đã cam kết hoặc có thể nhiều hơn, tất cả có BẢN WORD, LỜI GIẢI CHI TIẾT và tải về dễ dàng.
Để tải tài liệu gốc về máy bạn click vào nút Tải Xuống ở trên!
Thuộc bộ (mua theo bộ để tiết kiệm hơn):
- Tailieugiaovien.com.vn giới thiệu Đề HSG Hóa 12 Bình Thuận năm 2023 có đáp án.
- File word có lời giải chi tiết 100%.
- Mua trọn bộ sẽ tiết kiệm hơn tải lẻ 50%.
Đánh giá
4.6 / 5(2907 )5
4
3
2
1
Trọng Bình
Tài liệu hay
Giúp ích cho tôi rất nhiều
Duy Trần
Tài liệu chuẩn
Rất thích tài liệu bên VJ soạn (bám sát chương trình dạy)
TÀI LIỆU BỘ BÁN CHẠY MÔN Hóa Học
Xem thêmTÀI LIỆU BỘ BÁN CHẠY Lớp 12
Xem thêmTài liệu bộ mới nhất
Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
S GIÁO D C VÀ ĐÀO T O Ở Ụ Ạ KỲ THI CH N H C SINH GI I Ọ Ọ Ỏ
BÌNH THU NẬ L P 12 THPT C P T NHỚ Ấ Ỉ
NĂM H C 2022 – 2023Ọ
Đ CHÍNH TH CỀ Ứ Môn thi: HÓA H CỌ
(Đ này có 03 trang)ề Th i gian: 180 phút ờ (Không k th i gian phát đ )ể ờ ề
Đ :Ề
Câu 1 (4,5 đi m)ể
1.1. (1,5 đi m) ể H p ch t X đ c c u t o t cation Mợ ấ ượ ấ ạ ừ
3+
và anion
2-
n
YO
. T ng s h t protonổ ố ạ
trong X là 170. T ng s h t electron trong ổ ố ạ
2-
n
YO
là 50. Nguyên t Y (thu c nhóm A) có hóaố ộ
tr cao nh t trong h p ch t v i oxi g p 3 l n hóa tr trong h p ch t khí v i hidro. Xác đ nhị ấ ợ ấ ớ ấ ầ ị ợ ấ ớ ị
công th c phân t c a X.ứ ử ủ
1.2. (1,5 đi m)ể Nêu hi n t ng và vi t ph ng trình hóa h c x y ra khi th c hi n các thíệ ượ ế ươ ọ ả ự ệ
nghi m sau:ệ
a. Cho m t ít phenol vào ng nghi m ch a 2 ml dung d ch NaOH đ c, l c đ u r iộ ố ệ ứ ị ặ ắ ề ồ
thêm t t dung d ch HCl vào và ti p t c l c đ u.ừ ừ ị ế ụ ắ ề
b. Cho kho ng 3 - 4 gi t triolein vào ng nghi m ch a 2 ml dung d ch KOH 10% r iả ọ ố ệ ứ ị ồ
đun nóng. Đ ngu i ng nghi m, thêm ti p 3 - 4 gi t dung d ch CuSOể ộ ố ệ ế ọ ị
4
2%, l c đ u.ắ ề
c. Cho dung d ch NHị
3
1M t t đ n d vào ng nghi m ch a 2 ml dung d ch AlClừ ừ ế ư ố ệ ứ ị
3
1M, l c đ u.ắ ề
d. Cho 1-2 gi t brom l ng vào ng nghi m đ ng 3 ml benzen, l c đ u, r i đ ngọ ỏ ố ệ ự ắ ề ồ ể ố
nghi m trên giá trong 3 phút. Cho thêm ít b t s t vào ng nghi m, l c nh trong 1 phút.ệ ộ ắ ố ệ ắ ẹ
1.3. (1,5 đi m)ể
Cho hình v mô ph ng thí nghi m nh sau:ẽ ỏ ệ ư
a. Cho bi t b d ng c trong hình v trên có th đ c s d ng đ đi u ch ch t nàoế ộ ụ ụ ẽ ể ượ ử ụ ể ề ế ấ
trong s các ch t sau: HCl, HBrố ấ
,
HI, HNO
3
?
b. V i m i ch t th a mãn hãy ch n c p ch t A, B phù h p và vi t ph ng trình ph nớ ỗ ấ ỏ ọ ặ ấ ợ ế ươ ả
ng x y ra. ứ ả
c. Nêu vai trò c a ch t C và n c đá.ủ ấ ướ
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
Câu 2 (4,5 đi m)ể
2.1. (1,5 đi m) ể Có năm ch t khí A, B, C, D và E. Khí A đ c đi u ch b ng cách nungấ ượ ề ế ằ
KMnO
4
nhi t đ cao, khí B thu đ c anot b ng cách đi n phân dung d ch mu i ăn cóở ệ ộ ượ ở ằ ệ ị ố
màng ngăn, khí C đ c đi u ch b ng cách cho oxit s t t tác d ng v i dung d ch Hượ ề ế ằ ắ ừ ụ ớ ị
2
SO
4
đ c nóng, ặ
khí D đ c đi u ch b ng cách cho s t (II) sunfua tác d ng v i dung d ch HCl, khí E thuượ ề ế ằ ắ ụ ớ ị
đ c khi cho phân ure tác d ng v i n c vôi trong d .ượ ụ ớ ướ ư
a. Xác đ nh A, B, C, D, E và vi t ph ng trình ph n ng x y ra.ị ế ươ ả ứ ả
b. Hãy l a ch n ch t thích h p đ làm khô t ng khí A, C, D, E có l n h i n c.ự ọ ấ ợ ể ừ ẫ ơ ướ
2.2. (1,5 đi m) ể Nung m gam h n h p X g m Fe(NOỗ ợ ồ
3
)
2
và NaNO
3
(trong bình kín, không
có không khí) đ n kh i l ng không đ i, thu đ c ch t r n Y và 1,12 lít h n h p khí Zế ố ượ ổ ượ ấ ắ ỗ ợ
(đktc). H p th h t Z vào n c, thu đ c 400 ml dung d ch E (ch ch a m t ch t tan) có pHấ ụ ế ướ ượ ị ỉ ứ ộ ấ
= a, không có khí thoát ra. Vi t các ph ng trình hóa h c c a ph n ng x y ra và tính giá trế ươ ọ ủ ả ứ ả ị
m, a.
2.3. (1,5 đi m) ể Hòa tan h t 1,69 gam oleum có công th cế ứ H
2
SO
4
.3SO
3
vào 20,29 gam n cướ
đ c dung d ch X. Trung hòa X c n v a đ 100,25 gam dung d ch Y g m KOH 0,20M vàượ ị ầ ừ ủ ị ồ
Ba(OH)
2
0,10M thu đ c dung d ch Z. Tính n ng đ ph n trăm c a dung d ch Z. ượ ị ồ ộ ầ ủ ị
Câu 3 (4,0 đi m)ể
3.1. (2,0 đi m)ể H n h p Z g m hai ch t X và Y. X, Y là hai trong s ba ch t sau:ỗ ợ ồ ấ ố ấ
NH
4
HCO
3
, NaHCO
3
và (NH
4
)
2
CO
3
.
L y m gam Z (v i s mol X, Y b ng nhau) ti n hành các thí nghi m sau:ấ ớ ố ằ ế ệ
– Thí nghi m 1: Cho Z ph n ng v i dung d ch BaClệ ả ứ ớ ị
2
d , thì có nư
1
mol BaCl
2
ph nả
ng.ứ
– Thí nghi m 2: Cho Z ph n ng v i dung d ch HCl d , thì có nệ ả ứ ớ ị ư
2
mol HCl ph n ng.ả ứ
– Thí nghi m 3: Cho Z ph n ng v i dung d ch NaOH d , thì có nệ ả ứ ớ ị ư
3
mol NaOH ph nả
ng.ứ
Bi t các ph n ng x y ra hoàn toàn và nế ả ứ ả
1
< n
2
< n
3
.
a. L p lu n đ xác đ nh X, Y trong h n h p Z.ậ ậ ể ị ỗ ợ
b. Vi t ph ng trình ion thu g n c a các ph n ng trên.ế ươ ọ ủ ả ứ
c. Bi t nế
3
= 0,06. Tính giá tr nị
1
, n
2
và m.
d. Trong th c ti n, ng i ta dùng ch t nào trong ba ch t trên đ làm b t n ? Gi iự ễ ườ ấ ấ ể ộ ở ả
thích.
3.2. (2,0 đi m) ể Hòa tan h t ế 5,990 gam h n h p X g m Mgỗ ợ ồ , Fe
x
O
y
, Mg(OH)
2
và FeCO
3
vào dung d ch ch a 0,ị ứ 115 mol H
2
SO
4
(loãng) và 0,011 mol KNO
3
, thu đ c dung d ch Y ượ ị chỉ
ch a ứ 15,377 gam các mu iố sunfat trung hòa và 1,050 gam h n h p khí Z g m ỗ ợ ồ NO, CO
2
và
H
2
. Cho Y ph n ng v a đ v i dung d ch NaOH, thu đ c ả ứ ừ ủ ớ ị ượ 7,421 gam k t t a. M t khácế ủ ặ ,
hòa tan h t ế 5,990 gam X trong dung d ch HCl dị ư, thu đ c dung d ch ch a m gam mu i vàượ ị ứ ố
0,060 mol h n h p khí ỗ ợ T có t kh i so v i ỉ ố ớ H
2
là 8,000. Bi t các ph n ng x y ra hoàn toàn.ế ả ứ ả
Tính giá tr m.ị
Câu 4 (3,5 đi m)ể
4.1. (2,0 đi m) ể Cho hai h p ch t h u c X, Y đ u đ n ch c, m ch h , ch a ba nguyênợ ấ ữ ơ ề ơ ứ ạ ở ứ
t ố
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
(C, H, O) và đ u có t l kh i l ng oxi trong phân t là 53,33%. Bi t Mề ỉ ệ ố ượ ử ế
X
> M
Y
và X, Y đ uề
tan trong n c.ướ
a. Xác đ nh X, Y bi t nhi t đ sôi c a X và Y l n l t là 118ị ế ệ ộ ủ ầ ượ
o
C và -19,3
o
C.
b. Vi t ph ng trình ph n ng x y ra theo s đ sau:ế ươ ả ứ ả ơ ồ
Y
(1)
Y
1
(2)
Y
2
(3)
Y
3
(4)
Y
4
(5)
Y
5
(6)
Y
6
(7)
poli(vinyl axetat)
Bi t Yế
1
là ch t có trong c n công nghi p (tấ ồ ệ uy t đ i không u ngệ ố ố ) và Y
4
là hidrocacbon
chi m 40 – 50% khí biogas.ế
4.2. (1,5 đi m) ể S c V lít khí axetilen (đktc) vào dung d ch HgSOụ ị
4
trong H
2
SO
4
loãng, đun
nóng 80ở
o
C m t th i gian thu đ c h n h p Y (h i và khí). N u toàn b Y ph n ng h tộ ờ ượ ỗ ợ ơ ế ộ ả ứ ế
v i l ng d dung d ch AgNOớ ượ ư ị
3
trong NH
3
thì thu đ c 8,88 gam k t t a. M t khác, d n Yượ ế ủ ặ ẫ
vào dung d ch brom d thì th y dùng h t 250,00 ml dung d ch brom 0,20M. Vi t ph ngị ư ấ ế ị ế ươ
trình hóa h c c a các ph n ng x y ra và tính hi u su t c a ph n ng hidrat hóa trên.ọ ủ ả ứ ả ệ ấ ủ ả ứ
Câu 5 (3,5 đi m)ể
5.1. (1,5 đi m) ể Dùng dung d ch sát khu n (ị ẩ thành ph n chính là etanol) là m t trong nh ngầ ộ ữ
cách đ phòng d ch Covid-19. Ngoài ra, etanol đ c dùng thay xăng làm nhiên li u cho đ ng cể ị ượ ệ ộ ơ
đ t trong, nh b ng cách ti n hành pha etanol vào xăng truy n th ng v i t l 5% đ đ c xăngố ư ằ ế ề ố ớ ỉ ệ ể ượ
E5 (xăng sinh h c). ọ Các nhà máy s n xu t c n tinh khi t dùng đả ấ ồ ế pha xăng E5 thể ư ngờ dùng
nguyên li u là s n khô đ lên men r u theo s đ sau:ệ ắ ể ượ ơ ồ
(C
6
H
10
O
5
)
n
H = 60%
C
6
H
12
O
6
H = 75%
C
2
H
5
OH.
Cho bi t trong s n khô có 68,00% kh i l ng tinh b t; etanol có kh i l ng riêng là 0,80ế ắ ố ượ ộ ố ượ
g/ml.
a. Tính th tích etanol 96ể
o
đi u ch đ c t 5,00 t n s n khô trên.ề ế ượ ừ ấ ắ
b. Gi thi t 20% l ng etanol 96ả ế ượ
o
thu đ c t 5,00 t n s n khô này đ c dùng đ phaượ ừ ấ ắ ượ ể
ch dung d ch sát khu n. Tính th tích dung d ch sát khu n đ c t o ra, bi t r ng đế ị ẩ ể ị ẩ ượ ạ ế ằ phaể
ch 10,00 lít dung d ch sát khu n s d ng trong phòng d ch Covid-19, T ch c Y t Thế ị ẩ ử ụ ị ổ ứ ế ế
gi i WHO gi i thi u m t công th c sau:ớ ớ ệ ộ ứ
Dung d ch etanol (r u etylic) 96ị ượ
o
8333,00 ml
Dung d ch hiđro peoxit 3%ị 417,00 ml
Dung d ch glixerol 98%ị 145,00 ml
N c c t đã đun sôi, đ ngu iướ ấ ể ộ Ph n còn l iầ ạ
c. T i sao xăng sinh h c đ c coi là gi i pháp thay th cho xăng truy n th ng? Bi tạ ọ ượ ả ế ề ố ế
khi đ t cháy 1,00 kg xăng truy n th ng thì c n 3,22 kg Oố ề ố ầ
2
.
5.2. (2,0 đi m) ể H n h p E g m axit cacboxylic X (không no, hai ch c, m ch h , có 3 liênỗ ợ ồ ứ ạ ở
k t ế trong phân t , có đ ng phân hình h c), hai ancol Y, Z (no, đ n ch c, m ch h , k ti pử ồ ọ ơ ứ ạ ở ế ế
nhau, M
Y
< M
Z
) và este T hai ch c đ c t o b i Xứ ượ ạ ở và hai ancol Y, Z. Đ t cháy a gam h nố ỗ
h p E, thu đ c 15,84 gam COợ ượ
2
và 4,50 gam H
2
O. M t khác, khi đun nóng a gam E v iặ ớ
160,00 ml dung d ch NaOH 1,00 M thì đ trung hòa NaOH d c n 10,00 ml dung d ch Hị ể ư ầ ị
2
SO
4
1,00 M, thu đ c dung d ch F. Cô c n F, thu đ c m gam mu i khan và 2,02 gam h n h p Gượ ị ạ ượ ố ỗ ợ
g m hai ancol. Cho G tác d ng v i Na d , thu đ c 0,56 lít khí Hồ ụ ớ ư ượ
2
(đktc). Bi t các ph n ngế ả ứ
x y ra hoàn toàn. ả
a. Tính giá tr m.ị
b. Xác đ nh công th c c u t o c a các ch t ị ứ ấ ạ ủ ấ X, Y, Z và T.
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ
Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
Cho nguyên t kh i c a ử ố ủ
1
H: 1;
2
He: 4;
6
C: 12;
7
N: 14;
8
O: 16;
11
Na: 23;
12
Mg: 24;
13
Al: 27;
14
Si: 28;
15
P: 31;
16
S: 32;
17
Cl: 35,5;
19
K: 39;
20
Ca: 40;
24
Cr: 52;
26
Fe: 56;
29
Cu: 64;
30
Zn: 65;
32
Ge: 73;
35
Br: 80;
40
Zr: 91;
47
Ag: 108;
53
I: 127;
56
Ba: 137.
----------H TẾ ----------
H và tên thí sinh:………………………………….... S báo danh:………….ọ ố
- Thí sinh không đ c phép s d ng B ng tu n hoàn các nguyên t hóa ượ ử ụ ả ầ ố
h c. ọ
- Cán b coi thi không đ c gi i thích gì thêm.ộ ượ ả
S GIÁO D C VÀ ĐÀO T OỞ Ụ Ạ KỲ THI CH N HSG L P 12 C P T NHỌ Ớ Ấ Ỉ
BÌNH THU NẬ Năm h c: 2022 – 2023ọ
H NG D N CH M MÔN HÓA H CƯỚ Ẫ Ấ Ọ
Đ CHÍNH TH CỀ Ứ
Câ
u
N i dungộ Đi mể
1 1.1. (1,5 đi m)ể
X: M
2
(YO
n
)
3
.
Ta có: 2Z
M
+ 3Z
Y
+ 8.3n = 170 (1)
Mà Z
Y
+ 8n = 48 (2)
Z
M
= 13
V y M là Alậ
M t khác: Zặ
Y
+ 8n = 48
Và nguyên t Y (nhóm A) có hóa tr cao nh t v i oxi g p 3 l n hóa tr trong h pố ị ấ ớ ấ ầ ị ợ
ch t khí v i hidro nên Y là nguyên t nhóm VIA.ấ ớ ố
L p b ng giá tr :ậ ả ị
n 1 2 3 4
Z
Y
40
lo iạ
32
lo iạ
24
lo iạ
16
ch nọ
V y công th c phân t c a X là Alậ ứ ử ủ
2
(SO
4
)
3
.
0,25đ
0,25đ
0,25đ
0,25đ
0,25đ
0,25đ
1.2. (1,5 đi m)ể
a. Dung d ch t trong su t chuy n sang v n đ c.ị ừ ố ể ẩ ụ
C
6
H
5
OH + NaOH → C
6
H
5
ONa + H
2
O (dung d ch trong su t).ị ố
C
6
H
5
ONa + HCl → C
6
H
5
OH + NaCl (tái t o phenol không tan).ạ
b. Dung d ch thu đ c có màu xanh lam. ị ượ
(C
17
H
33
COO)
3
C
3
H
5
+ 3KOH
0
t
3C
17
H
33
COOK + C
3
H
5
(OH)
3
.
CuSO
4
+ 2KOH → Cu(OH)
2
+ K
2
SO
4.
2C
3
H
5
(OH)
3
+ Cu(OH)
2
→ (C
3
H
5
(OH)
2
O)
2
Cu + 2H
2
O.
c. Dung d ch xu t hi n k t t a keo tr ng, k t t a không b tan l i trong NHị ấ ệ ế ủ ắ ế ủ ị ạ
3
d .ư
3NH
3
+ 3H
2
O + AlCl
3
→ Al(OH)
3
+ 3NH
4
Cl.
d. Khi ch a có b t s t: dung d ch đ ng nh t, có màu vàng không đ i. Khi choư ộ ắ ị ồ ấ ổ
thêm b t s t vào h n h p ph n ng thì màu ch t l ng trong ng nghi m nh tộ ắ ỗ ợ ả ứ ấ ỏ ố ệ ạ
màu d n và có khí HBr thoát ra, do ph n ng: ầ ả ứ
C
6
H
6
+ Br
2
Fe
C
6
H
5
Br + HBr
0,25đ
0,25đ
0,25đ
0,25đ
0,25đ
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ

Đây là b n xem th , vui lòng mua tài li u đ xem chi ti t (có l i gi i)ả ử ệ ể ế ờ ả
Câ
u
N i dungộ Đi mể
0,25đ
1.3. (1,5 đi m)ể
a. B d ng c trong hình v trên đ c s d ng đ đi u ch HCl, HNOộ ụ ụ ẽ ượ ử ụ ể ề ế
3
.
b. Đi u ch HCl: ề ế A: H
2
SO
4
đ c, B: NaCl r n (hay KCl r n…). ặ ắ ắ
Đi u ch HNOề ế
3
: A: H
2
SO
4
đ c, B: NaNOặ
3
r n (hay KNOắ
3
r n...).ắ
Ph ng trình ph n ng:ươ ả ứ
NaCl + H
2
SO
4 đ
o
t
NaHSO
4
+ HCl
NaNO
3
+ H
2
SO
4 đ
o
t
NaHSO
4
+ HNO
3
c. Ch t C: NaOH hay Ca(OH)ấ
2
(dung d ch) h p th HNOị ấ ụ
3
ho c HCl d ng h i bayặ ạ ơ
ra, không gây ô nhi m không khí.ễ
N c đá đ ng ng t HNOướ ể ư ụ
3
ho c HCl d ng h i.ặ ạ ơ
0,25đ
0,25đ
0,25đ
0,25đ
0,25đ
0,25đ
2 2.1. (1,5 đi m)ể
a. Khí A: O
2
2KMnO
4
0
t
K
2
MnO
4
+ MnO
2
+ O
2
Khí B: Cl
2
2NaCl + 2H
2
O
dpdd
cmn
2NaOH + Cl
2
+ H
2
Khí C: SO
2
2Fe
3
O
4
+ 10H
2
SO
4
đ
0
t
3Fe
2
(SO
4
)
3
+ SO
2
+ 10H
2
O
Khí D: H
2
S
FeS + 2HCl → FeCl
2
+ H
2
S
Khí E: NH
3
(NH
2
)
2
CO + 2H
2
O → (NH
4
)
2
CO
3
(NH
4
)
2
CO
3
+ Ca(OH)
2
→ CaCO
3
+ 2NH
3
+ 2H
2
O
b. Làm khô NH
3
, H
2
S dùng CaCl
2
khan …
Làm khô O
2
, SO
2
dùng CaCl
2
khan ho c Hặ
2
SO
4 đ cặ
…
0,25đ
0,25đ
0,25đ
0,25đ
0,25đ
0,25đ
2.2. (1,5 đi m)ể
Ph ng trình hóa h c c a các ph n ng: ươ ọ ủ ả ứ
(1) 4Fe(NO
3
)
2
o
t
2Fe
2
O
3
+ 8NO
2
+ O
2
(2) 2NaNO
3
o
t
2NaNO
2
+ O
2
(3) 4NO
2
+ O
2
+ 2H
2
O → 4HNO
3
Dung d ch E ch ch a 1 ch t tan là HNOị ỉ ứ ấ
3
→ NO
2
ph n ng v a đ v i Oả ứ ừ ủ ớ
2
t oạ
thành HNO
3
→
2 2
NO O
n = 4.n
0,5đ/3pt
0,25đ
0,25đ
M i th c m c vui lòng xin liên h hotline: 084 283 45 85ọ ắ ắ ệ







